Nogo-A受体在早期神经元细胞分化过程中的表达
2015-05-20何主强杨国平赵洪洋
何主强,杨国平,赵洪洋
Nogo-A受体在早期神经元细胞分化过程中的表达
何主强1,杨国平1,赵洪洋2
目的:探讨在早期神经元细胞生长发育过程中Nogo-A受体(NG-R)的表达变化。方法:体外培养PC12细胞,实验组加入50 ng/mL细胞生长因子(NGF)进行诱导分化1、3、5、7 d,对照组中不加入NGF诱导分化。于不同时间点镜下观察细胞轴突发育及细胞分化情况,免疫荧光法观察NG-R蛋白在PC12细胞中的表达与定位,RT-PCR法检测NG-R mRNA在PC12细胞中的表达变化,western blot法检测NG-R蛋白在PC12细胞中的表达变化。结果:随着诱导分化时间的增加,实验组PC12细胞轴突发育及细胞分化增加;对照组PC12细胞未检测出NG-R mRNA及蛋白表达;实验组随着NGF诱导刺激时间延长,PC12细胞内NG-R mRNA及蛋白表达量逐步增加,组间差异有统计学意义,且均高于对照组(P<0.05或0.01),但实验组诱导1 d PC12细胞内NG-R蛋白表达量与对照组差异无统计意义(P>0.05)。结论:在神经元发育早期NG-R的表达随着轴突生长逐渐升高。
PC12细胞;Nogo-A受体;细胞分化
Nogo-A是一种髓鞘蛋白,在成熟中枢神经系统中主要功能是抑制神经突生长[1]。在成熟脑组织和脊索,少突胶质细胞表达Nogo-A受体(Nogo-A receptor,NG-R)分子,通过与Nogo-A结合抑制轴突的再生[1]。NG-R是一种糖基磷脂酰肌醇锚定蛋白,Nogo-A与NG-R的细胞外结构域Nogo-66结合[2]。除了少突胶质细胞,NG-R在外周和中枢神经系统,尤其是早期发育的神经系统中也有表达[3],其与Nogo-A相互作用机制仍不完全清楚。
PC12细胞株是从大鼠嗜铬细胞瘤中提取的具有分化潜能的儿茶酚胺瘤细胞,在神经生长因子(nerve growth factor,NGF)诱导下可分化为交感神经细胞。PC12细胞常被用作神经元细胞分化与分裂的细胞模型[4]。本研究用NGF诱导PC12细胞分化建立实验模型,检测NG-R的表达变化。
1 材料与方法
1.1 材料
1.1.1 细胞PC12细胞株由同济医学院组织学与胚胎学教研室惠赠。
1.1.2 主要试剂与材料高糖DMEM培养基购于Gibco公司,NGF购于Sigma公司,羊抗Ng-R多克隆抗体、人抗鼠β-actin抗体、辣根过氧化物酶标记鼠抗羊抗体/鼠抗人抗体均购于Santa Cruz公司,免疫荧光染色试剂盒购于Sigma公司;引物由北京奥科生物技术有限责任公司合成;GDS-8000型全自动凝胶成像分析系统购于英国UVP公司。
1.2 方法
1.2.1 细胞株培养PC12细胞株,高糖DMEM培养基中加入5%马血清、10%灭活胎牛血清,37℃,饱和湿度,5%CO2,95%空气培养箱中培养,培养3 d后,半量换液。
1.2.2 RT-PCR选取的内参照物为:大鼠3-磷酸甘油醛脱氢酶(G3PDH),上游的引物序列:5’ATCCCGCTAACATCAAAT 3’(1085-1103);下游的引物序列:5’TCCAGGGTTTCTTACTCC 3’(1862-1880),扩增778 bp。NG-R上游引物序列:5’CAATGAGCCCAAGGTGACGA3’(303-323);下游引物序列:5’TGCATTATCGCTGAGGTCCAG3’(549-570),扩增247 bp。全自动凝胶成像分析系统分析条带灰度值,计算NG-R/G3PDH灰度比值。
1.2.3 Western blot提取细胞总蛋白,Bradford法检测蛋白浓度,10%SDS-聚丙烯酰胺凝胶电泳,转膜,37℃3%小牛血清白蛋白封闭2 h,分别加羊抗Ng-R多克隆抗体、人抗鼠β-actin抗体(1:500),4℃孵育过夜。加辣根过氧化物酶标记鼠抗羊抗体/鼠抗人抗体(1:200)室温孵育1 h,增强化学发光显色液显色。全自动凝胶成像分析系统对蛋白条带扫描定量分析,计算NG-R/β-actin灰度值。
1.2.4 细胞爬片将细胞进行爬片并随机分为2组。当细胞生长覆盖载玻片80%左右时,实验组加入50 ng/mL NGF进行诱导分化1、3、5、7 d,对照组中不加入NGF诱导分化。
1.2.5 轴突发育及细胞分化在倒置相差显微镜下观察细胞爬片,随机选取20个视野进行拍照计数。计数标准:有突起的细胞,或轴突突起长度>细胞体直径2倍,或突起数目>3个,计数每种细胞占总细胞的百分比。
1.2.6 免疫荧光染色在相应时间点,按免疫荧光染色试剂盒说明书进行免疫荧光染色操作,加入的NG-R抗体稀释比例为1:50。阳性细胞为细胞浆和(或)细胞核内有荧光染色。共聚焦荧光显微镜拍照,彩色医学图文分析系统进行数据统计。
1.3 统计学处理
2 结果
2.1 细胞分化与轴突比较
随着诱导分化时间的增加,有轴突生长细胞百分比逐渐增加,组间差异均有统计学意义(P<0.05);诱导分化3 d开始,出现轴突突起长度>细胞体直径2倍及突起数目>3个的细胞,这2种细胞百分比逐渐增加,组间差异均有统计学意义(P<0.05);见表1。
2.2 NG-R蛋白在PC12细胞中的表达与定位
对照组细胞浆和细胞核中无荧光着色;实验组随着NGF诱导时间延长,可见轴突逐步生长,PC12细胞浆中荧光着色逐渐增强,NGF诱导7 d后NG-R蛋白表达呈强阳性,见图1。
2.3 NG-R mRNA在PC12细胞诱导分化中的表达变化
RT-PCR检测结果显示对照组PC12细胞未检测出NG-R mRNA表达;实验组随着NGF诱导时间延长,PC12细胞内NG-R mRNA表达量逐步增加,组间差异有统计学意义,且均高于对照组(P<0.05或0.01),见图2,表2。
2.4 NG-R蛋白在PC12细胞中的表达量Western blot检测结果显示对照组PC12细胞中无NG-R蛋白表达;实验组随着NGF诱导时间延长,PC12细胞内NG-R蛋白表达逐渐增加,组间差异有统计学意义(P<0.05或0.01),但实验组诱导1 d PC12细胞内NG-R蛋白表达量与对照组差异无统计意义,见图3,表2。
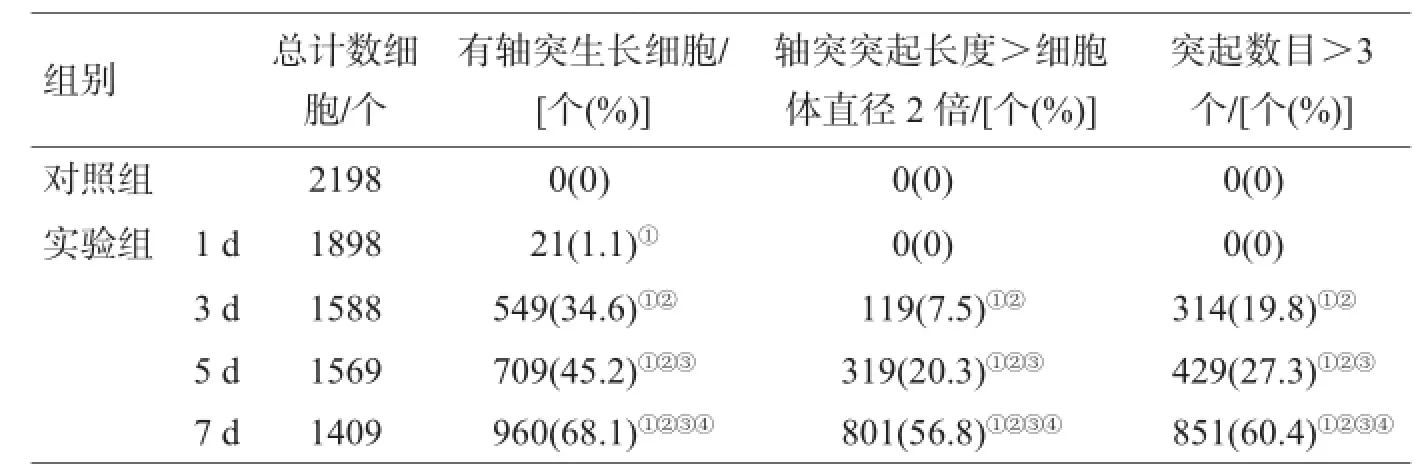
表1 各组细胞计数及百分比比较

图1 各组PC12细胞中NG-R蛋白的表达与定位

图2 PC12细胞分化过程中各组NG-R mRNA表达量

图3 PC12细胞分化过程中各组NG-R蛋白表达量
表2 各组中NG-R mRNA及蛋白表达量

表2 各组中NG-R mRNA及蛋白表达量
注:与对照组比较,①P<0.01;与实验组诱导分化1 d比较,②P<0.05;与实验组诱导分化3 d比较,③P<0.05;与实验组诱导分化5 d比较,④P<0.05
?
3 讨论
在胚胎形成早期,NG-R与Nogo-A在不同的物种都有高表达[3,5,6],它在巨大神经元轴突的表达提示神经元上的NG-R通过与Nogo-A结合在轴突形成和突触发生过程中起重要作用[5]。体外实验也表明NG-R通过与Nogo-A结合在皮质前体细胞的放射状迁移中起重要作用[7]。
本研究结果表明对照组无NG-R表达,实验组随着NGF诱导时间延长NG-R表达逐渐升高。诱导1 d组较对照组NG-R mRNA有明显升高(P<0.01),而NG-R蛋白无明显表达;诱导3 d组NG-R mRNA升高同时开始出现NG-R蛋白表达,提示在神经元分化过程首先启动NG-R mRNA逆转录,然后开始进行NG-R蛋白合成。该研究中NG-R表达趋势与前期研究中Nogo-A表达趋势一致[8]。随着NGF诱导分化时间延长,轴突生长数量及长度均增加,且NG-R mRNA表达逐渐增高,提示NG-R与神经元的发育密切相关。O’Neill等[9]的研究发现鸡胚发育早期在髓鞘化开始之前,Ng-R和Nogo-A就有表达,随着髓鞘的出现,Ng-R和Nogo-A在神经元的表达下降。因此,神经元失去再生潜能可能与Ng-R和Nogo-A在细胞定位的改变有关。可能只有在成熟少突胶质细胞表达的Ng-R和Nogo-A起抑制作用。Hasegawa等[10]的研究发现在胚胎早期的Ng-R和Nogo-A表达并不抑制海马神经元轴突的生长,Ng-R与Nogo-A的表达在早期中枢神经中与神经环路连接的发育密切相关,Ng-R在早期神经系统的形成中扮演了重要角色。
最近研究认为,成年哺乳动物中枢神经轴突再生障碍一部分是源自抑制髓鞘再生相关的分子,如Nogo-A、少突胶质细胞髓鞘糖蛋白(oligodendrocyte myelin glycoprotein,OMGp)及髓鞘相关糖蛋白(myelin associated glycoprotein,MGA),它们都是通过同一受体Ng-R介导[11]。在胚胎发育早期MGA促进神经生长,在成熟中枢神经系统中则抑制神经再生,它的功能转变主要依赖于环磷酸腺苷(cyclic adenosine monophosphate,cAMP)水平的改变。胶质细胞源性神经营养因子或脑源性神经营养因子等神经营养因子可刺激升高cAMP水平,从而阻止MGA抑制轴突生长的作用。本研究结果表明在早期神经元发育过程中随着轴突生长,NG-R的表达亦增加,NG-R可能介导的不是抑制而是促进神经轴突生长。NG-R功能如何转变的外部调节机制还不明确。然而,在早期神经发育过程中Ng-R是否也介导Nogo-A在一定条件下促进或抑制轴突生长的调节机制还有待深入研究。
[1]Chen MS,Huber AB,Vander Harr ME,et al. Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1[J].Nature,2000,403:434-439.
[2]Al Halabiah H,Delezoide AL,Cardona A,et al.Expression pattern of Nogo and NgR genes during human development[J].Gene Expr Patterns,2005,5:561-568.
[3]Huber AB,Weinmann O,Brösamle C,et al. Patterns of Nogo mRNA and protein expression in the developing and adult rat and after CNS lesions[J].J Neurosci,2002,22:3553-3567.
[4]Powers JF,Shahsavari M,Tsokas P,et al. Nerve growth factor receptor signaling in proliferation of normal adult rat chromaffin cells[J]. Cell Tissue Res,1999,295:21-32.
[5]Caltharp SA,Pira CU,Mishima N,et al.Nogo-A induction and localization during chick brain development in dicatea role disparate from neurite outgrowth inhibition[J].BMC Dev Biol, 2007,7:32-47.
[6]Mingorance-Le Meur A,Zheng B,Soriano E, et al.Involvement of the myelin-associated inhibitor Nogo-A in early cortical development and neuronal maturation[J].Cereb Cortex,2007,17: 2375-2386.
[7]Mathis C,Schröter A,Thallmair M,et al.Nogo-a regulates neural precursor migration in the embryonic mouse cortex[J].Cereb Cortex,2010, 20:2380-2390.
[8]何主强,殷莉,赵洪洋.NOGO-A在PC12细胞分化过程中的表达及意义[J].中华神经外科疾病研究杂志,2008,7:37-40.
[9]O'Neill P,Whalley K,Ferretti P.Nogo and Nogo-66 receptor in human and chinck:implications for development and regeneration[J].Den Dyn,2004,231:109-121.
[10]Hasegawa Y,Fujitani M,Hata K,et al.Promotion of axon regeneration by myelin-associated glycoprotein and Nogo through divergent signals downstream of Gi/G[J].J Neurosci,2004, 24:6826-6832.
[11]Nyatia E,Lang DM.Localisation and expression of a myelin associated neurite inhibitor, Nogo-A and its receptor Nogo-receptor by mammalian CNS cells[J].Res Vet Sci,2007,83: 287-301.
(本文编辑:唐颖馨)
Expression of Nogo-A Receptors during Early Neuronal Differentiation Process
HE Zhu-qiang,YANG Guo-ping,ZHAO Hong-yang.Department of Neurosurgery,Wuhan First Hospital,Wuhan 430022,China
Objective:To explore the expression of Nogo-A receptors(NG-R)during the early neuronal differentiation process.Methods:PC12 cells were culturedin vitro,and 50 ng/mL nerve growth factor(NGF)was added into medium to induce neuronal differentiation for 1,3,5,and 7 days individually in the experimental group but not in the control group.The cell differentiation and axon growth were observed by inverse microscopy.The expression of NG-R mRNA and protein in PC12 cells were detected by RT-PCR,western blot and immunofluorescence staining.Results:In the experimental group,the axon growth and differentiation of PC12 cells increased from day 1 to day 7.NG-R mRNA and protein were not detected in the control group.In the experimental group,the expression of NG-R mRNA and protein were increased from day 1 to day 7(P<0.05 or 0.01).But there was no difference of expression of NG-R protein at day 1 between the experimental and control groups(P>0.05).Conclusion:The expression of NG-R increased during the early neuronal differentiation process.
PC12 cell line;Nogo-A receptor;cell differentiation
R741;R741.02
ADOI10.3870/sjsscj.2015.02.001
1.武汉市第一医院神经外科
武汉430022
2.华中科技大学同济医学院附属协和医院神经外科
武汉430030
2014-12-28
何主强
colei@sina.com
