磁共振表观弥散系数变化率对肝细胞肝癌患者单次TACE术后疗效评价的应用价值
2015-05-20万绪明许祖闪侯红军
万绪明 许祖闪 侯红军
·论著·
磁共振表观弥散系数变化率对肝细胞肝癌患者单次TACE术后疗效评价的应用价值
万绪明 许祖闪 侯红军
目的 探讨磁共振表观弥散系数(ADC)变化率(即ΔADC)在肝细胞肝癌(HCC)单次经导管肝动脉化疗栓塞术(TACE)术后疗效评价中的应用价值。方法 选择48例确诊为中晚期HCC并于TACE术前、术后1个月接受常规CT、MRI扫描以及MRI弥散加权成像和动态增强扫描的患者,建立所有患者的随访数据,随访中以肿瘤出现进展为随访结束点,记录患者治疗后肿瘤无进展生存期(PFS);以TACE术后1个月再次行数字减影血管造影(DSA)的肿瘤染色结果作为“金标准”,将病灶按治疗效果分为良好组、中等组及差组3组,并根据各组PFS绘制生存曲线。分别比较ΔADC、CT及MRI3种方法对TACE术后疗效的判定价值,并与“金标准”的一致性进行检验。结果 48例患者共56个病灶纳入分析,以“金标准”评价治疗效果,结果:良好组30个、中等组16个、差组10个,3组间生存曲线差异有统计学意义(χ2=29.89,P<0.01),中位PFS分别为7.5、4.0和1.1个月;TACE术后各组ADC均升高,3组间ΔADC差异有统计学意义(F=22.41,P<0.01),且3组间生存曲线差异亦有统计学意义(χ2=26.57,P<0.01),中位PFS分别为7.5、4.6和1.8个月。经Kappa检验,ΔADC与“金标准”疗效评价方法具有一致性(Kappa值为0.542,P<0.01);以MRI和CT评价治疗效果,其与“金标准”的一致性较差(Kappa值分别为0.328和0.260,P均<0.05),3组间生存曲线仅MRI评价方法显示差异有统计学意义(χ2=30.623,P<0.01)。结论 ΔADC能及时、客观地评价TACE治疗效果,对指导患者术后的后续治疗有重要临床意义。
癌,肝细胞;磁共振成像;表观弥散系数;经导管肝动脉化疗栓塞术
肝细胞肝癌(hepatocellular carcinoma,HCC)是消化系统常见的恶性肿瘤之一,发病率仅次于胃癌和食管癌,位列恶性肿瘤总病死率的第三位。我国肝癌发病率较高,发病例数约占全世界总例数的55%[1],且确诊时多数患者已失去手术机会。对于不能手术治疗或复发性的HCC,经导管肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)已成为非外科手术治疗的首选。早期评估TACE术后疗效,对于制定下一步的治疗计划和改善患者预后都有重要意义。肿瘤无进展生存期(progression-free survival,PFS)常用于肿瘤治疗效果的随访研究,在一定程度上代表了肿瘤治疗后缓解持续时间;常规CT与MRI平扫结合动态增强成像可反映肿瘤治疗后大小、形态变化及碘油沉积情况等;而 MRI弥散加权成像(diffusion-weighted imaging,DWI)可以无创性地反映活体组织细胞内水分子的弥散能力,可用于评估肿瘤治疗后的坏死、残留或复发情况。本研究通过观察TACE术前及术后1个月肿瘤表观弥散系数(apparentdiffusion coefficient,ADC)变化率(即ΔADC)以及常规CT、MRI动态增强表现等,评估HCC患者单次TACE术后治疗效果,结合PFS探讨适用于HCC治疗后短期随访的客观指标。
1 资料与方法
1.1 一般资料
选取2008年7月至2014年2月在我院诊治的HCC患者,所有患者均经细针穿刺吸取活检(fine-needleaspiaration,FNA)组织病理学证实。纳入标准:患者属初次发病,检查前未经任何抗肿瘤治疗的进展期结节型HCC;肿瘤最大径超过30mm,肝功能分级为Child B级以上;所有患者训练后均能耐受15~22 s的屏气;患者于TACE治疗前及治疗后1个月行肝脏MRI扫描及多层螺旋CT两项检查,时间间隔在1周以内。排除标准:严重心、肺、肾功能不全、不能耐受穿刺或MRI、CT增强检查者,妊娠患者,肝脏转移性肿瘤患者,肝性脑病患者。按上述标准筛选出48例患者共56个病灶纳入研究,其中男性34例、女性14例,年龄40~ 78岁,中位年龄56.5岁,所有患者经TACE治疗后均无严重并发症发生。所有患者或其家属均于检查前签署了知情同意书。
1.2 MRI、CT扫描
MRI检查采用美国GE Signa 1.5T超导MRI仪,8通道上腹部线圈。患者取仰卧位,中心线定于剑突下缘,扫描范围自膈顶至肝下缘,常规压脂T2加权及T1加权平扫后行非屏气DWI扫描,b值为0 s/mm2和800 s/mm2,定位层数复制T2加权以保证图像扫描范围和层数、层厚的一致性;多期动态扫描(动脉期、门脉期及延迟期)使用磁共振双筒高压注射器,按0.1mmol/kg的剂量经肘静脉注射钆喷酸葡胺(德国先灵药业有限公司);后注入20ml生理盐水,保证钆喷酸葡胺完全进入体内,于开始注射对比剂后15、50、180 s嘱患者屏气扫描,分别获得动脉期、门脉期及延迟期全肝MRI图像,每期扫描20~23层。图像传送至GEAW4.6工作站上经ADC测量软件测量并记录患者的ADC。
CT检查采用荷兰Philips64排螺旋CT机,患者扫描前空腹,饮温水600~800ml充盈胃肠道,并训练掌握屏气方法,于吸气末开始扫描,范围自膈顶至肝下缘,常规平扫后,采用高压注射器经肘静脉以3.5ml/s的注射速率注射非离子型对比剂碘海醇80~100ml行动态增强扫描,分别于注射对比剂后25~30 s、50~60 s、120~180 s行动脉期、门脉期及延迟期全肝扫描,将图像传至Philips EBW工作站,根据需要进行多平面重建,重建厚度为2.0mm。
MRI和CT两项检查的时间点分别为TACE术前1周左右及术后1个月左右,成像参数均保持一致,同一患者的扫描层数尽量一致。对于术后1个月复查患者,是否行增强CT不作要求。
1.3 随访复查
患者于TACE术后每月常规行肝脏增强MRI或CT检查,观察肿瘤强化程度或碘油沉积情况,术后第一个月行数字减影血管造影(digital subtraction angiography,DSA)检查评价TACE治疗效果并将其作为“金标准”,将所有病灶按治疗效果分为良好组、中等组及差组3组;以后每个月根据肝功能、甲胎蛋白及碘油沉积情况和(或)强化情况等决定是否行下次介入治疗。所有收治的肝癌患者资料均登记并收入TACE治疗效果数据库,并由专业人员负责随访,每月随访一次,随访采用门诊、电话结合书信形式,记录患者的治疗经过和PFS。将HCC治疗后的PFS定义为从肿瘤治疗结束开始至随访中出现肿瘤进展的时间,按照修改的实体瘤疗效评价标准(modified response evaluation criteria in solid tumors,mRECIST)[2],将肿瘤进展定义为所有靶病灶存活肿瘤最大径之和增加超过原来肿瘤的20%以上,和(或)出现明确新发病灶。随访截止日期为2014年4月1日。
1.4 资料分析
1.4.1 ADC的测量
由2名高年资腹部影像诊断医师(1名主任医师和1名主治医师)在不知病理结果的情况下对所有患者的56个病灶进行分析,首先根据T1加权、T2加权平扫及动态增强图像确定肿瘤位置、大小、形态,对照DWI图像在ADC图上选择ROI,在同一病灶的最大层面上分别测量术前及术后1个月肿瘤的全病灶ADC;计算前后两次的ΔADC,其中,ΔADC(%)=[(ADC后-ADC前)/ADC前]×100%,测量时尽量避开肝内胆管、小血管、小囊肿等各种干扰因素;参考Koh和Collins[3]的标准,按术后1个月的治疗效果分为3组,ΔADC≥60%为良好组,13%≤ΔADC<60%为中等组,ΔADC<13%为差组。
1.4.2 CT、MRI图像评价
由上述2名医师观察,通过对比TACE术前及术后各月的随访图像,分析并记录病变的大小变化,有无新发病灶出现;根据术后第1个月的CT图像上的碘油沉积情况,将1月后治疗效果分为3组:良好组,碘油分布范围占肿瘤的70%以上;中等组,碘油分布范围占肿瘤的30%~70%;差组,碘油分布范围占肿瘤的30%以下。在MRI图像上根据肿瘤信号及强化情况,亦将1月后治疗效果分为3组:良好组,肿瘤坏死范围达70%以上,DWI上无高信号;中等组,DWI出现高信号,肿瘤坏死范围为30%~70%;差组,DWI信号与术前相比基本一致或稍高,肿瘤坏死范围小于30%。肿瘤坏死范围为增强扫描各期无强化或仅边缘略有强化的区域。
1.5 统计学分析
采用SPSS19.0统计学软件对各组数据进行统计学分析;计量资料用均数±标准差表示,采取单因素方差分析比较各组间ΔADC的差异;根据HCC术后随访各组的PFS采用Kaplan-Meier法分别绘制各组的生存曲线,对各曲线间的总体差异采用log-rank比较;分别计算不同随访方法和标准下肿瘤治疗效果与金标准的一致性,Kappa值>0.40表示两种方法有一致性;P<0.05表示差异有统计学意义。
2 结果
2.1 TACE术后1个月DSA复查结果
本组48例患者经训练后都能较好地配合检查,所得MRI和CT图像质量符合诊断要求;48例患者中单发者42例、多发者6例,共检出病灶56个;根据每月复查情况,至随访结束,所有患者均接受2~5次(中位次数4次)TACE治疗,其中38例患者还接受了放疗或系统化疗,但TACE术后1个月内没有患者行二次TACE治疗。TACE术后1个月经DSA复查,治疗效果良好组病灶30个(图1)、中等组16个、差组10个。3组的PFS生存曲线如图2所示,中位PFS分别为7.5、4.0和1.1个月,总体PFS为6.3个月,3组间生存曲线差异有统计学意义(χ2=29.89,P<0.01)。
2.2 TACE术后1个月ΔADC测量结果
以ΔADC作为疗效评价标准,结果:56个病灶中,良好组25个(图3)、中等组20个、差组11个。良好组、中等组及差组术前平均ADC分别为(1.051±0.188)、(1.125±0.223)和(1.177±0.167)mm2/s,术后1个月平均ADC均升高,分别为(2.176±0.133)、(1.623±0.148)和(1.305±0.137)mm2/s,术后各组ΔADC分别为(95.68±0.261)%、(44.27±0.509)%和(16.00± 0.244)%。经单因素方差分析,各组间ΔADC差异有统计学意义(F=22.41,P<0.01)(表1)。
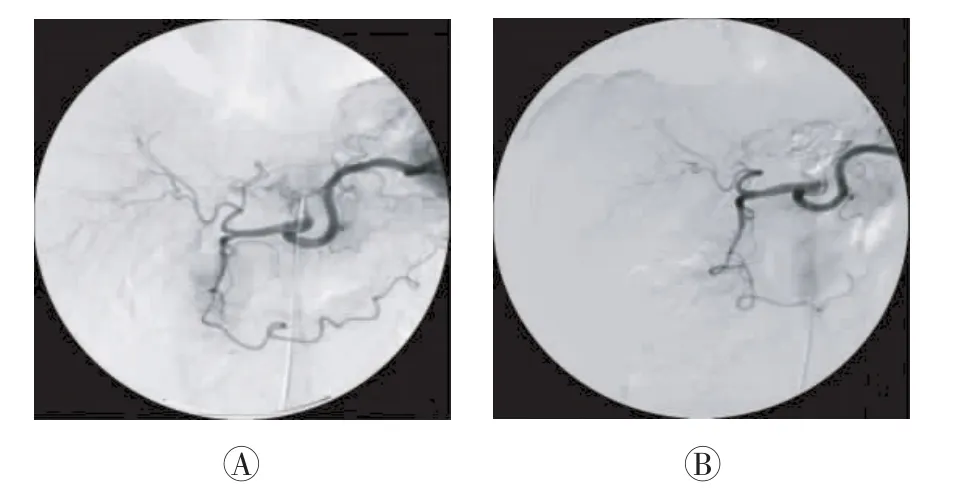
图1 肝细胞肝癌患者TACE前后的DSA图。患者男性,54岁,术后1个月,DSA示肝左叶肝癌基本无染色。图中,A:术前DSA可见肿瘤迂曲杂乱供血动脉显影;B:术后1个月肿瘤供血动脉栓塞良好。TACE:经导管肝动脉化疗栓塞术;DSA:数字减影血管造影。Fig.1 Digital subtraction angiography images of hepatocellular carcinoma before and after transcatheter arterial chemoembolization
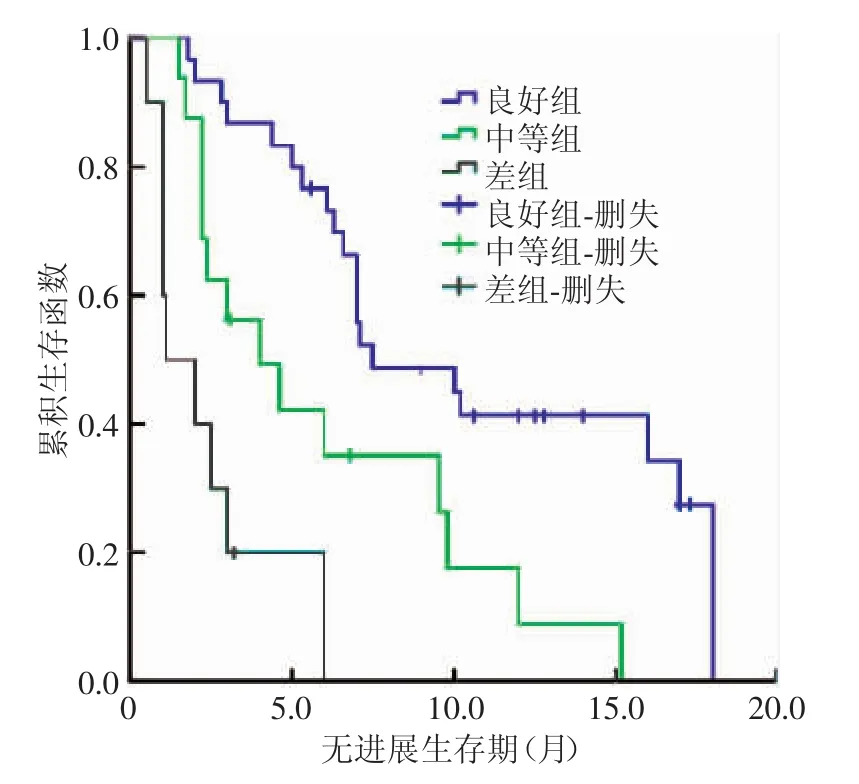
图2 以DSA为疗效评价标准时不同疗效组的生存曲线 图中,DSA:数字减影血管造影。Fig.2 The survival curvesof different therapeutic groupsevaluated by digitalsubtraction angiography criteria
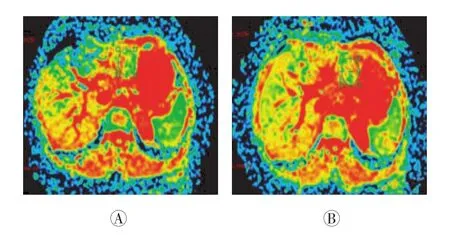
图3 肝细胞肝癌患者TACE前后的ADC图。患者男性,54岁(与图1为同一患者)。图中,A:TACE术前病灶ADC为1.102×10-3mm2/s;B:术后1个月病灶ADC为1.895×10-3mm2/s,治疗效果良好。TACE:经导管肝动脉化疗栓塞术;ADC:表观弥散系数。Fig.3 Apparent diffusion coefficient imagesofhepatocellular carcinomabeforeand after transcatheterarterialchemoembolization

图4 以ΔADC为疗效评价标准时不同疗效组的生存曲线图中,ΔADC:表观弥散系数变化率。Fig.4 The survival curvesofdifferent therapeutic groupsevaluated by the change ratioofapparentdiffusion coefficient
表1 TACE治疗前后不同疗效组平均ADC及ΔADC(±s)Table1 The resultsofaverage ADCandΔADC in different therapeutic group before and after TACE
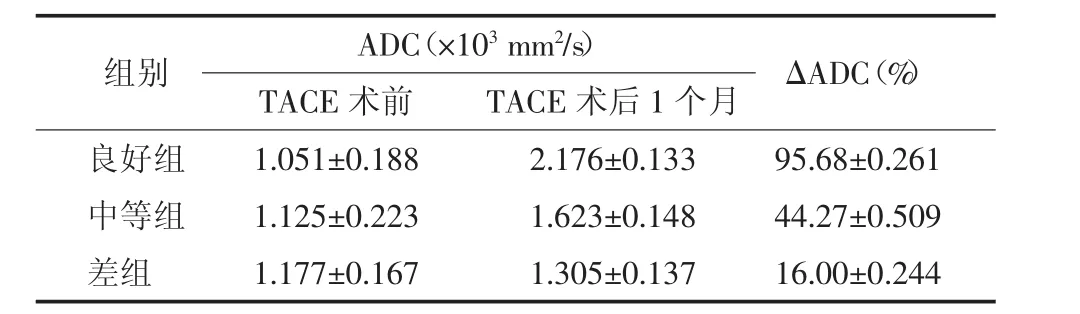
表1 TACE治疗前后不同疗效组平均ADC及ΔADC(±s)Table1 The resultsofaverage ADCandΔADC in different therapeutic group before and after TACE
注:表中,ADC:表观弥散系数;ΔADC:表观弥散系数变化率。
组别 ΔADC(%)良好组 1.051±0.188 2.176±0.133 95.68±0.261中等组 1.125±0.223 1.623±0.148 44.27±0.509差组 1.177±0.167 1.305±0.137 16.00±0.244 ADC(×103mm2/s)TACE术前 TACE术后1个月
经Kaplan-Meier分析,3组的PFS生存曲线如图4所示,其中位PFS分别为7.5、4.6、1.8个月,总体PFS为6个月,各组间生存曲线差异有统计学意义(χ2=26.57,P<0.01)。
2.3 TACE术后1个月CT、MRI复查结果
TACE术后1个月,以MRI为标准评价56个病灶,结果:疗效良好组29个(图5)、中等组17个、差组10个;以CT为标准评价,结果:良好组、中等组及差组分别为32、17、7个(图6)。两种方法下各组的生存曲线分别如图7、8所示。以MRI为标准评价时,3组的中位PFS分别为10.0、3.2及1.1个月,总体PFS为6.5个月,各组间生存曲线差异有统计学意义(χ2=30.623,P<0.01),而以CT为标准评价时,3组间生存曲线差异则无统计学意义(χ2=4.035,P>0.05)。
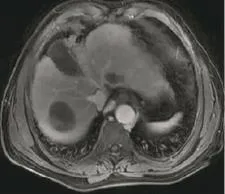
图5 肝右叶肝癌患者的MRI图。患者男性,65岁,上腹部疼痛不适6个月,TACE术后1个月复查,MRI动态增强门脉期扫描示肝癌已大部坏死,仅边缘有轻度结节样强化。TACE:经导管肝动脉化疗栓塞术。Fig.5 MRI image of liver cancer in the right lobe 1 month after transcatheterarterial chemoembolization
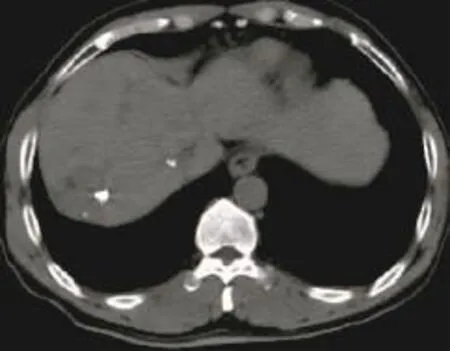
图6 肝右叶肝癌患者的CT图。患者男性,67岁,因查体发现肝右叶肝癌而接受TACE治疗,术后1个月复查,CT平扫示碘油沉积不良,病变区仅有少量碘油沉积。TACE:经导管肝动脉化疗栓塞术。Fig.6 CT imageof liver cancer in the right lobe after transcatheter arterial chemoembolization
2.4 3种不同评价方法与DSA的一致性比较
将ΔADC、CT、MRI 3种方法分别与DSA分组方法比较,经Kappa检验,ΔADC标准评价治疗效果与DSA评价效果具有一致性,而CT、MRI与DSA的一致性较差(表2)。
3 讨论
TACE通过选择性动脉内化疗栓塞使肿瘤组织缺血坏死,目前已广泛应用于进展期及晚期肝癌患者的治疗。因此,准确评估TACE术后疗效,及时采取干预措施,调整治疗方案对延长患者生存时间及改善预后有重要意义[4]。MRIDWI属于功能成像,其ADC可对病变组织进行量化分析,动态观察ADC的变化对肝癌诊断和治疗效果的评价有重要价值[5]。
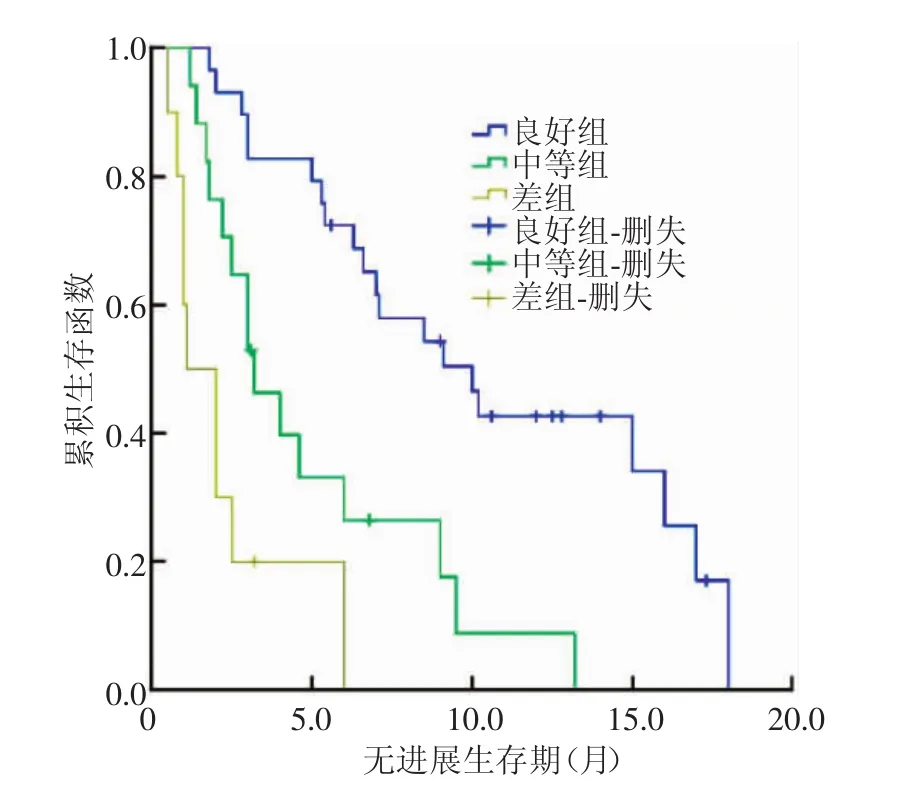
图7 以MRI为疗效评价标准时不同疗效组的生存曲线Fig.7 The survival curves in different therapeutic groupsevaluated byMRIcriteria
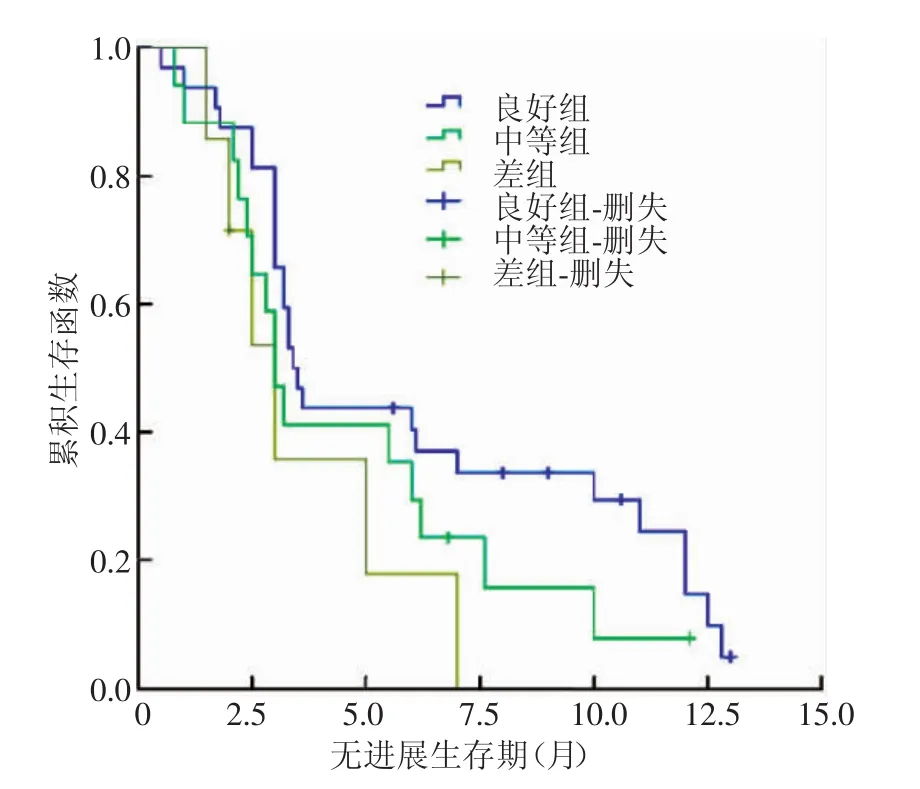
图8 以CT为疗效评价标准时不同疗效组的生存曲线Fig.8 The survival curves in different therapeutic groupsevaluated by CT criteria
既往临床上常用RECIST和mRECIST来评价非手术切除恶性肿瘤的治疗效果,但肝癌治疗后的大小变化不能早期反映治疗效果,而且上述标准对肝癌坏死情况的评价亦未提出定量化的依据[2],DWI可反映组织细胞密度及结构信号,与RECIST和mRECIST比较是更为可靠的疗效评价方法[6],而DSA对肝癌TACE术后残留病灶具有检出率高、准确性好的优点,被视为评价疗效的金标准[7]。本研究通过比较TACE术后各种评价方法与金标准的差别后发现,ΔADC与金标准对TACE疗效评价的一致性最好,而且两者均采用Kaplan-Meier法对各组数据进行生存分析,也得到了关于各组肝癌中位PFS的相似结果。
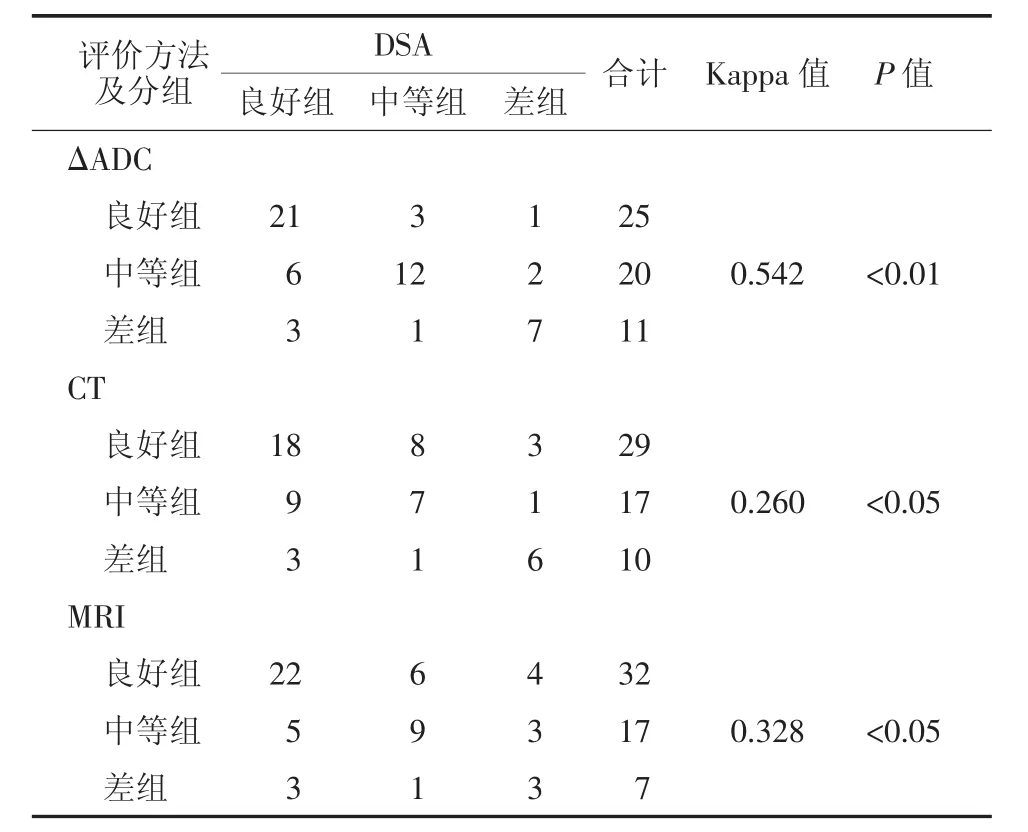
表2 不同评价方法与DSA评价效果的一致性比较(个)Table 2 The comparison of consistency ofDSAwith other differentevaluationmethods
尽管TACE已广泛应用于肝癌的非手术治疗,但该方法不能一次性彻底杀灭肿瘤细胞,而且肝癌通常侧支循环丰富,残存的肿瘤细胞和未能完全栓塞的侧支成为肿瘤复发转移的重要根源,DSA不受肝内原本沉积碘油的影响,可多时相、多方位观察病变,从而灵敏地发现新出现的动脉异常供血灶,而ADC与肿瘤坏死程度存在相关关系,可反映肿瘤坏死、残存或复发情况[8-9]。TACE治疗后肿瘤细胞坏死,肿瘤组织内细胞密度下降,细胞外间隙与细胞内间隙的比值增加,增加了水分子的扩散系数,而肿瘤复发区肿瘤细胞密集,细胞异型性高,肿瘤内部水分子扩散明显受限,因此,ADC的变化同DSA一样可灵敏地发现残存或复发的肿瘤病灶。
选择合适的随访时间点对评估TACE疗效也非常重要,过早评价单次TACE疗效时,化疗药物尚未完全发挥作用,栓塞血管所在的供血区尚未完全发生缺血坏死,而且患者治疗后早期可有恶心、发热等并发症,不能很好地配合检查,会影响ADC的测量;过晚评价时,化疗药物的细胞毒作用已减弱,且肿瘤可能已出现新的侧支血供,此时瘤灶内可能已出现复发或残存细胞并开始增殖。因此,过早或过晚评价都不能准确判断单次TACE术后肿瘤坏死程度。Sun等[10]研究认为,TACE术后1~2个月癌细胞的坏死、凋亡速率开始下降,残余癌细胞的增殖活性在此时有增强趋势,提示肿瘤复发或血管再通,需要进行疗效评价,指导后续治疗;而Dong等[11]发现,TACE术后7 d内由于肿瘤水肿、缺血、缺氧等可影响ADC的测量,从而影响对坏死程度的判断。本研究考虑到TACE术后高浓度的化疗药物的细胞毒作用以及碘油栓塞导致肿瘤局部缺血,各种药物对肿瘤细胞的间接破坏作用和诱导的肿瘤细胞凋亡是较为缓慢的过程,且ADC上升后会维持一段时间的平台期,术后30 d后才开始出现下降[12],因此选择术后1个月左右进行TACE疗效评价能较准确地判定单次TACE的疗效。
由于TACE治疗后病灶的组织学检查结果很难获得,本组资料采用了多种评价方法。多层螺旋CT是目前TACE术后随访中较为常用的影像学方法,然而沉积均匀的碘油会掩盖部分有活性的残存肿瘤,碘油产生的线束硬化伪影也在一定程度上影响了组织强化的观察,这都会降低CT扫描判断肿瘤残存或复发的可靠性,从而在判断疗效时出现假阴性或假阳性的结果。本研究结果显示,通过CT对肿瘤疗效分组,3组不同疗效间的肿瘤PFS差异没有统计学意义,且其分组与金标准的一致性也较差,而MRI的T2加权信号不受碘油沉积的影响,可通过观察病变信号及增强扫描血供变化判断肿瘤残余及复发,但部分乏血供肿瘤在MRI增强扫描中可无异常强化,且增强前T1加权即为高信号的病灶也会影响强化程度的判定。另外,MRIT1加权增强对分辨活性肿瘤组织和反应性肉芽组织有一定困难[13]。因此,两者在肿瘤术后疗效评价及对肿瘤PFS的分析方面存在一定的局限性。
本研究还发现疗效良好组、中等组及差组3组间ΔADC存在差异,ΔADC变化越大,治疗效果越好,其中位生存期也较长,这与Yuan等[14]、Mannelli等[15]的研究结果一致,因此,通过比较术后1个月较术前ADC的变化还可尽早识别对TACE治疗不敏感者,有利于及时制定和调整治疗方案,避免过多的TACE治疗加重患者的肝损害,降低TACE的疗效和耐受性。
本研究也存在诸多不足,包括病例数较少、部分处于肝边缘部的病灶受呼吸和伪影影响较大等,但ΔADC作为肝癌介入术后随访的一项重要指标,可反映肿瘤治疗前后组织坏死和(或)复发的微观变化,在判定肿瘤PFS及评价肿瘤治疗效果方面与DSA具有很好的一致性,因此,ΔADC能及时、客观地评价TACE治疗效果,对指导患者后续治疗有重要临床意义。
[1]PengW,Chen Y,Jiang Q,et al.Spatial analysis of hepatocellular carcinoma and socioeconomic status in China from a populationbased cancer registry[J].Cancer Epidemiol,2010,34(1):29-33.
[2]Lencioni R,Llovet JM.Modified RECIST(mRECIST)assessment for hepatocellular carcinoma[J].Semin Liver Dis,2010,30(1):52-60.
[3]Koh DM,Collins DJ.Diffusion-weighted MRIin the body:applicationsand challenges in oncology[J].AJR Am JRoentgenol,2007, 188(6):1622-1635.
[4]Okabe N,Morimoto M,Kondo M,etal.Efficacy of chemoembolization for recurrent HCC after curative ablation therapy[J].Hepatogastroenterology,2013,60(123):395-399.
[5]侯红军,许祖闪,万绪明.动态弥散加权成像对HCC的TACE术疗效评价的临床应用[J].医学影像学杂志,2014,24(3):395-398.
[6]GeorgiadesC,Geschwind JF,Harrison N,etal.Lack of responseafter initial chemoembolization forhepatocellular carcinoma:does it predict failure of subsequent treatment?[J].Radiology,2012,265(1):115-123.
[7]IwazawaJ,Ohue S,MitaniT,etal.Identifying feeding arteriesduring TACE of hepatic tumors:comparison of C-arm CT and digital subtraction angiography[J].AJR Am JRoentgenol,2009,192(4):1057-1063.
[8]Mannelli L,Kim S,Hajdu CH,etal.Assessment of tumor necrosis of hepatocellular carcinoma after chemoembolization: diffusionweighted and contrast-enhanced MRIwith histopathologic correlation of theexplanted liver[J].AJRAm JRoentgenol,2009,193(4):1044-1052.
[9]Bonekamp S,Jolepalem P,Lazo M,et al.Hepatocellular carcinoma:response to TACE assessed with semiautomated volumetric and functional analysis of diffusion-weighted and contrastenhanced MR imagingdata[J].Radiology,2011,260(3):752-761.
[10]Sun Z,LiG,AiX,etal.Hepatic and biliary damageafter transarterial chemoembolization formalignant hepatic tumors:incidence, diagnosis,treatment,outcome and mechanism[J].Crit Rev Oncol Hematol,2011,79(2):164-174.
[11]Dong S,Ye XD,Yuan Z,et al.Relationship of apparent diffusion coefficient to survival for patientswith unresectable primary hepatocellularcarcinomaafterchemoembolization[J].Eur JRadiol,2012, 81(3):472-477.
[12]尚全良,肖恩华,贺忠,等.肝癌经导管动脉灌注化疗栓塞术疗效的MR扩散加权成像动态研究[J].中华放射学杂志,2006,40(3):235-240.
[13]Assumpcao L,ChotiM,Pawlik TM,et al.Functional MR imaging asanew paradigm for imageguidance[J].Abdom Imaging,2009,34(6):675-685.
[14]Yuan Z,Ye XD,Dong S,etal.Role ofmagnetic resonance diffusion-weighted imaging in evaluating responseafter chemoembolization of hepatocellular carcinoma[J].Eur JRadiol,2010,75(1):e9-14.
[15]Mannelli L,Kim S,Hajdu CH,etal.Serial diffusion-weighted MRI in patientswith hepatocellular carcinoma:prediction and assessmentof response to transarterial chemoembolization[J].Preliminary experience.Eur JRadiol,2013,82(4):577-582.
App lication value of the change ratio of apparent diffusion coefficient in the therapeutic evaluation of hepatocellular carcinoma treated by single transcatheter arterial chemoembolization
Wan Xuming,Xu Zushan,Hou Hongjun.Departmentof Imaging,WeihaiWendeng Central Hospital,Wendeng 264400,China
Wan Xuming,Email:wanxuming@sina.com
Objective To explore the application value of the change ratio of the apparentdiffusion coefficient(ΔADC)in the therapeutic evaluation ofhepatocellular carcinoma(HCC)treated by single transcatheterarterialchemoembolization(TACE).Method s Forty-eightpatientsdiagnosedwith advanced HCC underwentdiffusion-weighted imaging,dynamic enhanced MRI,and CT before and onemonth after TACE.The follow-up data for all selected patientswere accumulated,and the disease progression in the follow-upwasconsidered theend point.The progression-free survivalofevery patientwas recorded after TACE.The responses one month after TACE were assessed via digital subtraction angiography,ΔADC, MRI, and CT, ofwhich DSA was considered the “gold standard.” The groupswere divided into three groups: good, middle, and bad.The PFS curveswere then plotted.The consistency of the other threeevaluationmethodswith the “gold standard” wasevaluated by kappa test.Results Fifty-six lesionswere found in 48 patients according to the DSA results,where 30,16,and 10 lesions belonged to the good,middle,and bad groups, respectively.The survival curvesamong the 3 groupswere statistically significant(χ2=29.89,P<0.01),and themedian PFSsof the good,middle,and bad groupswere 7.5,4.0,and 1.1months,respectively.TheΔADC results indicated that the ADC values generally in-creased after a single TACE;theΔADC and survival curves among the 3 groupswere also statistically significant(χ2=26.57,P<0.01);themedian PFSs for the good,middle,and bad groupswere 7.5,4.6,and 1.8 months, respectively.The kappa test shows that theΔADC was perfectly consistent with the“gold standard”(kappa=0.542,P<0.01), but theMRIand CTwere poorly consistentwith the “gold standard”(Kappa=0.328,0.260,P<0.05).Only the MRIwas statistically significant(χ2=30.623,P<0.01)in the survival curve.Conclusion TheΔADC can evaluate the efficacy of TACE timely and objectively,and theΔADC is clinically significantin guiding the subsequent treatmentaftera single TACE.
Carcinoma,hepatocellular;Magnetic resonance imaging;Apparent diffusion coefficient;Transcatheterarterialchemoembolization
2014-07-13)
10.3760/cma.j.issn.1673-4114.2015.02.006
264400,山东省威海市文登中心医院影像科
万绪明(Email:wanxuming@sina.com)
