含不同剂量左氧氟沙星方案的抗耐多药结核病疗效研究
2015-05-20王庆枫王隽王敬段鸿飞戈启萍黄学锐杜亚东韩喜琴初乃惠
王庆枫 王隽 王敬 段鸿飞 戈启萍 黄学锐 杜亚东 韩喜琴 初乃惠
·论著·
含不同剂量左氧氟沙星方案的抗耐多药结核病疗效研究
王庆枫 王隽 王敬 段鸿飞 戈启萍 黄学锐 杜亚东 韩喜琴 初乃惠
目的 观察不同剂量左氧氟沙星(Lfx)治疗耐多药结核病的疗效,指导临床选择合理的Lfx治疗剂量。方法 选取2011年1月至2012年11月在首都医科大学附属北京胸科医院住院和门诊治疗的耐多药结核病(MDR-TB)患者125例,由于失访和药物停用等原因,最终纳入研究119例,采用随机数字表法分为Lfx 400 mg/d(对照组,40例)、Lfx 600 mg/d(治疗1组,39例)、Lfx 800 mg/d(治疗2组,40例),联合其他抗结核药物组成至少4种以上敏感药物的抗结核治疗方案。在治疗的第7天,Lfx服药后2 h分别取血浆样本测定血药浓度,观察12个月,比较3组患者的痰菌阴转率及不良反应情况。采用SPSS 13.0统计软件进行统计学分析,计数资料用百分数(%)表示,组间比较采用χ2检验。多组均数比较采用Kruskal-WallisH检验,以P<0.05为差异有统计学意义。结果 治疗后3、6、9、12个月痰菌阴转率治疗1组分别为:53.8%(21/39)、56.4%(22/39)、59.0%(23/39)、59.0%(23/39),与对照组30.0%(12/40)、32.5%(13/40)、35.0%(14/40)、35.0%(14/40)的比较,差异有统计学意义(χ2值分别为4.60、4.57、4.95、4.95,P值均<0.05);治疗后3、6、9、12个月治疗2组痰菌阴转率分别为:60.0%(24/40)、65.0%(26/40)、65.0%(26/40)、65.0%(26/40),明显高于对照组的30.0%(12/40)、32.5%(13/40)、35.0%(14/40)和35.0%(14/40),差异有统计学意义 (χ2值分别为7.27、8.46、7.20、7.20,P值均<0.05)。治疗1组与治疗2组治疗后3、6、9、12个月痰菌阴转率比较,差异无统计学意义(χ2值分别为0.31、0.61、0.21、0.21,P值均>0.05)。3组患者不良反应观察以胃肠道反应、肌肉关节疼痛、中枢神经系统的异常为主要表现,上述不良反应在各组出现比率分别为对照组0.0%、15.0%(6/40)、0.0%;治疗1组2.6%(1/39)、10.3%(4/39)、2.6%(1/39);治疗2组5.0%(2/40)、17.5%(7/40)、7.5%(3/40),不良反应各组比较差异无统计学意义(χ2值分别为2.04、0.87、3.58,P值均>0.05)。结论 耐多药结核病治疗的Lfx剂量600 mg/d、800 mg/d均较好,但是由于差异没有统计学意义,故推荐耐多药结核病治疗的Lfx剂量为600 mg/d,部分患者可应用到800 mg/d。
结核, 肺/药物疗法; 结核, 抗多种药物性/药物疗法; 氧氟沙星; 治疗结果
正确选择抗结核药物制定合理的化疗方案是耐多药结核病(multidrug-resistant tuberculosis, MDR-TB)治疗成功最重要的环节,2011年WHO耐药结核病规划管理指南建议:氟喹诺酮类药物(fluoroquinolones,FQs)和二线注射剂为治疗MDR-TB方案的核心药物。体内和体外试验均证实氟喹诺酮类药物对耐多药结核分枝杆菌具有明确的杀菌活性[1-5]。包括左氧氟沙星(levofloxacin,Lfx)在内的新一代氟喹诺酮类药物的应用与MDR-TB治愈率密切相关[5]。目前我国治疗MDR-TB的药物Lfx多采用的是400 mg/d的常规用药剂量,而国外则应用Lfx 750 mg/d的剂量治疗MDR-TB,观察每隔3个月的痰菌阴转率和不良反应方面与莫西沙星(moxifloxacin, Mfx)400 mg/d的剂量无明显差异[6],但Lfx 750 mg/d的剂量较Mfx 400 mg/d的剂量成本明显降低。为此,笔者对MDR-TB患者给予不同剂量的Lfx治疗,对比不同剂量Lfx治疗的疗效、安全性及耐受性,提出适合我国人群的Lfx治疗剂量。
资料和方法
一、研究对象
1.对象的选择:选取2011年1月至2012年11月在首都医科大学附属北京胸科医院门诊及住院诊断为MDR-TB的患者,并符合以下入选及排除标准者125例。入选标准:(1)痰改良罗氏培养药敏试验结果确诊为MDR-TB患者,不包括对氟喹诺酮类药物耐药;(2)HIV阴性;(3)年龄在18~70岁;(4)无严重肝肾、心脏、神经系统、血液系统疾病。排除标准:(1)并发严重疾病、结核性脑膜炎者;(2)合并精神疾病;(3)因严重药物不良反应或其他原因强化期停药>2周或全疗程总停药时间>4周者;(4)广泛耐药结核病(extensively drug-resistant tuberculosis,XDR-TB)。本研究获得首都医科大学附属北京胸科医院伦理委员会的批准,所有入组患者均签署知情同意书。
2.分组:依据参考文献[5]制定治疗方案,选择以含口服Lfx和一种注射制剂(阿米卡星或卷曲霉素)为核心药物的化疗方案:6Lfx+注射剂Am或Cm+PAS(Cs)+Pto(EMB)+PZA/18Lfx+PAS(Cs)+Pto(EMB)+PZA(PZA-吡嗪酰胺,EMB-乙胺丁醇,Am-阿米卡星,Cm-卷曲霉素,Lfx-左氧氟沙星,PAS-对氨基水杨酸钠,Pto-丙硫异烟胺,Cs-环丝氨酸)。用药原则:若患者对上述方案中任一种药物耐药,参考既往用药史,结合药敏试验结果,选择替代药物组成至少4种以上敏感药物的抗结核治疗方案。药物替代说明:注射剂中Am可以用Cm代替,PAS可以用Cs代替,Pto可以用EMB代替)。将125例患者按随机数字表法分为3组,分别为Lfx 400 mg/d对照组42例(简称“对照组”)、Lfx 600 mg/d治疗1组41例(简称“治疗1组”)、Lfx 800 mg/d治疗2组(简称“治疗2组”)42例,3组均观察12个月。分别在治疗开始后3个月、6个月、9个月、12个月予痰抗酸染色涂片3次、痰改良罗氏培养1次,以痰改良罗氏培养阴性(简称“培阴”)为阴转标准。
对照组42例,失访2例;治疗1组41例,失访2例;治疗2组42例,有2例患者因药物不良反应停用,最终完成整个治疗过程的患者119例。其中男66例,女53例,年龄33~45岁,中位年龄39.4岁,中位体质量58.2 kg。各组受试者的年龄、性别、中位体质量、结核病治疗史等基本特征差异无统计学意义(表1)。
二、血药浓度的测定
根据Lfx药代动力学特征,服药后2 h出现血浆峰浓度,5~7 d达到稳态浓度,故受试者于第7次服用Lfx后2 h取静脉血3 ml,2000×g离心10 min,分离血浆,-70 ℃保存待测。Lfx的90%最低抑菌浓度(MIC90)为1 μg/ml[7],7 d后Lfx治疗有效血药浓度范围为8~12 μg/ml[8]。测定药物浓度采用Thermo Finnigan P4000高效液相色谱仪 (Thermo Finnigan, San Jose, CA)。超过最高标准的样本稀释后再测定Lfx的血浆峰浓度,以8~12 μg/ml为有效血药浓度范围。
三、安全性评估
安全性评估主要包括以下几个方面:每个月进行体格检查,症状评估,治疗开始前及治疗开始后每个月进行肝功能、肾功能、血常规、心电图检查,观察并记录不良反应发生情况。
四、统计学方法
采用SPSS 13.0统计软件进行统计学分析,计数资料用百分数(%)表示,不满足正态分布的数据的集中趋势和离散趋势的描述采用中位数和四分位数,组间比较采用χ2检验,多组均数比较采用Kruskal-WallisH检验,P<0.05为差异有统计学意义。
结 果
一、抗结核治疗方案
各组除氟喹诺酮类药物以外的药物耐药率比较差异无统计学意义(表2),3组均应用含有Lfx在内的4~6种抗结核药物组成治疗方案,3组抗结核治疗药物的选择差异无统计学意义(表3)。
二、痰菌阴转率
治疗后3、6、9、12个月痰菌阴转率治疗1组分别为:53.8%(21/39)、 56.4%(22/39)、59.0%(23/39)、 59.0%(23/39),与对照组30.0%(12/40)、32.5%(13/40)、35.0%(14/40)、35.0%(14/40)比较,差异
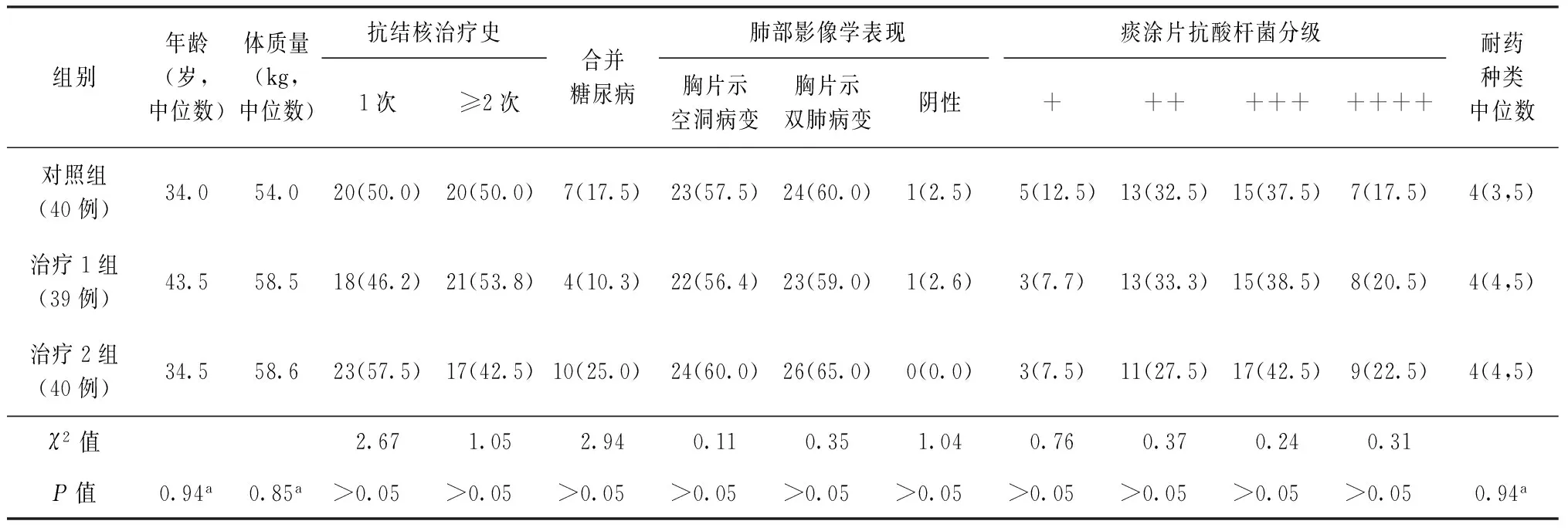
表1 119例患者的一般情况
注a:采用Kruskal-WallisH检验;表中括号外数值为例数,括号内数值为构成比(%)或率(%);表中的“+”表示痰涂片抗酸杆菌分级,表明痰结核分枝杆菌负荷量,“+”越多表明菌量越大

表2 3组患者耐药情况分析
注 括号外为各组对于各药的耐药例数,括号内为耐药率(%);EMB:乙胺丁醇;Rfb:利福布丁; Sm:链霉素;Km:卡那霉素;Am:阿米卡星;Cm:卷曲霉素;Eto:乙硫异烟胺;PAS:对氨基水杨酸有统计学意义(χ2值分别为4.60、4.57、4.95、4.95,P值均<0.05);治疗后3、6、9、12个月治疗2组痰菌阴转率分别为:60.0%(24/40)、65.0%(26/40)、65.0%(26/40)、65.0%(26/40),明显高于对照组的30.0%(12/40)、32.5%(13/40)、35.0%(14/40)和35.0%(14/40),差异有统计学意义 (χ2值分别为7.27、8.46、7.20、7.20,P值均<0.05)。治疗1组与治疗2组治疗后3、6、9、12个月痰菌阴转率比较,差异无统计学意义(χ2值分别为0.31、0.61、0.21、0.21,P值均>0.05)。痰菌阴转率具体见表4。
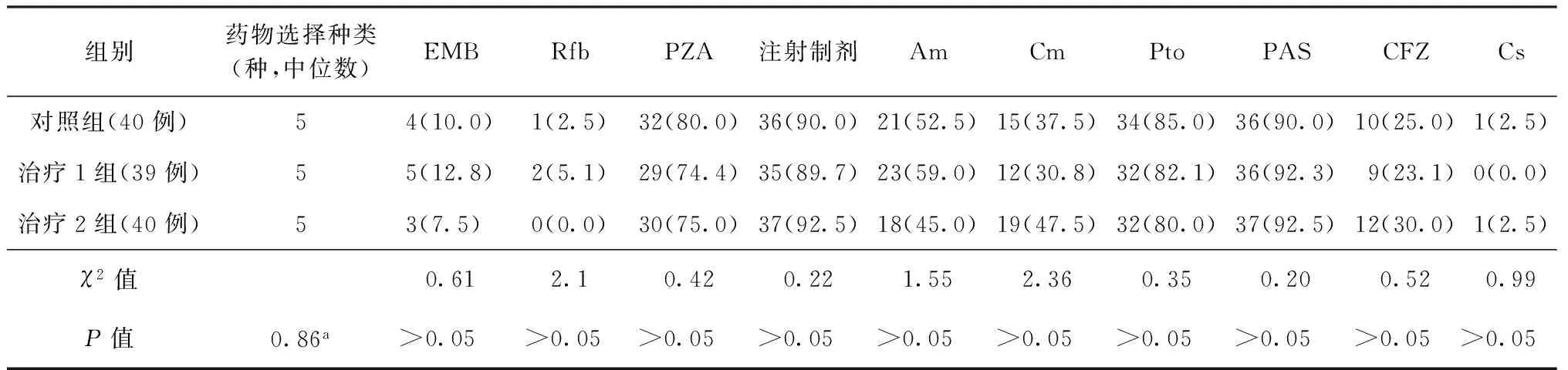
表3 3组患者选用抗结核药物治疗情况分析
注 EMB:乙胺丁醇;Rfb:利福布丁;PZA:吡嗪酰胺;注射制剂:阿米卡星或卷曲霉素;Am:阿米卡星;Cm:卷曲霉素;Pto:丙硫异烟胺;PAS:对氨基水杨酸;CFZ:氯法齐明;Cs:环丝氨酸;a:采用Kruskal-WallisH检验;括号外数值为各项例数,括号内数值为各项例数占各组的比率(%)

表4 3组患者不同治疗时期痰菌阴转情况分析
三、血药浓度监测结果
对照组Lfx的Cmax中位数是7.463 μg/ml,仅有32.5%(13/40)的患者达到治疗浓度范围;治疗1组Lfx的Cmax中位数是9.463 μg/ml,有64.1%(25/39)的患者达到治疗浓度范围;治疗2组Lfx的Cmax中位数是12.463 μg/ml,达到治疗浓度范围为97.5%(39/40)。各研究组的Cmax/MIC的比值见表5。
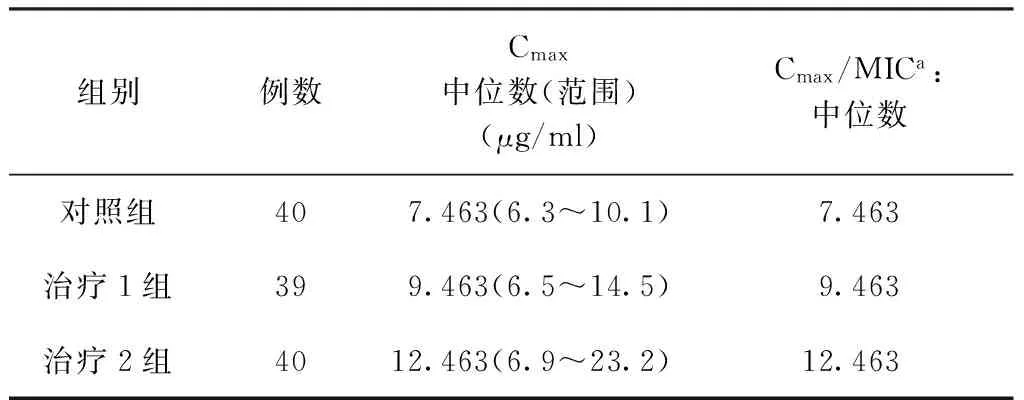
表5 3组患者Lfx血药浓度监测结果
注 Cmax=最大血药浓度;MIC=最低抑菌浓度;a:MIC90=Lfx 1 μg/ml[7]
四、不良反应发生情况
对照组有7例(17.5%)出现药物不良反应,治疗1组有8例(20.5%)、治疗2组有13例(32.5%)患者出现药物不良反应(表6)。在各种不良反应中以肌肉关节疼痛最常见,治疗2组治疗2周后有2例因出现踝关节疼痛,停用Lfx药物退组。胃肠道症状主要表现在恶心、呕吐、纳差、胃部不适;中枢神经系统的异常主要表现在头痛、失眠;血液系统异常表现在白细胞减少;不良反应主要表现皮肤瘙痒,对症治疗好转。患者未发生其他惊厥、眩晕、肝肾功能损伤、心律失常等不良反应。其中最常见的胃肠道反应、肌肉关节疼痛、中枢神经异常在各组表现差异无统计学意义(χ2值分别为2.04、0.87、3.58,P值均>0.05)。各组患者治疗方案的耐受性比较良好。
讨 论
氟喹诺酮类药物自20世纪80年代后期被广泛用于耐药结核病的治疗,由于新一代氟喹诺酮类药物的不断开发且其抗结核的效果要优于前代[9-11],因此,通常应用新一代产品来替代老一代的产品进行抗结核治疗。氟喹诺酮类药物在MDR-TB中的疗效得到了肯定[12]。目前由于XDR-TB对多数氟喹诺酮类药物耐药,因此,在XDR-TB的治疗中,氟喹诺酮类药物选择的是Mfx和加替沙星(Gfx);但在MDR-TB中,仍然优先选择Lfx。2011年WHO耐药结核病规划管理指南推荐在MDR-TB中应用新一代氟喹诺酮类药物[5]。新一代氟喹诺酮类药物包括Lfx(750 mg/d或更高剂量)、Mfx、Gfx和司帕沙星(Sfx)[5]。目前我国针对大部分患者采用Lfx 400 mg/d的常规用药剂量,远远低于国际耐药结核病处理指南推荐的750 mg/d治疗剂量,我国对于不同剂量Lfx抗结核作用的临床疗效研究报道较少。

表6 各类药物不良反应在各组中的出现情况
注 括号外数值为出现不良反应的例数,括号内数值为不良反应发生率(%)
化学药物治疗(简称“化疗”)的作用在于直接杀灭病灶中的结核分枝杆菌,而不是病灶形态学修复。经过合理、规律地化疗后,只要痰菌转阴,在停止化疗后肺部病变会继续好转,且很少复发[13],因此笔者选择以痰菌阴转作为疗效考核指标。本研究结果显示在不同治疗阶段,治疗1组Lfx 600 mg/d痰菌阴转率与对照组Lfx 400 mg/d比较差异有统计学意义,同时本研究引入血药浓度检测来监测Lfx的剂量范围,AUC(0~24 h曲线下面积)/MIC及Cmax/MIC是预测氟喹诺酮类药物疗效的参数[14]。对Lfx的临床研究表明,Lfx属于浓度依赖性抗生素,其杀菌活力随着药物浓度的增高而增加[15],AUC/MIC>100及Cmax/MIC≥8~10时,产生耐药性的可能性小[14,16]。本研究结果表明对照组(Lfx 400 mg/d)仅有32.5%的患者达到治疗浓度范围,治疗1组(Lfx 600 mg/d)有64.1%的患者达到治疗浓度范围,表明目前我国治疗MDR-TB应用Lfx多采用的400 mg/d的常规用药剂量存在不足。耐药结核病产生的重要原因是化疗方案的不合理、用药剂量不足和因不良反应引起的依从性下降等[17],我国氟喹诺酮类药物高耐药率可能与Lfx长期低剂量应用有关,提示Lfx通过提高给药剂量,使其血药浓度达到一定有效治疗范围可能是提高疗效的一种重要手段,所以根据本研究结果,推荐至少应用Lfx 600 mg/d的剂量。
国外研究在MDR-TB抗结核治疗中,在治愈率和痰菌阴转率方面,Lfx 750~1000 mg/d显示了与Mfx相似的抗结核作用[6,18]。但笔者观察到在不同治疗阶段,治疗2组(Lfx 800 mg/d)痰菌阴转率均明显高于对照组(Lfx 400 mg/d),差异有统计学意义。虽然治疗2组的痰菌阴转率在治疗后的3、6、9和 12个月均比治疗1组有所提高,但差异无统计学意义。WHO耐药结核病规划管理指南推荐在MDR-TB中Lfx应用剂量为750 mg/d或更高,而Lfx 600 mg/d被认为是较早一代氟喹诺酮类药物的推荐剂量[6];但是早期临床研究结果显示,采用含Lfx 600 mg/d的4种药方案[Lfx+PZA+Km(Am)+PAS]治疗MDR-TB,其治疗成功率也达到了78%[19]。2013年Jiang等[20]回顾性分析了158例MDR-TB患者,其中86例应用含Lfx(509.9+79.4)mg/d方案,而72例应用含Mfx(400 mg)方案,结果也显示含Lfx组和含Mfx组疗效相近。实验室研究表明,氟喹诺酮类药物杀灭结核分枝杆菌与其他病原菌一样具有浓度依赖性,本研究中血药浓度监测显示治疗2组(Lfx 800 mg/d)患者中血药浓度达到治疗浓度范围的占97.5%,而对照组Lfx仅有32.5%的患者达到治疗浓度范围。所以部分患者可能需要治疗剂量提高至 Lfx 800 mg/d。
本研究中3组患者在不良反应方面差异并没有统计学意义(P值均>0.05)。Lfx 400 mg/d~600 mg/d在MDR-TB治疗中有很好的耐受性,本研究观察12个月治疗2组(Lfx 800 mg/d)仅出现2例因出现踝关节疼痛不能耐受停药,其余患者没有因不良反应调整治疗剂量。在各种不良反应中以肌肉关节疼痛最常见,而Stahlmann等[21]观察102例因不能耐受一线抗结核药物或因为耐药原因需要服用Lfx的患者中不良反应以胃肠道症状、中枢神经异常表现为主, Koh 等[6]观察了155例MDR-TB患者,78例应用Lfx 750 mg/d治疗,其中30例(38.5%)出现胃肠道不适,28例(35.9%)有骨骼肌肉异常。QT间期延长是氟喹诺酮类药物的常见不良反应,但在本研究中,每月复查心电图并未观察到QT间期延长的表现。不良反应发生的差异可能与不同个体对药物耐受程度不同有关。
本研究存在以下不足,首先MDR-TB疗程至少18个月,各组均只观察了12个月以内不同时期的痰菌阴转率,并未评价治愈率和远期的复发率,还应当进一步随访;Johnson等[22]报道Lfx在1000 mg/d的剂量具有早期杀菌活性, 与INH、Mfx、Gfx相似,本研究未评价Lfx的早期杀菌活性,因此未增加1000 mg/d治疗组进行观察。
总之,在本研究人群中Lfx 600 mg/d和Lfx 800 mg/d显示了相似的抗结核疗效,因此费用和不良反应发生情况将是使用该药物的重要考虑,笔者结合血药浓度监测的情况,及耐药指南中的建议,MDR-TB治疗的Lfx剂量600 mg/d、800 mg/d均较好,但是由于差异没有统计学意义,故推荐MDR-TB治疗的Lfx剂量为600 mg/d,部分患者可应用到800 mg/d。
[1] Chang KC, Yew WW, Chan RC.Rapid assays for fluoroquino-lone resistance inMycobacteriumtuberculosis:a systematic review and meta-analysis. J Antimicrob Chemother,2010,65(8):1551-1561.
[2] Vilemagne B, Crauste C, Flipo M, et al. Tuberculosis: the drug development pipeline at a glance. Eur J Med Chem, 2012,51:1-16.
[3] Fillion A1, Aubry A, Brossier F, et al.Impact of fluoroquino-lone resistance on bactericidal and sterilizing activity of a moxifloxacin-containing regimen in murine tuberculosis. Antimicrob Agents Chemother,2013,57(9):4496-4500.
[4] Ahmad Z, Tyagi S, Minkowski A, et al. Contribution of mo-xifloxacin or levofloxacin in second-line regimens with or wi-thout continuation of pyrazinamide in murine tuberculosis. Am J Respir Crit Care Med, 2013,188(1):97-102.
[5] World Health Organization. Guidelines for the programmatic management of drug-resistant tuberculosis: 2011 update.Geneva: World Health Organization, 2011.
[6] Koh WJ, Lee SH, Kang YA, et al. Comparison of levofloxacin versus moxifloxacin for multidrug-resistant tuberculosis. Am J Respir Crit Care Med, 2013,188(7):858-864.
[7] Segreti J, Jones RN, Bertino JS Jr. Challenges in assessing microbial susceptibility and predicting clinical response to newer-generation fluoroquinolones. J Ocul Pharmacol Ther, 2012,28(1):3-11.
[8] Francis J. Curry National Tuberculosis Center, California Department of Public Health. 耐药结核病临床医生使用指南.2版.李亮,译. 北京:中国疾病预防控制中心结核病防治临床中心,中华医学会结核病学分会,世界卫生组织结核病研究培训合作中心,2008:49-66.
[9] Mpagama SG, Ndusilo N, Stroup S, et al. Plasma drug activity in patients on treatment for multidrug-resistant tuberculosis. Antimicrob Agents Chemother, 2014,58(2):782-788.
[10] Guerrini V, De Rosa M, Pasquini S, et al. New fluoroquinolones active against fluoroquinolones-resistantMycobacteriumtuberculosisstrains. Tuberculosis (Edinb), 2013,93(4):405-411.
[11] Jo KW, Lee SD, Kim WS, et al.Treatment outcomes and moxifloxacin susceptibility in ofloxacin-resistant multidrug-resistant tuberculosis. Int J Tuberc Lung Dis, 2014,18(1):39-43.
[12] Lemos AC, Matos ED. Multidrug-resistant tuberculosis. Braz J Infect Dis, 2013,17(2):239-246.
[13] Volmink J, Garner P. WITHDRAWN: interventions for promoting adherence to tuberculosis management. Cochrane Database Syst Rev, 2007,18(4):CD000010.
[14] Gao CH, Yu LS, Zeng S, et al.Personalized therapeutics for levofloxacin: a focus on pharmacokinetic concerns. Ther Clin Risk Manag, 2014,10:217-227.
[15] 孙雯雯,吴福蓉,肖和平,等. 强化期含左氧氟沙星方案保守治疗脊柱结核的近期疗效分析. 中国防痨杂志,2013,35(10):840-842.
[16] Patel SN, McGeer A, Melano R, et al. Susceptibility of Streptococcus pneumoniae to fluoroquinolones in Canada. Antimicrob Agents Chemother, 2011,55(8):3703-3708.
[17] Emilio D, 刘宇红, Catharina VW, 等.全球结核病控制:过去、现在和未来. 结核病与肺部健康杂志,2013,2(3):143-149.
[18] Lee J, Lee CH, Kim DK, et al. Retrospective comparison of levofloxacin and moxifloxacin on multidrug-resistant tuberculosis treatment outcomes.Korean J Intern Med, 2011,26(2):153-159.
[19] Maranetra KN. Quinolones and multidrug-resistant tuberculosis. Chemotherapy,1999,45(Suppl 2): 12-18.
[20] Jiang RH, Xu HB, Li L. Comparative roles of moxifloxacin and levofloxacin in the treatment of pulmonary multidrug-resistant tuberculosis: a retrospective study. Int J Antimicrob Agents,2013,42(1):36-41.
[21] Stahlmann R, Lode HM. Risks associated with the therapeutic use of fluoroquinolones. Expert Opin Drug Saf, 2013,12(4):497-505.
[22] Johnson JL, Hadad DJ, Boom WH,et al. Early and extended early bactericidal activity of levofloxacin, gatifloxacin and moxifloxacin in pulmonary tuberculosis. Int J Tuberc Lung Dis, 2006, 70(6):605-612.
(本文编辑:王然 薛爱华)
Study on the efficacy of antituberculosis regimens containing different dosage of levofloxacin in patients with MDR-TB
WANG Qing-feng, WANG Jun, WANG Jing, DUAN Hong-fei, GE Qi-ping, HUANG Xue-rui, DU Ya-dong, HAN Xi-qin, CHU Nai-hui.
Department of Tuberculosis, Beijing Chest Hospital, Capital Medical University, Beijing Tuberculosis and Thoracic Tumor Research Institute, Beijing 101149,China
WANG Qing-feng,Email:wangjunzt@126.com
Objective To observe the efficacy of antituberculosis regimens containing different dosage of levofloxacin in the treatment of multidrug-resistant tuberculosis(MDR-TB), and to guide to choose rational dosage of levofloxacin (Lfx) in clinical practice. Methods One hundred and twenty-five inpatients and outpatients with MDR-TB treated from Jan. 2011 to Nov. 2012 in Beijing Chest Hospital, Capital Medical University were enrolled, and all patients were randomly divided into 3 groups with different dosage of Lfx (400 mg/d-control group, 600 mg/d and 800 mg/d) combined with other anti-tuberculosis agents. Plasma samples were taken to detect plasma drug concentrations at 2 hours after taking Lfx at 7 days’ treatment. The clinical efficacy (sputum negative conversion rate) and adverse effects of the three groups were observed for 12 months. Statistical analysis was performed using the Statistical Package for the Social Sciences(SPSS) for Windows(version 13.0).Theχ2test was used in the comparison of categorical variables.The Kruskal-WallisHtest was applied in the mean comparison among many groups.P<0.05 was considered statistically significant. Results The rates of sputum conversion for the group of 600 mg/d Lfx at the end of 3, 6, 9 and 12 months were 53.8% (21/39), 56.4% (22/39), 59.0% (23/39) and 59.0% (23/39), which were significantly higher than those of the group of 400 mg/d Lfx (30.0% (12/40), 32.5% (13/40), 35.0% (14/40) and 35.0% (14/40)), respectively. The differences were significant statistically (χ2=4.60, 4.57, 4.95 and 4.95,P<0.05). The rates of sputum conversion of the group of 800 mg/d Lfx (60.0%(24/40), 65.0%(26/40), 65.0%(26/40) and 65.0% (26/40)) were also significant higher than those of the group of 400 mg/d Lfx at the different time of treatment. The differences were also significant statistically (χ2=7.27, 8.46, 7.20 and 7.20,P<0.05). However, the differences of the rates of sputum conversion between the group of 800 mg/d Lfx and 600 mg/d Lfx were not significant with statistics (χ2=0.31, 0.61, 0.21 and 0.21,P>0.05). Gastrointestinal reaction, muscle and joint pain and central nervous system abnormalities were the main performance as adverse reaction in the three groups. The rates of the main adverse reactions were 0.0%, 15.0% (6/40) and 0.0% for the group of 400 mg/d Lfx, 2.6% (1/39), 10.3% (4/39) and 2.6%(1/39) for the group of 600 mg/d Lfx, 5.0% (2/40), 17.5% (7/40) and 7.5%(3/40) for the group of 800 mg/d Lfx. There were no significant differences in adverse reactions among the three groups (χ2=2.04, 0.87 and 3.58,P>0.05). Conclusion 600 mg/d and 800 mg/d Lfx were better for MDR-TB treatment, but the difference was not statistically significant, so 600 mg/d is recommended for MDR-TB treatment and 800 mg/d can be applied for some cases.
Tuberculosis, pulmonary/drug therapy; Tuberculosis, multidrug-resistant/drug therapy; Ofloxacin; Treatment outcome
10.3969/j.issn.1000-6621.2015.02.009
“十二五”国家重大科技专项(2012ZX09303002)
101149 北京市结核病胸部肿瘤研究所 首都医科大学附属北京胸科医院结核一科
王庆枫,Email:wangjunzt@126.com
注 王庆枫和王隽为并列第一作者
2014-06-06)
