副猪嗜血杆菌hhdA克隆、抗原表位预测和表达
2015-05-15曾文斌刘悦欣聂小伟黄冬艳
曾文斌,刘悦欣,谢 巧,聂小伟,黄冬艳,王 萍*
(1.江西农业大学 动物科学技术学院,江西 南昌 330045;2.江西省家畜血防站,江西 南昌 330046)
副猪嗜血杆菌(Haemophilus parasuis,HPS)可引起猪的格氏病,临床上以多发性浆膜炎、关节炎、脑膜炎、肺炎为特征[1]。该菌已成为国内外引起保育仔猪死亡的一个重要因素,且死亡率呈显著上升趋势。目前,已有关于副猪嗜血杆菌毒力因子的报道[2-5],但对编码神经氨酸苷酶基因的了解还很少,对副猪嗜血杆菌外膜蛋白所引起的致病性研究还处于鉴定阶段,利用毒力因子来区分致病菌株和非致病菌株还存在缺陷[6-7]。毒力因子是构成细菌毒力的物质基础,在其病原菌的致病过程中发挥主要作用,因此对毒力因子生物学特性的研究是探索病原菌致病机理的首要任务[8]。为了进一步明确致病菌株和非致病性菌株的差异性,Meike等研究发现在HPS致病菌株基因组内有hhdA基因存在于大多数致病菌株中,而非致病菌株中为阴性[9]。因此,笔者对临床发病猪中所分离的HPS菌株进行hhdA基因的克隆,应用生物信息学软件对hhdA基因及其编码的蛋白质进行结构及功能的分析,构建pET-32a(+)-hhdA原核表达载体,诱导表达融合蛋白,将为进一步制备hhdA单克隆抗体提供免疫原并为研究hhdA分子生物学功能提供重组蛋白奠定基础。
1 材料与方法
1.1 载体和菌株
载体pMD18-T购自大连宝生物公司;感受态细胞Top10、BL21(DE3)菌株均购自天根生化科技(北京)有限公司;pET-32a(+)以及副猪嗜血杆菌均由本实验室保存。
1.2 工具酶和主要试剂
限制性内切酶BamH I与Hind III、rTaq DNA聚合酶、dNTPs、DNA Marker、琼脂糖凝胶DNA回收试剂盒、T4连接酶均为宝生物工程(大连)有限公司的产品;细菌基因组DNA提取试剂盒、质粒提取试剂盒购自天根生化科技(北京)有限公司;其他化学试剂均为国产分析纯产品。
1.3 引物设计与合成
根据GenBank数据库中的hhdA基因序列,利用Primmer3.0在线软件设计,由生工生物技术有限公 司 合 成1对 引 物:上 游 引 物:5′-GGATCCATTGGTAGTAAAGTGCAAGCG-3′;下 游 引 物:5′-AAGCTTACTTGCAGAAACGCTCACACT-3′。上下游引物的5′端分别引入BamH I和Hind III 2个酶切位点(下划线处)。
1.4 目的基因的PCR扩增
PCR模板为用细菌基因组 DNA提取试剂盒提取。PCR反应体系(25 μL):10×buffur 2.5 μL,dNTPs(2.5 mmol/L)1 μL,上、下游引物(25 μmol/L)各 0.5 μL,模板 DNA 2.5 μL,Taq DNA 聚合酶0.25 μL,无菌水17.75 μL;PCR 反应条件:94 ℃预变性5 min;94 ℃变性45 s,58 ℃退火45 s,72 ℃延伸1 min,共35个循环;最后72℃延伸10 min。扩增后,取5 μL PCR扩增产物于1%琼脂糖凝胶中进行电泳,于凝胶成像系统观察和记录结果。
1.5 目的基因的克隆与鉴定
采用DNA回收纯化试剂盒,回收纯化扩增片段,将纯化后的目的基因片段与载体pMD18-T于4℃连接过夜,将连接产物转化至感受态细胞TOP10中,涂布于含AMP的LB的固体培养基,37℃培养12~16 h后。挑取生长良好的单个菌落接种于含AMP的LB液体培养基中培养后,进行菌液PCR及提取质粒酶切鉴定。将阳性克隆质粒命名为pMD18-T-hhdA,并送至上海生工生物工程公司进行序列测定。
1.6 hhdA蛋白的二级结构预测
预测hhdA蛋白的二级结构用以下方法:用Garnier-Robson和Chou-Fasman方法预测hhdA蛋白的α-螺旋、β-折叠、β转角和无规则卷曲。用Karplus-Schulz法预测其蛋白骨架区的柔韧性。
1.7 hhdA蛋白抗原特异性淋巴细胞抗原表位的预测
Kyte-Doolittle方法预测hhdA蛋白的亲水区,Jameson-wolf方法预测hhdA蛋白的抗原指数,Emini原则预测hhdA蛋白可能的抗原表位,然后综合评价hhdA蛋白抗原特异性B淋巴细胞的抗原表位。
1.8 原核表达载体的构建
将pMD18-T-hhdA和pET-32a(+)分别经BamH I和Hind III双酶切,纯化回收hhdA小片段和pET-32a(+)大片段,用T4 DNA连接酶于4℃连接过夜,将连接产物转化于感受态细胞BL21(DE)中,挑取琼脂板上的单一菌落进行培养进行菌液PCR及提取质粒酶切鉴定。
1.9 目的基因的诱导表达
分别挑取含重组质粒pET-32a(+)-hhdA和空载体pET-32a(+)的BL21(DE3)单个克隆,接种含AMP的LB液体培养基,37℃,220 r/min振荡过夜。取过夜的菌液按1%接种至新鲜的含AMP的LB液体培养基,37℃,220 r/min振荡培养2~3 h,至菌液浓度OD600达0.6~0.8 mmol/L时,加入IPTG至终浓度为1 mmol/L,继续振荡培养,于4 h后离心收集菌体,用30 μL生理盐水重悬菌体,加入等量的2×SDS凝胶上样缓冲液,混匀后,于沸水中煮沸10 min,离心取上清液进行SDS-PAGE电泳。
2 结果与分析
2.1 目的基因的PCR结果
电泳结果表明,PCR扩增出大小约为1 797 bp的hhdA基因片段,与预期结果相符(图1)。
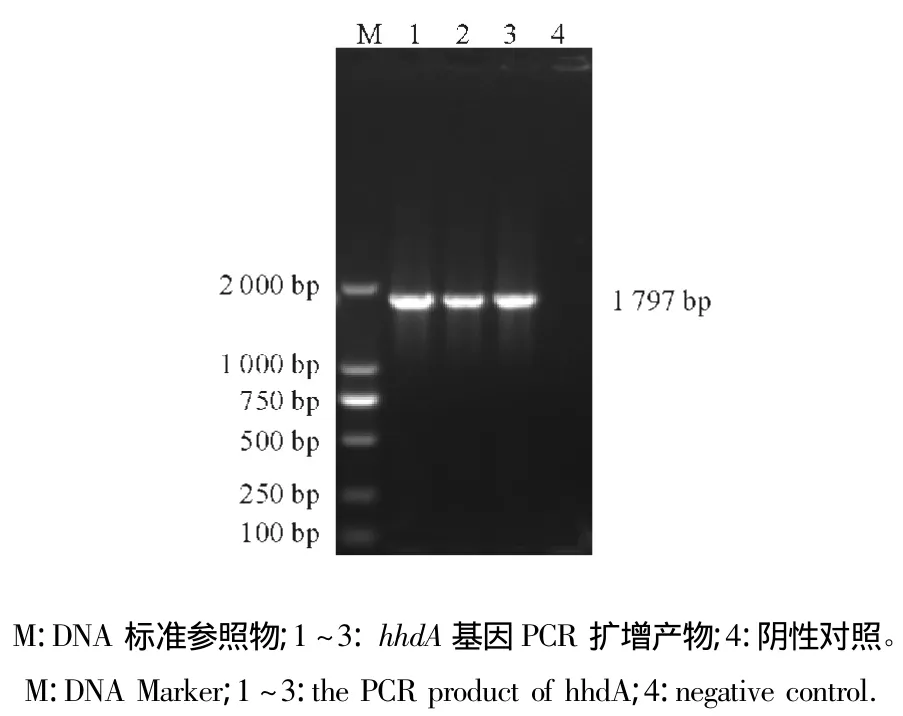
图1 hhdA基因的PCR扩增结果Fig.1 the PCR amplification of hhdA
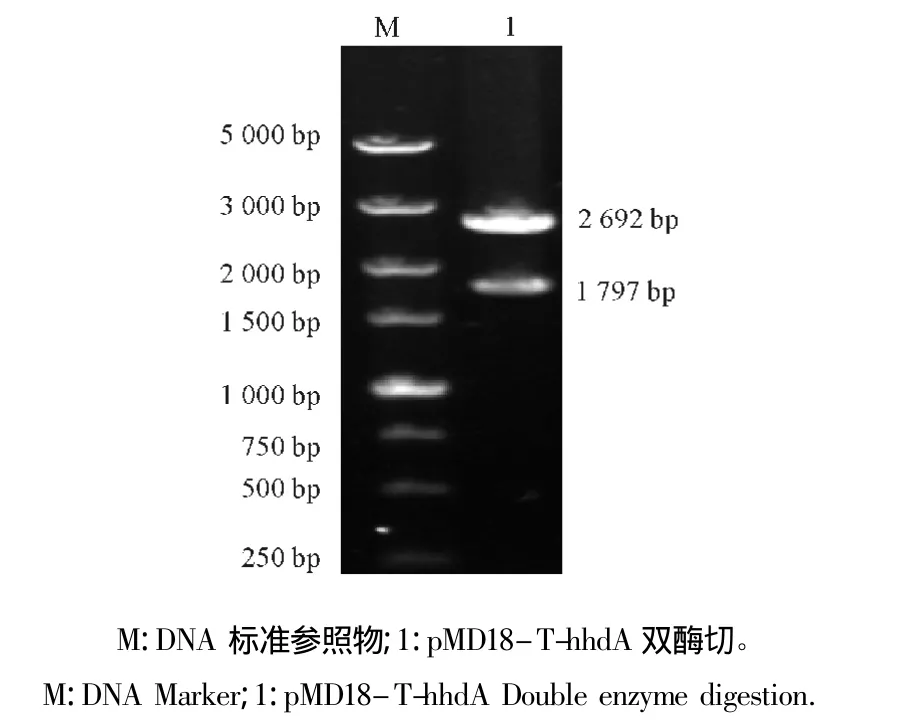
图2 pMD18-T-hhdA重组质粒的双酶切鉴定Fig.2 Analysis of recombinant plasmid pMD18-T-hhdA by enzymatic digestion
2.2 pMD18-T-hhdA重组质粒的鉴定与序列测序
将目的基因片段与载体pMD18-T连接转化到感受态细胞TOP10后,进行菌液PCR鉴定,扩增出1 797 bp的目的基因片段。再对提取的pMD18-T-hhdA重组质粒经BamH I和Hind III双酶切后,分别切出了1 797 bp的目的片段和2 692 bp载体片段(图2),进一步证实了阳性重组质粒。测序结果表明,扩增出的hhdA基因不含终止密码子的目的基因,插入位点、大小与读码框均正确,与已发表的副猪嗜血杆菌ZJ0906的hhdA基因同源性为99.8%,氨基酸同源性99.6%。
2.3 hhdA蛋白二级结构的预测
将HPS hhdA基因编码的总共599个氨基酸序列运用DNAStar Protean软件模块进行二级结构的预测(图3),由于使用不同的预测方法分析,预测的结果并不完全相同,所含的α螺旋、β折叠和无规则卷曲的数目及其存在的位置都有一些差异。
用Garnier-Robson方法计算出特定氨基酸残基在特定结构内部的可能性结果:α-螺旋区域(22个),β-折叠区域(43个),β转角(14个),无规则卷曲(32个);用Chou-Fasman方法预测hhdA蛋白质的二级结构结果:α-螺旋区域(17个),β-折叠区域(27个),β转角(44个),无规则卷曲(32个);用Karplus-Schulz方法预测蛋白质骨架区的柔韧性区段较多(40个),呈散在分布,这些区域由柔性氨基酸构成,在空间结构中表现为物理上的灵活性,形成B细胞抗原表位的可能性较大,易于抗体进行嵌合。

图3 根据2种不同的方法预测hhdA蛋白的二级结构Fig.3 Secondary structure of hhdA protein predicted by two different methods
2.4 hhdA蛋白抗原特异性B细胞抗原表位的预测
按照Kyte-Doolittle法的氨基酸亲水性标准,hhdA蛋白具有较高的亲水性,主要包括在第25~55、93 ~158、183 ~195、210 ~250、275 ~335和450 ~480位区段,根据Emini原则分析表面可能的抗原表位,结果显示,hhdA蛋白中表面可及性较高的区域43 ~50、94 ~106、150~158、274 ~289和326 ~334位区段,而且这些区段都位于hhdA区段的亲水性区域;Jameson-Wolf法预测hhdA抗原指数的结果显示,hhdA蛋白的大多数区域的抗原指数都比较高。综合预测结果,hhdA蛋白上位于蛋白分子表面的区段都有可能是B细胞抗原表位的优势表位(图4)。
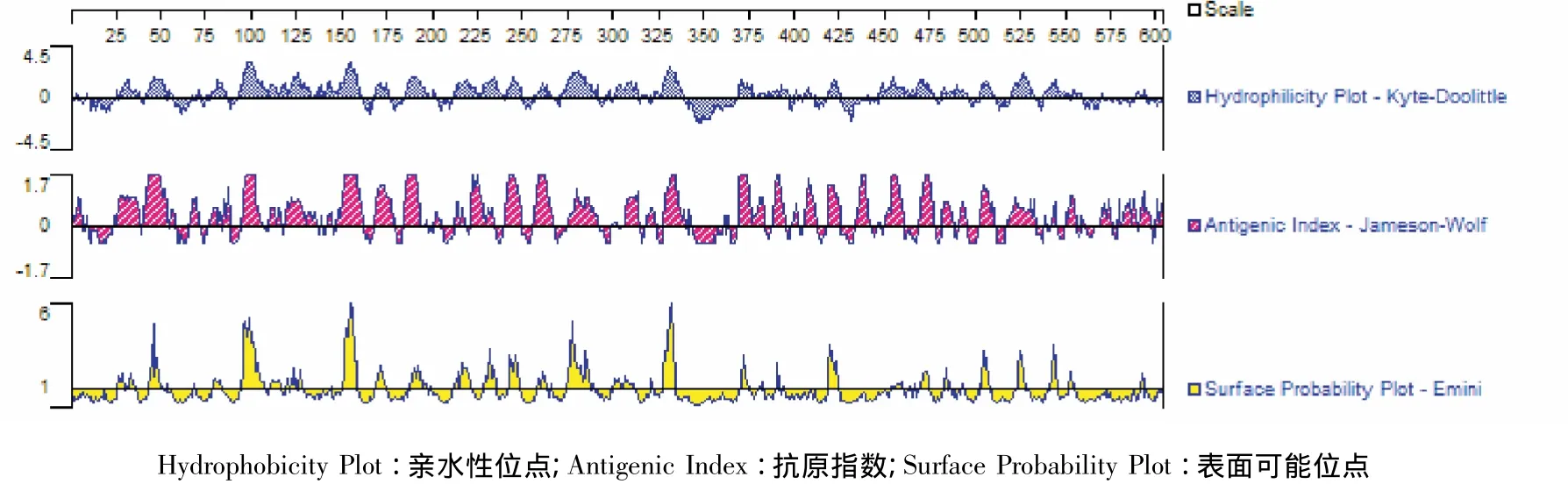
图4 hhdA蛋白亲水性位点、抗原指数和表面可能位点预测结果Fig.4 Analysis of hydrophilicity plot,antigenic index and surface probability of hhdA protein
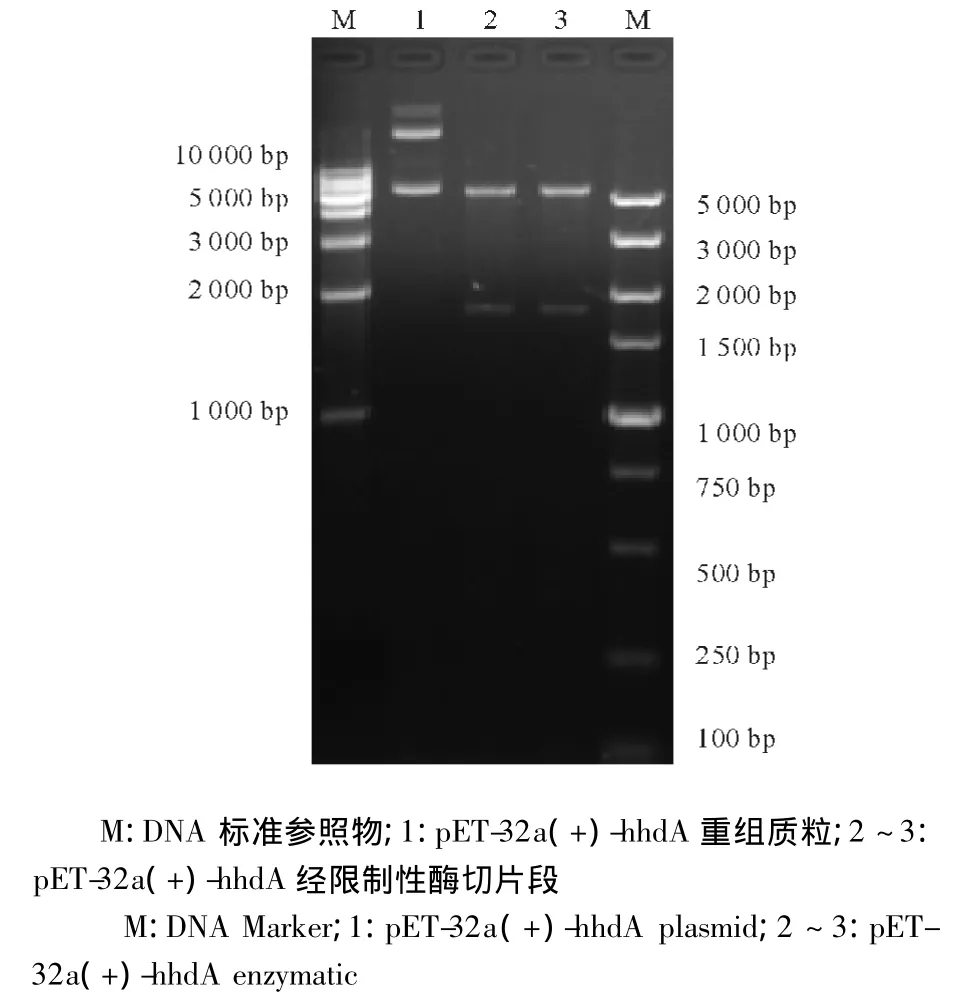
图5 pET-32a(+)-hhdA重组质粒的酶切鉴定Fig.5 Analysis of recombinant plasmid pET-32a(+)-hhdA by enzymatic digestion
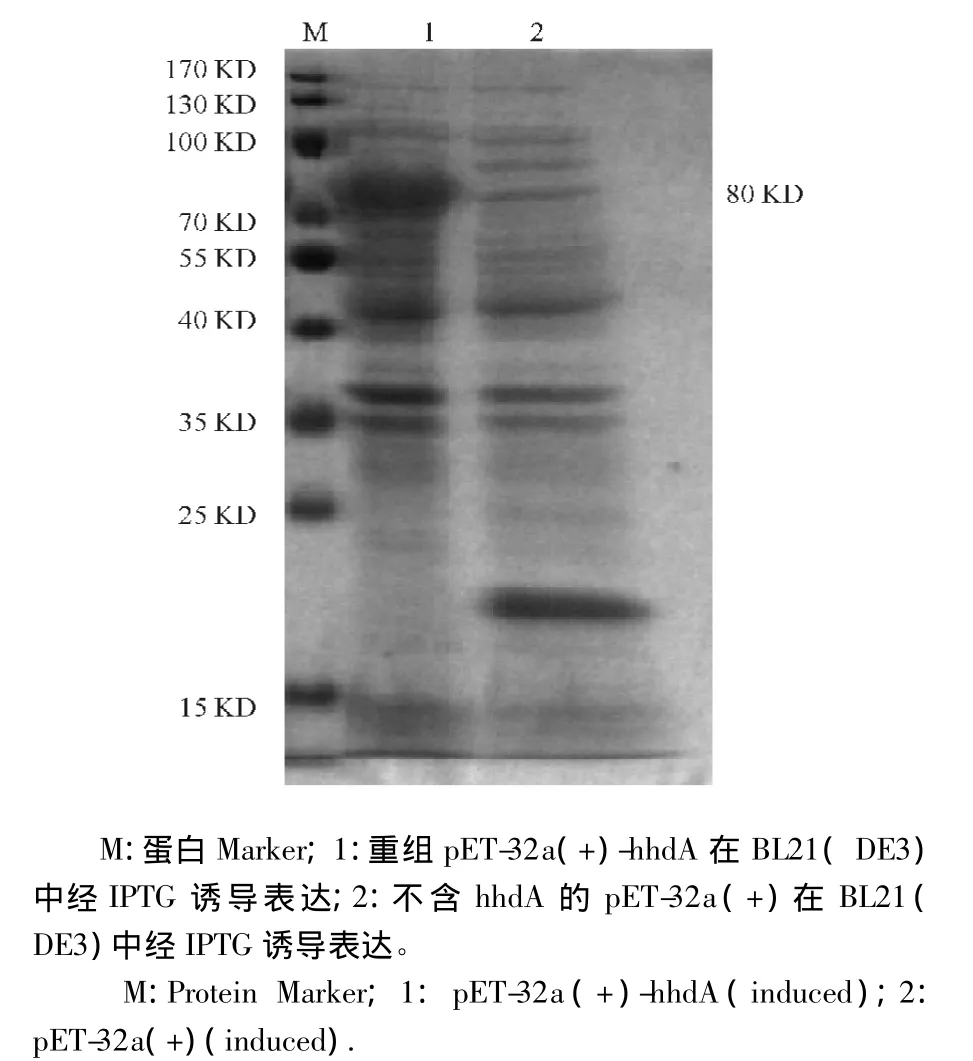
图6 重组pET-32a(+)-hhdA在BL21(DE3)中表达产物的电泳Fig.6 The expression of pET-32a(+)-hhdA in BL21(DE3)
2.5 原核表达载体的酶切鉴定
将构建的原核表达质粒用BamH I和Hind III进行酶切,可以得到5 900 bp和1 797 bp片段(图5)。与理论设计相符,经PCR鉴定,扩增出1 797 bp片段,进一步证实了阳性重组质粒。
2.6 hhdA基因的诱导表达
将鉴定阳性的重组表达质粒转化pET-32a(+)-hhdA和空载体pET-32a(+)分别转化BL21(DE3),经IPTG诱导表达后,进行SDS-PAGE电泳,表达产物的相对分子质量约为80 kD(图6)。
3 讨论
hhdA基因在杜克雷嗜血杆菌中编码溶血素蛋白,其活性与沙雷菌的溶血素蛋白相同亦同源。副猪嗜血杆菌中有段核苷酸序列所编码的氨基酸序列与杜克雷嗜血杆菌溶血素hhdA的氨基酸序列有很高的相似性,从而将这段核苷酸序列假定为副猪嗜血杆的hhdA基因[10],但该基因是否是副猪嗜血杆菌毒力特征基因还处在研究鉴定中[11-13]。hhdA基因在致病菌株中具有良好的保守性,不同血清型致病菌株的hhdA基因存在较近的遗传进化关系。因hhdA基因在非致病菌株中为阴性,所以,可考虑将hhdA基因作为区分致病菌株和非致病菌株的候选对象,以完善对副猪嗜血杆菌致病菌株的鉴定方法[14]。目前,对副猪嗜血杆菌hhdA基因以及编码蛋白的生物学特性还不是很清楚[15]。
本研究应用PCR技术成功扩增了副猪嗜血杆菌的hhdA基因1 797 bp,序列测定表明HPS的hhdA基因十分保守,与GenBank上公布的ZJ0906株(CP005384.1)中对应的核苷酸序列同源性为99.8%,氨基酸同源性99.6%。另外本研究应用免疫信息学,对hhdA蛋白的二级结构及其潜在的B细胞抗原表位进行了预测和分析。结果显示hhdA含有较多α-螺旋、β-折叠、β转角和无规则卷曲等二级结构,而且有较多柔性区域,呈散在分布,这些区域由柔性氨基酸构成,在空间结构中表现为物理上的灵活性,形成B细胞抗原表位的可能性较大,易于抗体进行嵌合。抗原表位代表抗原分子上的一个免疫活性区,与相应的受体结合。在体液免疫应答中,B细胞识别蛋白抗原是以其表面的B细胞受体与蛋白抗原表位结合,从而诱导高度特异性的体液免疫,根据不同的参数,研究评价了hhdA蛋白潜在的抗原特异性B淋巴细胞抗原优势表位。抗原指数分析结果表明,hhdA有较高的抗原指数区域;从表面可能性分析,大部分在蛋白表面,能直接成为B细胞表位(抗体表位),且抗原指数较高,是潜在的候选抗原位点。进一步本试验以质粒pET-32a(+)为原核表达载体,构建了重组原核表达质粒pET-32a(+)-hhdA,并在表达菌BL21(DE3)中成功诱导表达了副猪嗜血杆菌hhdA融合蛋白。表达蛋白的相对分子质量约为80 kD,与预期结果相符。
研究运用多参数综合预测的方法在一定程度上提高了预测的准确度,但是,目前几乎所有的B细胞表位预测的方法都是预测连续氨基酸构成的线性表位,而基于蛋白质的三级结构来预测构象表位的方法较少[15]。此外,对于B细胞表位预测的结果也缺少标准的评估方法[16]。因此,试验的预测结果也只能作为hhdA蛋白潜在表位的参考,对HPS hhdA主要抗原蛋白结构蛋白区B细胞表位的筛选,还有待于进一步鉴定。本实验通过对副猪嗜血杆菌hhdA基因的扩增、克隆、生物信息学分析以及原核表达,为进一步研究HPS hhdA生物学功能及抗体制备和开发hhdA基因工程产品奠定了基础。
[1]王晨燕,林裕胜,车勇良,等.副猪嗜血杆菌病诊断方法研究进展[J].动物医学进展,2014(01):86-90.
[2]Yu J,Wu J,Zhang Y,et al.Identification of putative virulence-associated genes among Haemophilus parasuis strains and the virulence difference of different serovars[J].Microb Pathog,2014,77:17-23.
[3]王湘如.副猪嗜血杆菌毒力因子筛选和capD基因功能研究及致脑膜炎大肠杆菌突破血脑屏障的分子机制研究[D].武汉:华中农业大学,2014.
[4]马广鹏.副猪嗜血杆菌毒力因子研究进展[J].动物医学进展,2013(2):83-88.
[5]Martinez-Moliner V,Soler-Llorens P,Moleres J,et al.Distribution of genes involved in sialic acid utilization in strains of Haemophilus parasuis[J].Microbiology,2012,158(Pt 8):2117-2124.
[6]Oliveira S,Pijoan C.Computer-based analysis of Haemophilus parasuis protein fingerprints[J].Can J Vet Res,2004,68(1):71-75.
[7]Metcalf D S,MacInnes J I.Differential expression of Haemophilus parasuis genes in response to iron restriction and cerebrospinal fluid[J].Can J Vet Res,2007,71(3):181-188.
[8]Palmer K L,Thornton A C,Fortney K R,et al.Evaluation of an isogenic hemolysin-deficient mutant in the human model of Haemophilus ducreyi infection[J].J Infect Dis,1998,178(1):191-199.
[9]侯娜,张培君,龚玉梅,等.副猪嗜血杆菌潜在毒力因子的综述[J].中国畜牧兽医,2013(1):36-41.
[10]Sack M,Baltes N.Identification of novel potential virulence-associated factors in Haemophilus parasuis[J].Vet Microbiol,2009,136(3/4):382-386.
[11]宋帅,李春玲,李淼,等.副猪嗜血杆菌hhdA基因的克隆与分子特征[C].郑州:中国畜牧兽医学会动物传染病学分会第四次猪病防控学术研讨会,2010.
[12]宋帅,李春玲,杨冬霞,等.副猪嗜血杆菌hhdA基因的鉴定和分析[C].广州:2010第二届中国食品安全高峰论坛,2010.
[13]臧莹安,陈国开,庞木生,等.副猪嗜血杆菌分离株hhdA和hhdB基因的克隆及同源性分析[J].中国兽医学报,2012(11):1662-1668.
[14]宋帅,李春玲,杨冬霞,等.副猪嗜血杆菌hhdA基因的鉴定和分析[J].湖南农业大学学报:自然科学版,2011,37(3):290-294.
[15]Jin H,Zhou R,Kang M,et al.Biofilm formation by field isolates and reference strains of Haemophilus parasuis[J].Vet Microbiol,2006,118(1/2):117-123.
[16]Kolaskar A S,Kulkarni-Kale U.Prediction of three-dimensional structure and mapping of conformational epitopes of envelope glycoprotein of Japanese encephalitis virus[J].Virology,1999,261(1):31-42.
