N,N′-二(三硝基乙基)-5,6-二氨基呋咱并[3,4-b]吡嗪(DNFP)的合成与性能
2015-05-14李敏霞杨红伟吕春绪程广斌
李敏霞, 伍 波, 杨红伟, 吕春绪, 程广斌
(南京理工大学化工学院, 江苏 南京 210094)
1 引 言
高能量密度含能材料是当今含能材料领域的研究热点。为了提高炸药的能量,寻找综合性能超过HMX,对环境友好的高能量密度材料[1-2],是科研工作者不懈追求的目标。研究结果表明[3-5]: 无氢或者少氢高氮多硝基化合物是提高CHON炸药能量密度的有效方法之一。多硝基的存在可以提高化合物的密度和改善氧平衡。三硝基乙基是一种多硝基基团,是设计和合成高能量密度化合物的理想修饰单元[6,11]。含能杂环中三硝基乙基的引入打破了炸药领域中多硝基化合物的合成仅使用硝化的陈规,引起了含能领域研究者的广泛关注。三硝基乙醇与直链烷烃的氨基[13]、呋咱的氨基[7,12]、唑类[8-9]的氨基、或者四嗪[9]中的氨基Mannich缩合反应生成三硝基乙基类含能化合物均已有报道,相对而言,以钝感的氨基呋咱吡嗪类化合物为底物,利用此类反应生成三硝基乙基呋咱吡嗪类衍生物的合成及爆轰性能报道较少[10]。为此,本研究以5,6-二羟基呋咱并[3,4-b]吡嗪(DHFP)为原料,经过氯代、胺化,N-羟甲基化及缩合等四步反应得到了N,N′-二(三硝基乙基)-5,6-二氨基呋咱并[3,4-b]吡嗪(DNFP)。探讨DNFP的合成反应机理。采用密度泛函理论B3LYP/6-311G(d,p)基组方法对DNFP的结构进行全优化,通过设计等键反应计算该分子的生成焓,运用Kamlet-Jacobs公式预估其爆热、爆速及爆压。
2 实验部分
2.1 试剂与仪器
5,6-二羟基呋咱[3,4-b]吡嗪(自制), 三硝基甲烷(自制), 三氯氧磷、五氯化磷、甲醛,分析纯,南京化学试剂厂; 氨水(25%~28%),(分析纯,南京化学试剂一厂),乙腈(分析纯,京科通化工科技有限公司)。
Bruker Avance III500M 数字化核磁共振仪(瑞士Bruker公司), TSQ Quantum质谱仪(美国Finnigan公司), Bruker Tensor27傅里叶红外变换光谱仪(瑞士Bruker公司),SEA1000All元素分析仪(日本日立公司),高效液相色谱仪(LC-20AT,日本岛津公司)
2.2 合成路线
N-三硝基乙基化合物的合成有两种路径[14](如Scheme 1所示)。Path 1(一步法): 氨基化合物直接和三硝基乙醇(TNE)反应得到N-三硝基乙基化合物。Path 2(两步法): 氨基化合物先与甲醛氮羟甲基化反应,然后与三硝基甲烷(NF)缩合反应得到N-三硝基乙基化合物。反应式如图1所示。其中Path 1是两分子反应,反应时物料比例易于控制。但是部分氨基化合物以此路线得不到目标化合物,可按照Path 2进行反应,其原因可能有两种,一是氨基的电子云密度较低,不足以直接进攻取代三硝基乙醇上的羟基。二是部分氨基具有还原性,在酸性条件下能和硝基发生氧化还原反应,先和甲醛反应可降低其还原性。
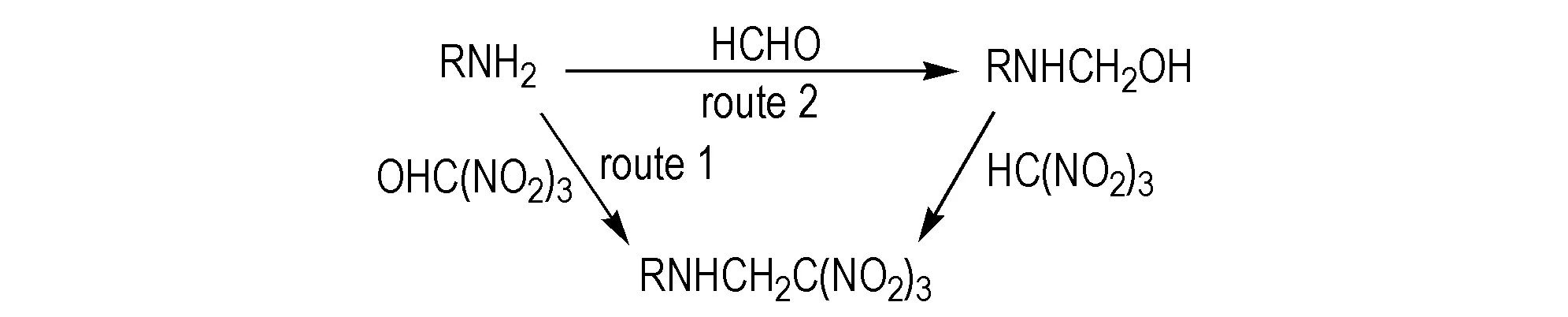
Scheme1Two synthesis routes ofN-trinitroethyl
为此,本研究以DHFP为原料,经过氯代和胺化反应得到5,6-二氨基呋咱并[3,4-b]吡嗪(DAFP); DAFP采用上述的路径2,先与甲醛反应得到氮羟甲基中间体5,6-二羟甲基氨基呋咱并[3,4-b]吡嗪(DMFP); 后分子间脱水缩合得到目标化合物DNFP。具体反应式如Scheme 2所示。
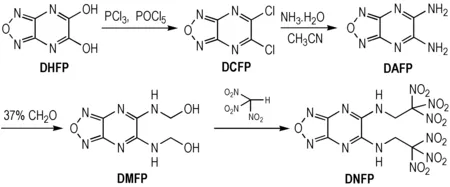
Scheme2Synthesis route of target compound
2.3 实验步骤
2.3.1 5, 6-二氯呋咱并[3,4-b]吡嗪(DCFP)的合成
室温搅拌下,向装有2.7 g (13 mmol) 五氯化磷和1.0 g ( 6.5 mmol)5,6-羟基呋咱并[3,4-b]吡嗪的反应瓶,缓慢加入4.5 mL三氯氧磷,升温至回流,反应5 h,冷却至室温,减压蒸馏除去三氯氧磷,于冰浴条件下向其中缓慢加入2.0 mL冰水,过滤,将滤饼溶解于1.0 mL丙酮和1.5 mL水的混合液中,静置,析出固体,过滤,干燥得到无色固体0.86 g,收率69%。IR(KBr,ν/cm-1): 1573, 1462~1158 (CN),1032 (呋咱环), 870~820 (C—Cl);13C NMR(DMSO-d6, 126 MHz),δ: 155.6 (C—Cl), 151.2 (C—N) ; ESI-MS (m/z): 192 [M+1]+; 元素分析 (C4Cl2N4O, %) 计算值, C 25.26, N 29.47, Cl 37.37, 实测值, C 25.17, N 29.03, Cl 37.72。
2.3.2 5, 6-二氨基呋咱并[3,4-b]吡嗪(DAFP)的合成
0 ℃ 搅拌下,向装有2.5 mL乙腈和12.0 mL(25%~28%)氨水的反应瓶中,分批加入3.8 g (20 mmol)DCFP,温度控制在0 ℃,反应2.5 h,有大量黄色固体析出,过滤,洗涤,将滤饼溶于N,N′-二甲基甲酰胺(DMF)中静置, 析出固体, 过滤干燥得到黄色固体DAFP 2.3 g,收率75%。IR (KBr,ν/cm-1): 3465~3228 (NH2), 1657~1532 (CN), 1338~1017 (呋咱环), 850 (C—N);13C NMR(DMSO-d6,126 MHz), δ: 150.8 (C—NH2), 150.5 (C—N);1H NMR(DMSO-d6, 500 MHz),δ: 7.6 (NH2); ESI-MS (m/z): 153[M+1]+; 元素分析 (C4H4N6O, %), 计算值, C 31.58, H 2.65, N 55.24, 实测值, C 31.50, H 2.47, N 54.97。
2.3.3 5,6-二羟甲基氨基呋咱并[3,4-b]吡嗪(DMFP)的合成
室温搅拌下,将3.0 g (20 mmol)DAFP加入到8 mL 37%甲醛和2 mL水的混合液中,反应30 h, 静置,析出固体,过滤,水洗,五氧化二磷干燥,得到固体4.0 g,收率92%。IR(KBr,ν/cm-1): 1022(呋咱环), 3100(NH), 3400(OH);13C NMR(DMSO-d6, 126 MHz)δ:150.2 (C—NH),149.6 (C—N), 65.1 (CH2);1H NMR(DMSO-d6,500 MHz),δ: 4.8 (s, 4H, CH2); 6.1 (s, 2H, OH); 8.6 (s, 2H, NH), 元素分析(C6H8N6O3, %), 计算值, C 33.96, H 3.77, N 39.62, 实测值, C 33.55, H 3.56, N 40.03。
2.3.4 N,N′-二(三硝基乙基)-5,6-二氨基呋咱并[3,4-b]吡嗪(DNFP)的合成
配置质量分数为20%的硝仿水溶液(0.75 g 硝仿溶解于3 mL水中),将0.42 g (2 mmol)化合物5,6-二羟甲基氨基呋咱[3,4-b]吡嗪,缓慢加入到此溶液,室温搅拌30 h,产生悬浮液,置于冰箱中静置2 h,离心,抽滤,滤饼于1,4-二氧六环溶剂中重结晶,过滤,冰水洗涤并干燥得到浅黄色固体0.62 g,收率65%。 IR (KBr,ν/cm-1): 1028 (呋咱环), 1600 (NO2), 3350 (NH);13C NMR(DMSO-d6,126 MHz),δ: 151.2 (C—NH), 150.3 (C—N), 128.5 (C(NO2)), 50.0 (CH2);1H NMR(DMSO-d6, 500 MHZ),δ: 5.6 (d, 4H, CH2), 8.95 (t, 2H, NH); 元素分析(C8H6N12O13, % ),计算值, C 20.08, H 1.25, N 35.15, 测量值, C 20.52, H 1.42, N 34.72。
3 结果与讨论
3.1 DNFP的合成机理及合成条件的探讨
以水作为溶剂,以摩尔比n(DAFP)∶n(TNE)=1∶2, 反应温度为60 ℃,一步法反应并未得到DNFP。尝试添加催化剂无水FeCl3,提高反应温度,增加三硝基乙醇的量,以及更换溶剂甲醇、盐酸溶液等均未得到目标化合物DNFP。其原因可能是氨基与三硝基乙醇的反应与氨基的活性有关。DAFP中呋咱环的强吸电子效应使得氨基的电子云密度降低,再者氨基的孤对电子和呋咱吡嗪环形成了p-π共轭,使得氨基的电子云密度由于电子离域的影响进一步降低,最终导致DAFP中氨基活性较低,不足以直接进攻取代三硝基乙醇上的羟基,须采用分步反应才可以得到DNFP。其中具体的反应机理如Scheme 3所示: DAFP中的氨基进攻甲醛中羰基的碳原子形成氮正离子中间体,再经H+转移生成氮羟甲基化产物DMFP,氮羟甲基化产物和三硝基甲烷(NF)发生分子间脱水生成DNFP。
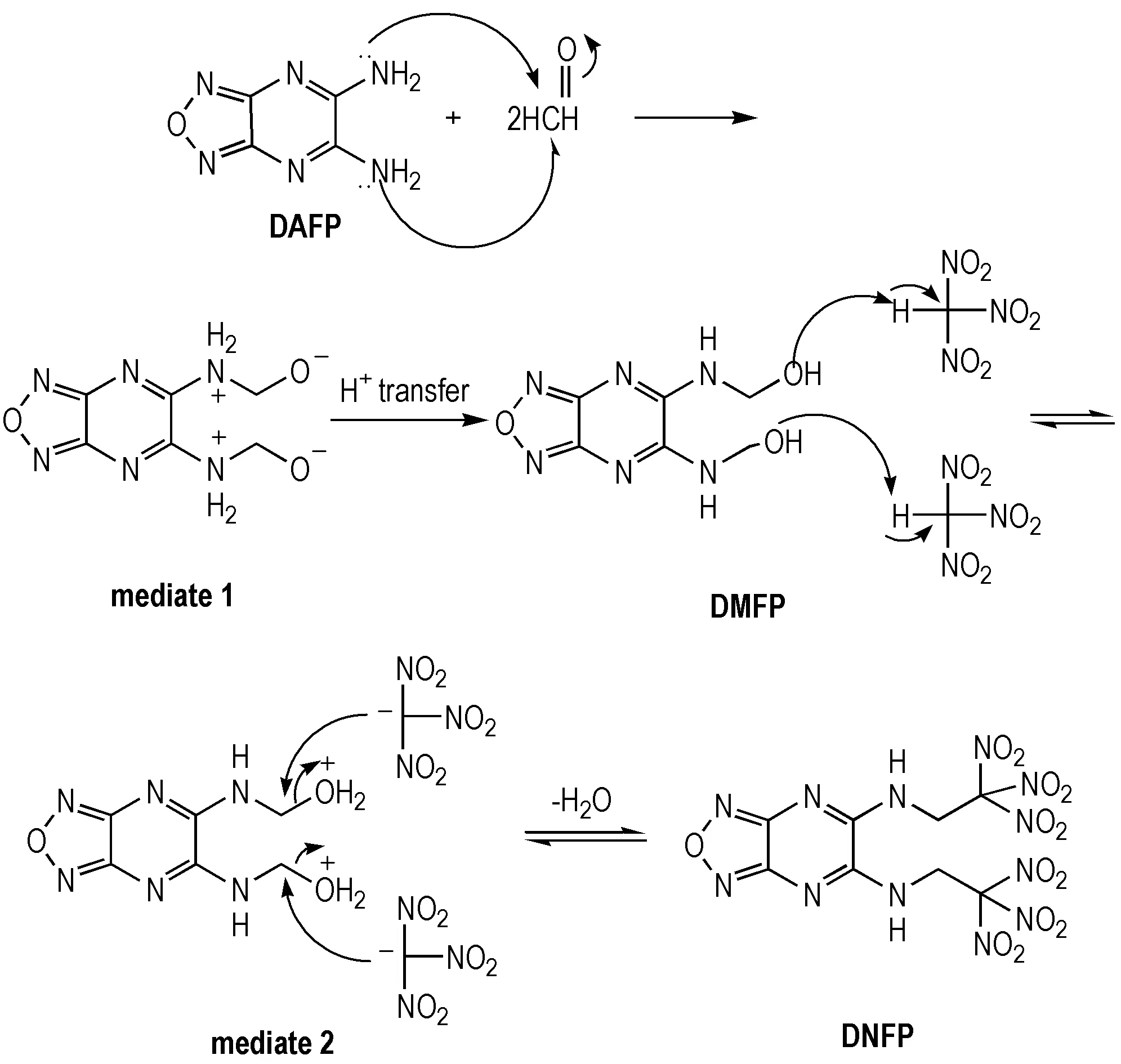
Scheme3Reaction mechanism for DNFP synthesis
DNFP两步合成法中DNFP的合成收率较小,为59.8%(以DMFP计),羟甲基化产率为92%,影响DNFP合成收率的步骤主要是缩合反应。由于DMFP在不同的溶剂中溶解差异较大,直接影响着DNFP的合成收率。在室温条件下考察质子溶剂甲醇、乙醇及水和非质子丙酮及乙腈对目标化合物DNFP合成收率的影响,结果见表1。
由表1可以看出, 在非质子溶剂丙酮和乙腈中反应时间较长,反应产率较低,分别为25%和20%。而在质子溶剂甲醇、乙醇及水中,反应时间明显缩短,反应产率较高。可能由于DNFP在非质子性溶剂中溶解度较小,在强质子溶剂水中溶解度相对大些。质子溶剂可以与反应中产生的负离子氧形成氢键,从而使得氧强烈的溶剂化,分散负电荷,进而负离子更稳定,有利于解离反应的进行。
表1反应溶剂对DNFP反应收率的影响
Table1Effects of various solvents on the yield of DNFP

solventt/hyield/%ethanol4568methanol4568water3065acetone7225acetonitrile7220
Note: Water, methanol and ethanol were protic solvent. Acetone and acetonitrile were aprotic solvent.
3.2 DNFP的生成热及爆炸性能的计算
运用Gaussian 98程序[15],采用密度泛函理论B3LYP/6-311G(d,p)优化了DNFP的几何构型。通过设计等键反应能预测许多有机化合物的生成热(HOF)。所设计的等键反应过程中,呋咱吡嗪骨架保持不变,反应前和反应后化学键的数量和形式均保持相同,这样可以减少系统误差,而且大的分子改变成小分子的时候也不改变其主要骨架。运用Born-Haber循环[16]进行计算(Scheme 4所示)。
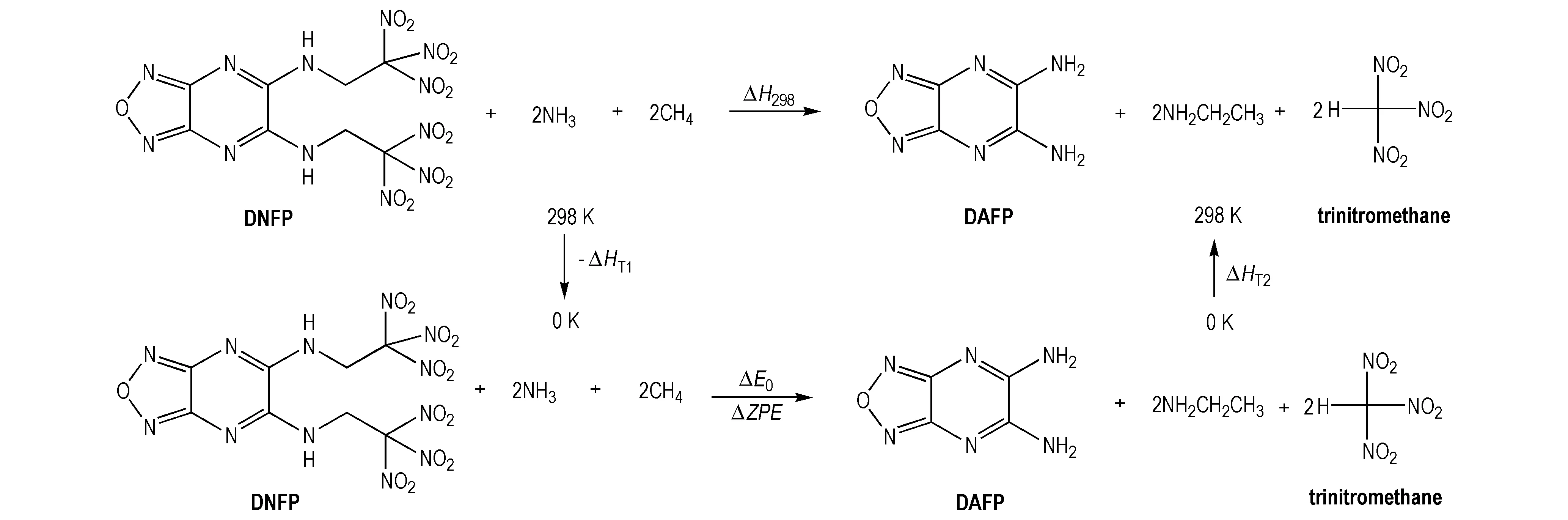
Scheme4Born-Haber system forming for DNFP
在298 K下的反应焓的变化可以表示为:
ΔH298=∑ΔfHP-∑ΔfHR
(1)
ΔfHR和ΔfHP分别是298 K反应物与生成物标准生成热之和,H298可用(2)式计算:
ΔH298=ΔE298+Δ(PV)=ΔE0+ΔZPE+ΔHT+ΔnRT
(2)
式(2)中,ΔE0是在0 K时生成物和反应物总能量之差;ZPE是在0 K时生成物和反应物零点能之差; ΔHT是从0 K到298 K的温度校正系数; Δ(PV) 在理想气体反应中等于体积变化时所做的膨胀功ΔnRT(J)。对于等键反应,由于n=0,所以Δ(PV)=0。化合物NH3、CH4、NH2CH2CH3生成热的实验值通过已知文献查得[11,17],呋咱吡嗪环和三硝基甲烷的生成热通过高水平CBS-4M方法,结合原子化反应计算求得。N,N′-二(三硝基乙基)-5,6-二氨基呋咱并[3,4-b]吡嗪(DNFP)的生成热就可以运用Born-Haber计算(见表2)。
表2DNFP及参考物的总能量和生成焓
Table2Total energy and heat of formation for the title and reference compounds
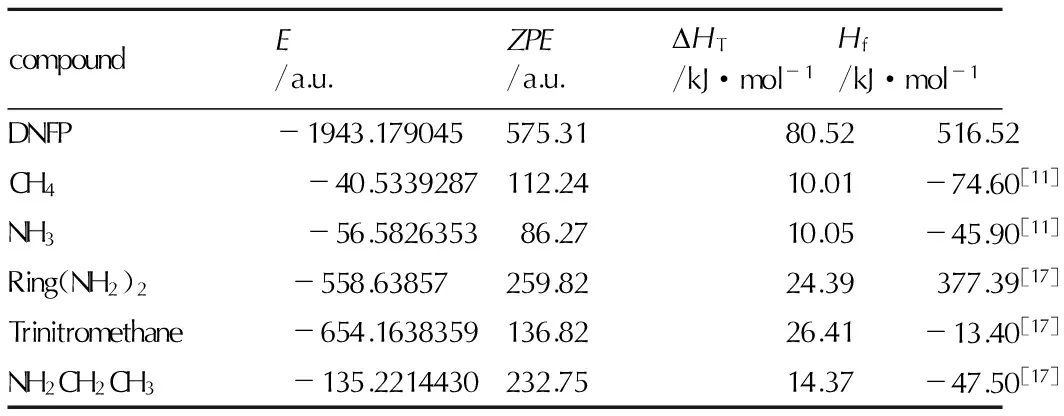
compoundE/a.u.ZPE/a.u.DHT/kJ·mol-1Hf/kJ·mol-1DNFP-1943.179045575.3180.52516.52CH4-40.5339287112.2410.01-74.60[11]NH3-56.582635386.2710.05-45.90[11]Ring(NH2)2-558.63857259.8224.39377.39[17]Trinitromethane-654.1638359136.8226.41-13.40[17]NH2CH2CH3-135.2214430232.7514.37-47.50[17]
Note:Eis the total energy of compound,ZPEis vibrational zero-point energy,HTis thermal correction to enthalpy,Hfis heat of formation.
由DNFP的稳定构型,利用Monte-Carlo方法[18]和自编程序,基于0.001e·bohr-3等电子密度面所包围的体积空间求得分子平均摩尔体积,进而由摩尔质量求得分子的密度。用Kamlet-Jacobs方程[19]计算DNFP的爆轰性能,见表3。由表3可知,所获得的目标化合物与HMX爆轰性能相当。
表3DNFP,HMX的爆轰性能参数
Table3Detonation performance of DNFP and HMX
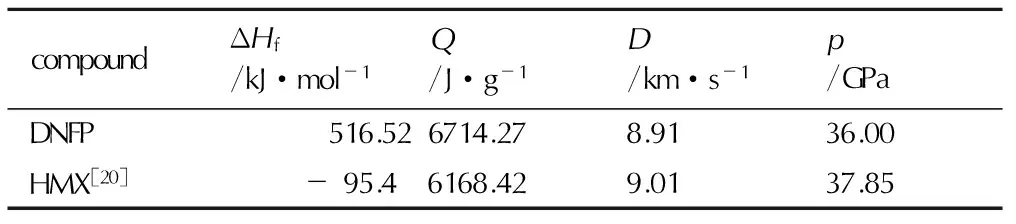
compoundΔHf/kJ·mol-1Q/J·g-1D/km·s-1p/GPaDNFP516.526714.278.9136.00HMX[20]-95.46168.429.0137.85
Note: ΔHfis heat of formation,Qis heat of detonation,Dis detonation velocity,pis detonation pressure.
4 结 论
以5,6-二羟基呋咱[3,4-b]吡嗪DHFP为原料,经氯代、胺化、羟甲基化,缩合等四步反应得到N,N′-二(三硝基乙基)-5,6-二氨基呋咱并[3,4-b]吡嗪(DNFP),总收率为31%(以DHFP计)。DNFP的合成需先经过羟甲基化,后缩合反应得到。探讨了溶剂对DNFP合成收率的影响,确定最佳溶剂为质子性溶剂。DNFP的爆热、爆速、爆压及生成焓分别为6714 J·g-1、 8.91 km·s-1、 36 GPa及516.52 kJ·mol-1,接近HMX的爆轰性能。
参考文献:
[1] 阳世清,徐松林,黄亨健,等. 高氮化合物及含能材料[J]. 化学进展,2008, 20(4): 526-536.
YANG Shi-qing, XU Song-lin, HUANG Heng-jian, et al. High nitrogen compounds and their energy materials[J].ProgressinChemistry, 2008, 20(4): 526-536.
[2] 罗义芬, 王伯周, 陈晓芳, 等. 1,3,4,6-四硝基吡唑[4,3-c]并吡唑(TNPP)合成[J]. 含能材料,2012, 20(6): 814-815.
LUO Yi-fen, WANG Bo-zhou, CHEN Xiao-fang, et al. Synthesis of 1,3,4,6-tetranitropyrazole[4,3-c] pyrazole(TNPP)[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2012, 20(6): 814-815.
[3] 贾思媛, 张海昊, 王伯周, 等. 3,4-双(3′-氨基呋咱-4′-基)呋咱的合成与表征[J]. 含能材料, 2013, 21(3): 289-293.
JIA Si-yuan, ZHANG Hai-hao, WANG Bo-zhou, et. al. Synthesis and characterization of 3,4-bis-(3′-aminofurazal-4′-yl)-furzan(BATF)[J].ChineseJournalofEnergeticMaterials(HannengCailiao), 2013, 21(3): 289-293.
[4] Nivikova T S, Meinikova T M, Khari-tonova O V, et al. An effective method for the oxidation of aminofurazans to nitrofurazans[J].MendeleevCommunication, 1994, 4(4): 138-140.
[5] Sheremeteev A B. Chemistry of furazan fused to five me-mbered rings[J].JournalofHeterocyclicChemistry, 1995, 32(2): 371-385.
[6] YIN Ping, ZHANG Qing-hua, ZHANG Jia-heng, et al.N-Trinitroethylamino functionalization of nitromidazoles:a new strategy for high performance energetic materials[J].JournalofMaterialsChemistry, 2013, 1(25), 7500-7510.
[7] Margarita A E, Igor V O, Alexander S K, et al. Henry and mannich reactions of polynitroalkes in ionic liquids [J].MendeleevCommun, 2011, 21(1): 21-23.
[8] ZHANG Qing-hua, ZHANG Jia-heng, Damon A P, et al. EnergeticN-Trinitrmethyl-substituted mono-, di-, and triaminotetrazoles[J].ChemistryEuropeanJournal, 2013, 19(33): 11000-11006.
[9] Michael G, Thomas M K. Development and testing of energetic materials: the concept of high densities based on the trinitroethyl functionality[J].AdvancedFunctionalMaterials, 2009,19(3): 347-365.
[10] Srarchenkov I B, Andrianov V G, Mishnev A F. The chemistry of
furazano[3,4-b]pyrazine: properties of 5,6-diamino-and 5,6-dihydrazinofurazinofurazano[3,4-b]pyrazine[J].ChemistryofHeterocyclicCompounds,1999,35(4): 499-508.
[11] WU Qiong, ZHU Wei-hua, XIAO He-ming. Molecular design of tetrazole-and tetrazine-based high-density energy compounds with oxygen balance equal to zero[J].JournalofChemical&EngineeringDate, 2013, 58(10): 2748-2762.
[12] Aleksei B S, Nataly S A, Nadezhda V P, et al. Ionic liquids as unique solvents in one-pot synthesis of 4-(N, 2,2,2-Tetranitroethylamino)-3-R-Furazans[J].ChemistryEuropeanJournal, 2013,19(37): 12446-12457.
[13] Avdonin V V, Volkov G A, Galkin P V, et al. Preparation and properties ofN-fluoro-andN-nitrobis(2,2,2-trinitroethyl)ureas[J].IzvestiyaAkademiiNaukSeriyaKhimicheskaya, 1992, 8: 1857-1863.
[14] Ovchinnikov I V, Kulikov A S, Epishina M A, et al. Synthesis ofN-trinitroethyl derivatives of linear and heterocyclic nitrogen-containing compound[J].RussianChemicalBulletin, 2005,54(5): 1346-1349.
[15] Jaidann M, Roy S. A DFT theoretical study of heats of formation and detonation properties of nitrogen-rich explosives[J].JournalHazardMaterials, 2010,176: 165-173.
[16] PAN Yong, LI Jin-shan, CHENG Biao, et al. Computational studies on the heats of formation, energetic properties, and thermal stability of energetic nitrogen-rich furazano[3,4-b]pyrazine-based derivatives[J].ComputationalandTheoreticalChemistry, 2012, 992: 110-119.
[17] ZHANG Xiao-wen, ZHU Wei-hua, XIAO He-ming. Comparative theoretical studies of energetic substituted carbon- and nitrogen-bridged difurazans[J].TheJournalofPhysicalChemistryA, 2010, 114(1): 603-612.
[18] Caflisch R E. Monto carto and quasi-monto carto methods[J].ActaNumerica, 1998, 7: 1-49.
[19] Kamlet M J, Jacobs S J. Chemistry of detonationⅠ: a simple method for calculating detonation properties of C H N O explosives[J].JournalofChemistryPhysics, 1968, 48(1): 23-25.
[20] Talawar M B, Sivabalan R, Mukundan T, et al. Environmentally compatible next generation green energetic materials[J].JournalHazardMaterial, 2009,161:589-607.