土壤水分对沙棘光合日变化的影响
2015-05-11夏宣宣吴芹张光灿邢伟
夏宣宣,吴芹,张光灿*,邢伟
(1.山东农业大学林学院,山东泰安271018;2.山东省土壤侵蚀与生态修复重点实验室,山东泰安271018;3.山东农业大学生态学博士后流动站,山东泰安271018)
土壤水分对沙棘光合日变化的影响
夏宣宣1,2,吴芹3,张光灿1,2*,邢伟1,2
(1.山东农业大学林学院,山东泰安271018;2.山东省土壤侵蚀与生态修复重点实验室,山东泰安271018;3.山东农业大学生态学博士后流动站,山东泰安271018)
探索土壤水分对沙棘光合日变化的影响对于深入了解黄土高原地区沙棘的光合生理和水分生态特性具有重要意义。文章应用CIRAS-2型光合作用系统,测定了3年生沙棘叶片光合作用气体交换参数在不同(8个)土壤水分含量下的日变化过程,研究了土壤水分变化对沙棘光合作用效能的影响。结果表明:土壤含水量明显影响沙棘光合日变化过程,当土壤相对含水量(RWC)在50.4%~62.4%时,沙棘的净光合速率(Pn)全天处于较高水平,且无“午休”现象;RWC超出此范围时,全天的Pn均下降,并伴随光合“午休”现象;沙棘光合“午休”的主要原因与土壤含水量有关,当RWC减少至36.3%时,沙棘光合“午休”现象加重且其导致光合“午休”主要原因由气孔限制转变为非气孔限制。
土壤水分;气孔;沙棘;光合“午休”
0 引言
水分是植物进行光合作用的重要环境因子和原料,土壤水分不足或过多都会影响植物的光合作用[1-2]。在黄土高原地区,干旱胁迫是经常发生的制约植物生长发育的逆境问题[3-4]。水分亏缺时,植物叶片的气孔特性会发生不同程度的变化,进而通过气孔因素或非气孔因素的途径对光合作用产生影响。过去的研究结果表明,植物生理过程(如光合作用过程)对土壤水分有一定的适应性和抵抗性,即植物光合生理活动并非在土壤水分充足时最活跃[5],而是在适度的水分亏缺范围内。研究植物光合作用的日变化过程可为分析植物生长和产量限制因素提供重要依据[6]。光合作用的“午休”现象是植物对干旱、炎热等逆境的一种有益的生态适应和自我调节机制的表现。光合作用日变化有单峰、双峰、三峰等几个种类,这与植物种类以及植物所处的环境条件有关系[7]。引发植物光合“午休”的主要逆境因子可通过气孔因素或非气孔因素限制叶片的光合作用。气孔因素的限制原因主要包括在逆境下由气孔导度下降引起的C O2供应受阻,而非气孔因素限制的原因则包括逆境下光合作用发生光抑制[8]、光合酶活性降低、光合产物累积、光呼吸升高等[9]。植物光合作用日变化过程的测试分析,是研究环境因素影响植物生长和代谢的重要手段[10]。因此,研究植物光合日变化过程与土壤水分的关系,对深入认识植物的抗旱生理生态特性及指导旱区植物的栽培管理具有重要意义。
沙棘(Hippophaer hamnoidesL.)是黄土高原地区常见的具有重要生态和经济价值的物种[11]。迄今为止,有关沙棘光合生理生态方面的研究内容十分广泛,有研究报道了水分胁迫对沙棘光合作用光响应[1]、日变化[12]过程的影响,也有关于沙棘在不同坡位[9]、水分[13]等生境下光合作用的日变化特征的研究报道。但具体到沙棘光合作用日变化过程与土壤水分关系的研究还不多见,目前还不十分清楚。本试验观测了沙棘在多级土壤水分梯度(8个水分含量)下光合作用的日变化过程,其目的主要探索土壤水分对沙棘光合作用水平、日变化过程及其“午休”原因的影响,以期为深入了解黄土高原地区沙棘的光合生理和水分生态特性提供参考。
植物的光合作用生理过程,还与生物节律、生长季节和环境因子的变化有关。本研究的结果与结论,还局限于在特定时期(即7月份)对沙棘光合生理特征的测试与分析,因而具有一定的时效性。关于沙棘在其他季节或月份等不同时期光合日变化与土壤水分的关系,还需要进一步的研究。
1 材料与方法
1.1 试验区概况
试验区位于山西省方山县峪口镇土桥沟流域(N 37°36'58″,E 110°02'55″),位于吕梁山西麓,属黄河中游黄土丘陵沟壑区。流域内平均海拔约为1200 m,最高海拔为1446m左右。试验区土壤为中壤质黄绵土,质地均匀,p H值为8.0~8.4[14]。该区属暖温带亚干旱区大陆性季风气候,多年平均降水量为416 m m,且一年中降雨量分配不均,其中6~9月份的降水量占全年降水量的70%以上,多年平均蒸发量约为1857.7 m m[15],霜冻期为九月下旬至次年五月上旬,无霜期为140 d[16]。
1.2 试验材料与水分处理
采用3年生沙棘苗木为试验材料。3月中旬进行盆栽培育,共培育6株(每盆1株)。栽植盆(长期埋于土壤中以保证盆内土壤与田间土壤同温)的规格为内径为38 c m,深为45 c m,其土壤容重为1.20 g/c m3,田间持水量为23.4%。培育期间只浇水不施肥,保持盆栽土壤的自然肥力。7月上旬,从培育的6株(6盆)盆栽植株中,选取生长健壮的3株(3盆)作为试验观测植株,在光合作用观测的前2天,给各供试植株浇充足的水,使盆内土壤饱和,之后不再给各供试植株浇水,使其自然耗水,每2天(即每隔1天)获取一个土壤含水量并观测该土壤水分条件下光合作用的气体交换参数。整个实验过程中共获得8个土壤水分梯度以及相应水分条件下的气体交换参数数值。8个土壤水分梯度的质量含水量GWC(%,采用烘干法测定)依次为21.7%、19.0%、14.6%、11.8%、10.0%、8.5%、6.2%和4.5%,相对含水量(RWC,%,GWC与田间持水量的比值)依次为92.7%、81.2%、62.4%、50.4%、42.7%、36.3%、26.5%和19.2%。试验期间搭建简易遮雨棚,以防止降水对实验过程中土壤水分的处理造成影响。
1.3 气体交换参数测定
从供试植株的中部分别选取5片无病虫害、生长健壮的成熟叶片并做标记,应用英国PPS公司生产的CIRAS-2型光合作用测定系统,测定各土壤水分下沙棘叶片光合作用参数的日变化过程。测定时间为7∶00~17∶00,每2 h测定1次,每次测定15个叶片(每个叶片重复3次计数)。光合测定系统自动记录叶片的净光合速率(Pn)、相对湿度(R H)、胞间C O2浓度(Ci)、大气C O2浓度(Ca)、光合有效辐射(PAR)、蒸腾速率(Tr)、空气温度(Tc)、气孔导度(Gs)等参数。气孔限制值(Ls)由式(1)计算为[17]

1.4 数据处理
将不同处理、不同观测时间点测定的数据集中处理,采用Excel 2003计算相关数据并完成作图,利用SPSS 19.0软件采用最小显著差异法(LSD)以及单因素方差分析(one-way ANOVA),在5%水平上进行显著性检验。
2 结果与分析
2.1 沙棘叶片净光合速率日变化分析
不同土壤水分下沙棘净光合速率日变化图如图1所示。沙棘叶片净光合速率(Pn)对土壤相对含水量(RWC)的变化有明显的阈值响应。当RWC为50.4%~62.4%时,全天各时间点的Pn处于较高水平,没有出现光合“午休”现象(单峰型),最大值为11∶00;超出此水分范围时,各时间点的Pn水平降低,且出现光合“午休”现象(双峰型)。当RWC<42.7%时,第一峰值出现在9∶00,第二峰值出现在15∶00,且随RWC的降低,全天各点的Pn水平明显下降,光合“午休”程度加重且持续时间较长(发生在9∶00~13∶00);当RWC在81.2%~92.7%范围时,第一峰值出现在9∶00,第二峰值出现在13∶00,光合“午休”程度相对较轻且时间持续较短(主要在9∶00~11∶00)。即沙棘进行光合作用比较适宜的RWC范围为50.4%~62.4%,土壤水分过高或过低,均会导致沙棘光合速率的降低和“午休”现象的发生。
2.2 沙棘胞间C O2浓度和气孔限制值日变化分析
不同土壤水分下沙棘胞间C O2浓度与气孔限制值得的日变化情况如图2和3所示。当土壤水分在RWC>81.2%或在36.3%~50.4%范围时,在沙棘光合“午休”时段(9∶00~13∶00),随着叶片净光合速率(Pn)下降,细胞间隙C O2浓度(Ci)降低和叶片气孔限制值(Ls)升高,根据Farquhar[17]等人的气孔限制理论判断,此时沙棘光合“午休”的主要原因为气孔因素对Pn的限制,即由于气孔开度降低引起的C O2供应受阻。当土壤水分在RWC≤36.3%时,随光合“午休”期间(9∶00~13∶00)Pn下降,Ci明显升高和Ls下降,因此参考光合作用气孔限制理论,此时沙棘光合“午休”的主要原因转变为非气孔因素对Pn限制,即沙棘的光合机构受到损伤,叶肉细胞光合能力受到了严重影响。
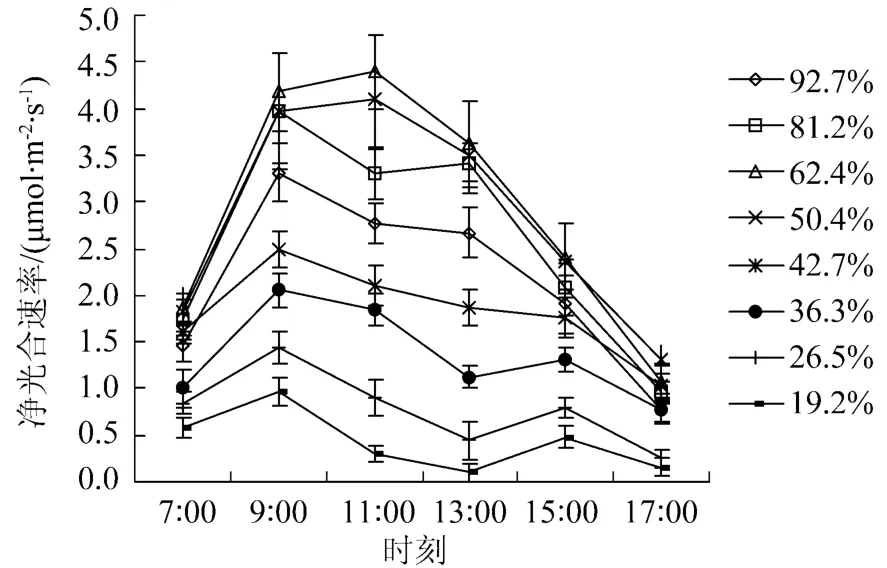
图1 不同土壤水分下沙棘净光合速率日变化图
图2和3表明,沙棘光合“午休”的主要原因也与土壤含水量有关。具体表现在当土壤处于严重水分胁迫(RWC<36.3%)时,沙棘光合“午休”的主要原因为非气孔因素;否则为气孔因素。即RWC为36.3%是限制光合作用的主要原因由气孔因素过渡为非气孔因素的转折点,同时也是黄土丘陵区沙棘生长所允许的最低土壤含水量。

图2 不同土壤水分下沙棘胞间C O2浓度日变化图

图3 不同土壤水分下沙棘气孔限制值的日变化图
3 结论
通过上述研究可知:
(1)在适合的土壤水分条件下,沙棘叶片净光合速率日变化曲线呈单峰型(RWC约为54.9%~62.2%);否则,光合日变化曲线呈双峰型,且出现“午休”的时间及“午休”程度不同。
(2)土壤含水分的变化会明显影响沙棘的光合日变化过程以及光合“午休”的主要原因。随土壤水分含量的降低,光合“午休”程度加重,“午休”时间变长。当土壤水分含量降低至RWC≤36.3%时,沙棘光合“午休”的程度较大、“午休”时间较长。
(3)RWC约为36.3%时,沙棘叶片的光合“午休”现象由气孔因素限制转变为非气孔因素限制,此水分也是半干旱黄土丘陵区沙棘生长所允许的土壤水分下限。
[1] 裴斌,张光灿,张淑勇,等.土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响[J].生态学报,2013,33(5):1386-1396.
[2] Xia J.B.,Zhang G.C.,Zhang S.Y.,et al..Photosynthetic and water use characteristics in three natural secondary shrubs on Shell Islands,Shandong,China[J].Plant Biosystems,2014,148:109-117.
[3] 孟鹏,李玉灵,尤国春,等.彰武松、樟子松光合生产与蒸腾耗水特性[J].生态学报,2012,32(10):3050-3060.
[4] Hu J.C,Cao W.X.,Zhang J.B.,et al..Quantifying responses of winter wheat physiological processes to soil water stress for use in growth simulation modeling[J].Pedosphere,2004,14(4):509-518.
[5] Montanaro G.,Dichio B.,Xiloyannis C..Shade mitigates photoinhibition and enhances water use efficiency in kiwifruit under drought[J].Photosynthetica,2009,47(3):363-371.
[6] Xia J.B.,Zhang S.Y.,Guo J.,et al..Critical effects of gas exchange parameters in Tamarix chinensis Lour on soil water and its relevant environmental factors on a shell ridge island in China's Yellow River Delta[J].Ecological Engineering,2015,76:36-46.
[7] 梁开明,曹洪麟,徐志防,等.台湾青枣及野生种的光合作用日变化及光响应特征[J].园艺学报,2008,35(6):793-798.
[8] 吴彦琼,胡玉佳.外来植物南美蟛蜞菊、裂叶牵牛和五爪金龙的光合特性[J].生态学报,2004,24(10):2334-2339.
[9] 靳甜甜,傅伯杰,刘国华,等.不同坡位沙棘光合日变化及其主要环境因子[J].生态学报,2011,31(7):1783-1793.
[10]Robinson J.C.,Bower J.P..Transpiration from banana leaves in the subtropics in response to diurnal and seasonal factors and high evaporative demand[J].Scientia Horticulturae,1988,37(1/2):129-143.
[11]Guo W.H.,Li B.,Huang Y.M.,et al..Effects of different water stresses on eco-physiological characteristics of Hippophae rhamnoides seedlings[J].Acta Botanica Sinica,2003,45(10):1238-1244.
[12]蔡海霞,吴福忠,杨万勤.干旱胁迫对高山柳和沙棘幼苗光合生理特征的影响[J].生态学报,2011,31(9):2430-2436.
[13]高丽,杨劼,刘瑞香.不同土壤水分条件下中国沙棘雌雄株光合作用、蒸腾作用及水分利用效率特征[J].生态学报,2009,29(11):6025-6034.
[14]张征坤,张光灿,刘顺生,等.土壤水分对山杏光合作用日变化过程的影响[J].中国水土保持科学,2012,10(3):99-104.
[15]Lang Y.,Wang M.,Zhang G.C.,et al..Experimental and simulated light responses of photosynthesis in leaves of three tree species under different soilwater conditions[J].Photosynthetica,2013,51(3):370-378.
[16]吴芹,张光灿,裴斌,等.不同土壤水分下山杏光合作用CO2响应过程及其模拟[J].应用生态学报,2013,24(6):1517-1524.
[17]Farquhar G.D.,Sharkey T.D..Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology,1982,33:317-345.
(学科责编:吴芹)
Effects of soilmoisture on diurnal variation of photosynthesis in Hippophae rhamnoides L.
Xia Xuanxuan1,2,Wu Qin3,Zhang Guangcan1,2*,et al.
(1.School of Forestry,Shandong Agricultural University,Tai'an 271018,China;2.Shandong Provincial Key Laboratory of Soil Erosion and Ecological Restoration,Tai'an 271018,China;3.Ecology Post-doctoral Mobile Station,Shandong Agricultural Vniversity,Tai'an 271018,China)
In the study,photosynthetic parameters in leaves of three-year-old Hippophae rhamnoides L.grown in potswere tested under8 soilwater contents to investigate daily variation course of drought stress on photosynthesis and the relationship between photosynthesis and soil water content by using CIRAS-2 portable photosynthesis system in the semiarid loess hilly region.The results show that:Changes in soilmoisture content significantly affect the diurnal variation of photosynthesis in leaves of Hippophae rhamnoides L..When relative soilwater content(RWC)iswithin the scope of 50.4%~62.4%,the net photosynthetic rate(Pn)keeps at high levels throughout the day and midday depression of photosynthesis does not occur;while RWC is outside this range(increasing or decreasing),the day level of Pn decreases and midday depression occurs,low ebbs appeares at 11:00~13:00.Themain reason formidday depression in Hippophae rhamnoides L.is related to the variation of RWC.When RWC reduced to 36.3%,midday depression of photosynthesis aggravated and themain reason formidday depression changed from stomatal limitation to non-stomatal limitation.
soilmoisture;stomata;Hippophae rhamnoides L.;midday depression of photosynthesis
Q945.79
A
2015-08-30
国家重点基础研究发展计划(973)项目(2012CB416904);国家林业公益性行业科研专项项目(201104002)
夏宣宣(1989-),女,在读硕士,主要从事植物生理生态等方面的研究.E-mail:xiaxx2012@126.com
*:张光灿(1963-)男,教授,博士,主要从事林业生态工程、植物生理生态等方面的研究.E-mail:zhgc@sdau.edu.cn
1673-7644(2015)05-0441-04
