紫外辐射对菹草(Potamogetoncrispus)成株快速光响应曲线的影响*
2015-05-10王锦旗宋玉芝
王锦旗,宋玉芝,薛 艳
(1:南京信息工程大学应用气象学院,南京210044)
(2:江苏省环境演变与生态建设重点实验室,南京210023)
(3:江苏省大气环境监测与污染控制高技术重点实验室,南京210044)
紫外辐射对菹草(Potamogetoncrispus)成株快速光响应曲线的影响*
王锦旗1,2,3,宋玉芝1,3,薛 艳1,3
(1:南京信息工程大学应用气象学院,南京210044)
(2:江苏省环境演变与生态建设重点实验室,南京210023)
(3:江苏省大气环境监测与污染控制高技术重点实验室,南京210044)
将菹草(Potamogetoncrispus)成株置于50、100、150、200μW/cm2剂量的UV-B辐射下,利用调制叶绿素荧光仪测定紫外辐射对菹草成株PSⅡ系统的损伤程度.结果表明:急性辐射初期叶片最大光合速率、耐强光能力、叶片捕光能力均随辐射剂量增大而减少;16 d后,UV-B辐射剂量小于100μW/cm2的实验组,辐射促进其叶片光能利用效率、最大光合速率、耐强光能力,而高于100μW/cm2的实验组,随辐射时间延长,其抑制作用持续,最终高于100μW/cm2剂量组植株均死亡,而低于100μW/cm2剂量组差异不大.结果表明辐射剂量小于100μW/cm2时,UV-B辐射对叶片最大光合速率、耐强光能力、叶片捕光能力的影响较小,而高于100μW/cm2时,UV-B辐射对植株叶片PSⅡ系统构成的损伤,降低了植株叶片的光合作用能力.春末夏初陆上紫外辐射逐渐增加,对菹草伤害程度加剧,因此,紫外辐射可能是促进菹草春末夏初大批衰亡的重要原因.
菹草;快速光响应曲线;电子传递速率;光能利用效率;耐强光能力
菹草(Potamogetoncrispus)是眼子菜科多年生沉水草本植物,世界广布[1],是一种典型的秋季萌发、越冬生长的沉水植物,主要分布在淡水湖泊、池塘、稻田、河流等水域[2].菹草作为冬、春季沉水植物的优势种,对水体中的氮、磷等营养盐有吸收作用,在净化水质、改善水环境质量、提高水体透明度、抑制藻类生长等方面均有显著作用[3],对维持水生生态系统的平衡与健康有重要意义[4].野外菹草生长特性主要表现为春季生长迅速、夏初死亡,其衰亡的原因一直是很多学者研究的重点.研究认为强光照是造成菹草夏季大量衰亡的主要原因,在生长早期,光照一般不会对水下菹草的生长产生抑制;而到后期,强日照天数增多,菹草经春季快速生长已到达水表,水表强烈的光照条件将对菹草生长、生存产生剧烈抑制作用,进而促进菹草衰亡[5].那么强光照中到底是哪个波段真正起作用的呢?在江苏省水环境中试平台温室内的观测发现,温室内菹草可四季持续生长,而野外春末夏初则大批衰亡,对比温室内外光照发现,温室内外光照强度差异不大,但紫外辐射明显减弱,尤其以UV-B减少明显.UV-B辐射不仅能抑制陆生植物的生长,而且对水生生物有较大的危害,研究发现,对生物有危害的UV-B辐射在一些海域可深入水下几米,甚至几十米[6-7].长江中下游湖泊中对生物有害的紫外辐射基本上能到达湖底[8-9].我国总体紫外辐射从1-7月逐渐增大,其中5-8月紫外辐射均为全年较强月份[10].太湖地区的研究发现,5-6月陆上紫外辐射强度逐渐增强,其中5-9月紫外辐射总量均超过0.9MJ/(m2·d),远高于1-3月[11].南京市春、夏两季紫外辐射较强,极大值出现在5月,5-8月为全年紫外辐射强度较强月份[12].大量野外观测发现,我国大部分地区野外菹草于5-6月进入繁殖衰老期[13].对武昌自然水体进行观察发现,5月上、中旬石芽逐渐成熟,植株开始衰败[14];南京玄武湖野外菹草在5月以后开始逐渐衰亡[15];武汉东湖也于5月下旬衰败,6月倒伏死亡[16].根据上述分析,菹草开始衰亡的时间与陆上紫外辐射开始增强的时期正好吻合,野外太阳辐射增强与菹草大量衰亡是否存在一定的关联性,其中的原因值得研究.
光合曲线不仅能评估植物实际光合能力,而且能评估一定光强下植物潜在光合能力,这种测量手段被称为光合作用曲线(P-E曲线,以前称为P-I曲线)[17].利用水下叶绿素荧光仪(DIVING-PAM)可原位、无损伤地测定沉水植物的光合作用能力,其测定的快速光响应曲线(RLC)能体现植物光合作用活性及电子传递速率的特点,同时反映光合器官对瞬时及长期生活光照的响应,例如光适应、光抑制及光保护等生理现象[18],因此广泛用于植物生理生态调查和研究[19],使得RLC成为研究植物对逆境响应的重要手段[20].因此,利用RLC曲线研究UV-B对菹草光合生理的影响,研究春末夏初菹草衰亡的原因,探索菹草衰亡机制,对丰富水生植物生态学理论和富营养化湖泊生态修复具有一定的理论和现实意义.
1 材料与方法
1.1 实验地点选择
实验地点选择在江苏省环境工程重点实验室水环境生态修复中试平台(32.11°N, 118.91°E)温室内.光合有效辐射(PAR)为室外的80%~85%,温室内UV-B透过率仅为2%~5%,UV-A透过率为60%~70%.
1.2 实验设计
将采集的菹草成株种植于上口直径18cm、下口直径12.5cm、高15cm的花盆中,每个花盆种植约15~20株(分枝).为减少底泥带来的营养盐差异,在花盆底部预先铺设少量泥土加碎石细沙以固着菹草植株根部.将上述种植好的花盆置于上口直径64cm、下底直径52cm、高72cm的白色塑料桶中,桶容量为200 L.
将培育好的菹草植株种植于水桶中,每组设3个平行对照,桶上方用120cm不锈钢支架悬挂UV-B日光灯管.UV-B灯管采用南京华强特种光源厂生产的纯UV-B灯管(40 W,主峰313nm).
实验用菹草成株取自野外自然河道中,取生长状况基本一致的植株进行实验,植株初始株高为55~65cm,节间距为2.2~3.3cm,叶长为3.2~4.0cm,叶宽为4.5~5.5mm,在玻璃温室内培育待生长稳定后用于实验.分别于实验第0、9、16、23、31 d测定RLC曲线,其生育期与野外菹草繁殖及衰亡期基本一致.
1.3 UV-B剂量设定
以南京信息工程大学农业气象站2005年4月(118.9μW/cm2)和2008年8月(239.8μW/cm2)实际测量的全天UV-B剂量的平均值为参照(采用监测的仪器及传感器与本实验一致),通过SpectroSense 2 (英国SKYE公司)连接SKU 430UV-B传感器(280~315nm)测定UV-B剂量,结合南京市2005-2010年总紫外辐射年变化趋势[12],设定4个UV-B剂量梯度,最低剂量低于4月野外UV-B剂量日均值,最高剂量远低于5月UV-B剂量日均值.对照组为0μW/cm2,其余4个组剂量分别为50、100、150、200μW/cm2,分别记作R0、R50、R100、R150、R200.对照组水桶上方用125μm聚酯薄膜以过滤温室中少量UV-B辐射,通过调节灯管粗细、高度以及滤膜的角度使各处理组接受可见光基本一致.对照组水桶仅接受UV-A和PAR,其余组接受PAR、UV-A及UV-B.为防止各水桶间UV-B辐射相互干扰,用125μm聚酯薄膜相互隔离,并在水桶四周用遮光布遮挡侧向光源,并防止UV-B对周围实验产生不利影响.
为防止UV-B对植株造成急性伤害,分别从低剂量短期辐射缓慢递增,最终调整到设定剂量,每日UV-B灯管照射时间为6 h(9:00-15:00).
1.4 指标测定
(1) 株高:每个水桶中选3~5株植株,从根部至植株顶部测量其长度,取3个平行对照组的平均值.
(2) 鲜重:自植株根部截断,在每个水桶取2~3株植株用吸水纸吸干表面水分后测定其鲜重,取3个平行样的平均值.
(3) 快速光响应曲线测定:使用Diving-PAM水下调制叶绿素荧光仪(德国WALZ公司)测定RLC曲线,由饱和脉冲光(4000μmol/(m2·s),0.8 s)测得Fm后,逐渐开启光强度分别为17、49、104、176、248、342、506和684μmol/(m2·s)的光化光,每个强度的光化光照射10 s后,经检测光和饱和脉冲光测得Ft、Fm′,计算得到8个电子传递速率(ETR)值,绘出ETR平均值的快速光响应曲线.选择最接近水面的植株进行测量,每组测定的叶片选择植株顶端向下完全伸展的叶片,每组每个水桶随机测定3~4株,取3个平行样的平均值.
1.5 快速光响应曲线参数计算
RLC为电子传递速率随光强的变化曲线,测定快速光响应曲线可以确定菹草叶片的实际光化学效率.为定量研究RLC,需要确定RLC的几个重要参数,如:α、半饱和光强(Ek)及rETRmax[18,21].
rETR=rETRmax(1-e-α·PAR/rETRmax)e-β·PAR/rETRmax
(1)
Ek=rETRmax/α
(2)
式中,rETRmax代表无光抑制时的最大潜在相对电子传递速率;α是RLC曲线的初始斜率,反映了光能利用的效率.叶片捕光能力的高低与叶片的吸光系数和PSⅡ对光能的利用能力有关.rETRmax和Ek反映了植物最大光合速率以及所耐受强光的能力,β是光抑制参数[18].
快速光响应曲线每隔7~10 d监测1次,快速光曲线参数由MATLAB软件通过拟合曲线按Platt等的公式计算,曲线拟合采用最小二乘法[18].
1.6 数据分析
实验数据用Excel软件进行统计分析及图表制作,RLC参数用MATLAB软件分析计算获得.
2 结果与分析
2.1 植株生长状况
从第7 d开始,R100、R150和R200组触及水体表面及接近水面部分植株叶片出现不同程度漂白死亡现象,而水下部分生长良好,各组随辐射剂量增加伤害程度增加;而第16 d,R150、R200组部分植株腐烂,植株根部与根系仍连接在一起,尚未断裂;第22 d,R0、R50、R100组植株出现衰亡特征,菹草断枝增多,均于根部断裂漂浮于水面上,与野外菹草衰亡特征一致,但仍有少量植株未出现断根现象;第23 d,3个平行对照组中,R0组仅余6株直立生长,R50组仅存2株,其余为断枝,R100存7株;第31 d,R150、R200组根部腐烂植株全部死亡腐烂,而R0、R50、R100组仍余部分植株能直立生长.
由图1a可知,第16 d,R0、R50组株高略有增加,分别较开始增加2.1%、0.9%,R100、R150、R200组株高基本一致,且较开始时出现降低趋势,但差异不显著(P>0.5),分别较开始降低1.6%、8.3%、2.0%,R50、R100、R150、R200组高度分别较R0组降低2.2%、8.1%、8.3%、8.3%;第24 d,R0组植株仍持续增高,各组较开始差异显著(P<0.05),R50、R100、R150、R200组随辐射剂量增加降低显著,R50、R100、R150、R200组分别较R0组降低21.4%、22.9%、28.2%、34.1%;第31 d,R150、R200组植株死亡,R0、R50、R100组植株仍持续生长,但均较开始有所降低,较第24 d降低显著(P<0.05).
各组单株重量从第16 d至第31 d均呈下降趋势(图1b).第16 d,R50、R100、R150、R200组随剂量增加,较R0组降低率依次增加,分别为18.9%、22.7%、30.9%、30.9%.第24 d,R0、R50、R100、R150、R200组分别较第16 d降低15.5%、23.3%、38.4%、35.0%、43.6%,但差异不显著(P>0.05),R50、R100、R150、R200组较R0组降低率增大,分别较R0组降低26.4%、43.6%、46.9%、53.9%.第31 d,R0、R50、R100组分别较第16 d降低42.0%、44.0%、39.3%(P>0.05),R50、R100组分别较R0组降低21.8%、19.2%.

图1 UV-B对菹草成株株高(a)和单株重量(b)的影响Fig.1 Plant height (a) and weight per plant (b) of Potamogeton crispus by UV-B radiation
2.2 各处理组在不同辐射日后快速光响应曲线
由图2、图3可见,实验开始,各组RLC变化趋势一致,各组间rETRmax差异不显著(P>0.05),α值均较低,R50、R100组略高,R200组最低,Ek值却自R0、R100、R150、R200组依次升高.第9 d,rETRmax随辐射剂量增加而逐渐递减,其中R0组最高,R50组其次,R200组最低,各组间未达到显著性差异(P>0.05),α值较开始均有增加,自R50、R100、R150、R200组依次降低,R50、R100组略高于R0组,而Ek值R0组高于其余4组,4个辐射组大小顺序为R150、R50、R200、R100组.第16 d,rETRmax分布自R0、R50、R100组逐渐升高,R100、R150、R200组依次降低,α值R50、R100组均高于R0组,其中R50、R100、R150、R200组依次降低,而Ek值则自R0至R150组依次升高,R200组略低于R150组.第23 d,rETRmax值R0组显著高于其他处理组,总体自R0、R50、R150、R200组逐渐降低,α值R50、R100、R150、R200组依次降低,而R50组略高于R0组,Ek值R0组高于其余组,且R50、R100、R150、R200组依次升高.第31 d由于对照组植株也进入衰亡阶段,故剩余3组RLC曲线基本重合,其中rETRmax也相差较小,R0组略高于R50、R100组,α值也为R0组高于R50、R100组,Ek值则R100、R50组高于R0组.
2.3 各处理组随辐射时间变化快速光响应曲线
由图3、4可见,对照组自实验开始至第16 drETRmax呈逐渐上升趋势,第16 d达最高,自16 d后,呈下降趋势,但第31 d仍高于实验开始时,其中第16 dETR值与实验开始时达显著性差异(P<0.05),α值从开始至第31 d呈逐渐升高的趋势,第31 d较第0 d高61.4%,Ek值从第0 d至第16 d呈逐渐升高趋势,从第16 d至第31 d呈逐渐降低趋势,第31 d达最低,第16 d较第31 d高31.1%.
R50组经辐射处理,呈现周期性升降趋势,第9 d与实验开始时rETRmax大致相当,第16 d升至最高,第23 d下降,第31 d又略有升高.其中第16 dETR值与第23 d呈极显著差异,与其他监测日均呈显著性差异(P<0.05);α值从第0 d至第23 d呈逐渐升高的趋势,第23 d达最高,第31 d迅速降低;Ek值从第0 d至第16 d呈逐渐升高趋势,第16 d达最高,第23 d迅速降低,达实验期间最低,较第16 d降低59.4%,第31 d有所升高,与实验开始基本相当.
R100组呈现有规律周期性升降趋势,辐射第9 d,rETRmax较实验开始有所下降,第16 d恢复较多,并达所有监测日中最高,第23 d降至最低,第31 d略有升高.第16 dETR值与第23 d呈极显著差异(P<0.01),与实验开始及第9 d呈显著差异(P<0.05),α值及Ek值自第0 d至第31 d呈交替升降,α值第23 d达最高,第31 d降至最低,Ek值第16 d升至最高,第23 d降至最低,最高值较最低值高60.5%.
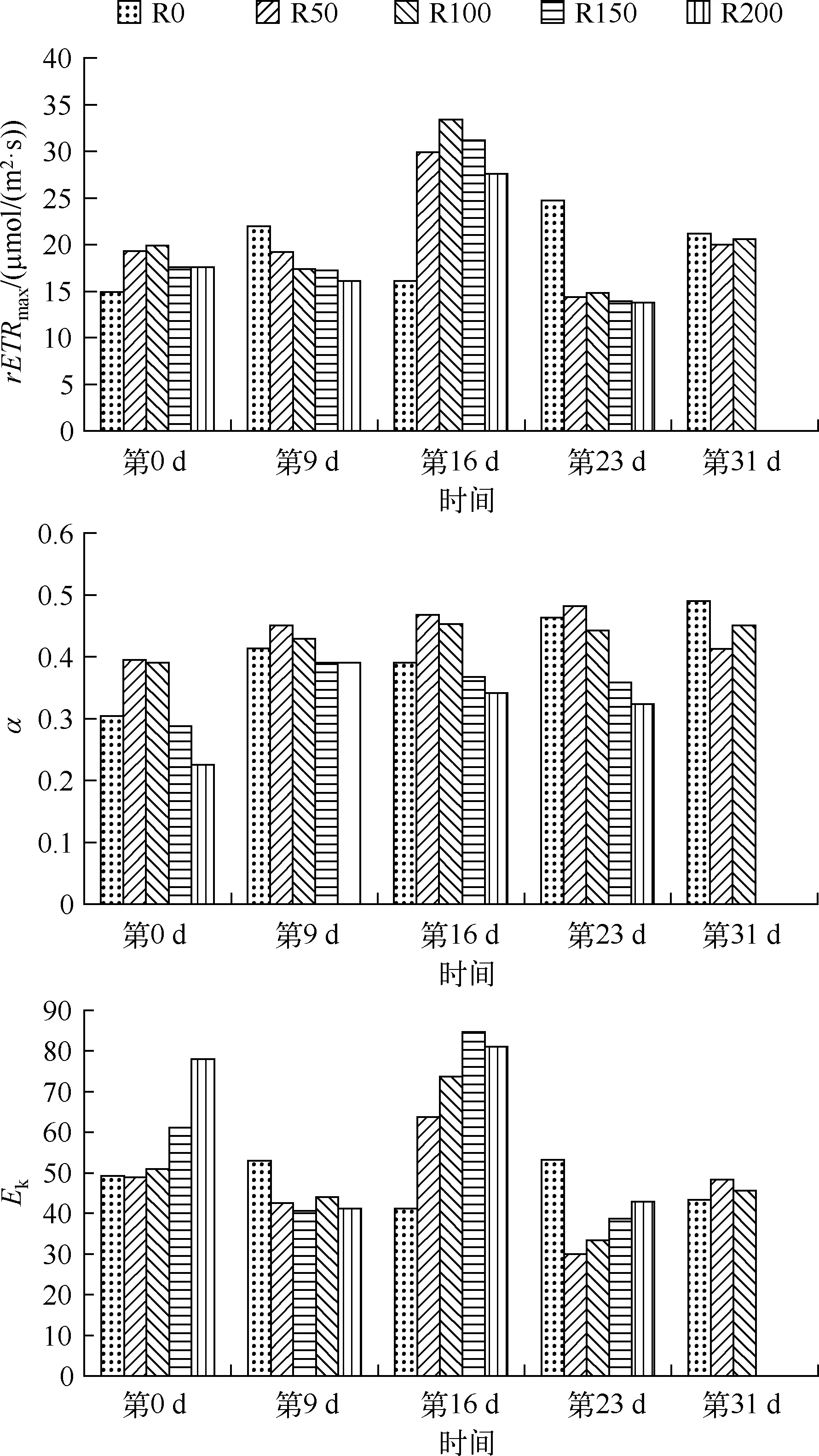
图3 UV-B对菹草成株快速光响应曲线参数的影响Fig.3 Rapid light curve parameters of Potamogeton crispus by UV-B radiation
R150组辐射第9 drETRmax与实验开始时大致相当,但不同的是随光强增加光响应能力显著降低,第16 d恢复较多,并达所有监测日中最高,第23 d迅速下降并降至最低,第31 d植株死亡.其中第16 dETR与第23 d呈极显著差异(P<0.01),与第9 d呈显著差异(P<0.05),α值一直维持较低水平,第9 d达最高,第16 d及第23 d有所降低,Ek值呈交替升降趋势,第16 d达最高,第23 d降至最低,两者差异达52.2%.
R200组自实验开始至第9 drETRmax略有降低,第16 d升至最高,第23 d降至最低值,其中第16 dETR值与第9 d达显著差异(P<0.05),与第23 dETR值呈极显著差异(P<0.01),α值一直维持较低水平,第9 d 达最高,后持续降低,第23 d降至最低,Ek值也呈交替升降趋势,第16 d升至最高,第9 d最低.
3 讨论
实验开始时RLC曲线与UV-B辐射之间无明显关系,经9 d辐射后,其急性伤害特点表现明显,rETRmax随辐射剂量增加而逐渐递减,说明菹草植株叶片受UV-B剂量增大伤害加重,其最大光合速率、对强光的耐受能力也有所降低;其α值自R50、R100、R150、R200组依次降低,说明其叶片捕光能力也因辐射剂量增大而伤害加大,但因低剂量UV-B辐射使LHCII(捕光色素蛋白复合体Ⅱ)中色素分子对能量的吸收明显增强,传递到PSⅡ核心的能量也明显增多,即UV-B辐射作为一种弱胁迫,刺激了光合结构的功能发挥[22],所以R50、R100组在UV-B辐射辐射下α值较对照组升高;从叶片生长状况也能充分反映上述分析,而高剂量UV-B能对植株叶片色素细胞有强烈的漂白效应[23],从第7 d开始,R100、R150、R200组植株接近水面部分开始漂白死亡,故叶片光合作用功能势必受到抑制,其最大光合速率、对强光的耐受能力、叶片捕光能力也有所降低,而低于50μW/cm2,因伤害程度较低,且UV-B辐射刺激了光合结构的功能发挥,故植株生长状况良好;第16 d,rETRmax、α值及Ek值趋势说明≤100μW/cm2条件下,植株最大光合速率、叶片捕光能力及耐受强光的能力均有促进作用,也充分说明低剂量UV-B辐射短期内能促进光合结构功能的发挥,但剂量>100μW/cm2时伤害作用表现明显,故从植株生长状况也表现出R150和R200组部分植株开始腐烂,而R0、R50、R100组植株仍生长较为良好,另一重要原因可能是因为R0、R50、R100组顶端叶片衰亡后,中部叶片代替顶端叶片成为新顶端,离辐射源略远,故其伤害较小,而R150、R200组水下叶片无法持续生长代替衰亡顶端叶片,故持续衰亡;随辐射的继续,第23 d后辐射处理组的伤害作用逐渐呈现,最大光合速率、叶片捕光能力及耐受强光的能力均随剂量增加而下降,导致所有处理组植物均出现断根衰亡的迹象,植株生长状况也持续恶化,其对光能利用效率较其他组而言也降低,故导致植物迅速衰亡.第31 d,余下3组RLC曲线基本重合,其最大光合速率、叶片捕光能力及耐受强光的能力也趋于一致,故植株表象上也都表现出一致性,随植株根部断裂,但生长状况基本一致.由此说明,菹草植株持续暴露在UV-B辐射下,促进了植株衰亡的进程,因植株自实验开始已经进入繁殖期,故即使在低剂量的UV-B辐射下,随辐射时间延长,植株仍表现出一定的衰亡迹象.因此,从春末到夏初随着阳光中紫外辐射逐步增强,强烈的紫外辐射可能成为促进菹草衰亡的一个重要因素.而在太阳辐射中,强PAR、UV-A、UV-B同时作用,三者之间是否存在联合作用机制,还需要进一步探索.且强光照与气候变化、酸沉降、水体污染等与其他环境因素之间是否存在联合作用,也需要进一步研究.另外,在我国,由于很多浅水型湖泊深度较浅,且由于水体富营养化,泥沙淤积,湖床进一步变浅,很多沉水植物在生长后期均能触及水面,遭受UVR侵袭的机会也增多,因此,研究UVR对沉水植物生长及衰亡的影响将对研究水生生态系统演化、水体生态修复具有一定意义.

[1] Ali MB, Vajpayee P, Tripathi RDetal. Mercury bioaccumulation induces oxidative stress and toxicity to submerged macrophytePotamogetoncrispusL..BulletinofEnvironmentalContaminationandToxicology, 2000, 65(5):573-582.
[2] Aysel S, Emire E, Fatih Getal. Removal of Cadmium byMyriophyllumheterophyllumMichx. andPotamogetoncrispusL. and its effect on pigments and total phenolic compounds.ArchivesofEnvironmentContaminationandToxicology, 2008, 54(4): 612-618.
[3] Zhang M, Cao T, Ni Letal. Carbon, nitrogen and antioxidant enzyme responses ofPotamogetoncrispusto both low light and high nutrient stresses.EnvironmentalandExperimentalBotany, 2010, 68(1): 44-50.
[4] 金送笛, 李永函, 倪彩虹等. 菹草对水中氮,磷的吸收及若干影响因素. 生态学报, 1994, 14(2): 168-173.
[5] 苏胜齐, 沈盎绿, 唐洪玉等. 温度光照和pH对菹草光合作用的影响. 西南农业大学学报, 2001, 23(6):532-534.
[6] Ryan KG. UV radiation and photosynthetic production in antarctic sea ice microalgae.PhotochemistryandPhotobiology, 1993, 13(3/4): 235-240.
[7] Smith RC, Prezelin BB, Baker KSetal. Ozone depletion: ultraviolet radiation and phytoplankton biology in Antarctic water.Science, 1992, 225(5047): 952-959.
[8] 张运林, 秦伯强, 马荣华等. 太湖典型草、藻型湖区紫外辐射的衰减及影响因素分析. 生态学报, 2005, 25(9): 2254-2261.
[9] 张运林, 秦伯强, 陈伟民. 增强的UV-B对湖泊生态系统的影响研究. 地球科学进展, 2005, 20(1): 106-112.
[10] 祝青林, 于贵瑞, 蔡 福等. 中国紫外辐射的空间分布特征. 资源科学, 2005, 27(1): 108-113.
[11] 张运林, 秦伯强. 太湖地区太阳紫外辐射的初步研究. 气象科学, 2002, 22(1): 93-99.
[12] 毛宇清, 沈 澄, 姜爱军等. 南京市紫外线辐射强度的变化及影响因子. 气象科学, 2011, 31(5): 621-625.
[13] 沈 佳, 石福臣, 许 文. 菹草无性系季节生长速度和生物量分配特征. 水生生物学报, 2009, 33(2): 246-251.
[14] 汪 磊. 植物生长物质对菹草石芽形成与萌发的调节作用研究[学位论文]. 武汉: 华中农业大学, 2009.
[15] 曹 昀, 王国祥. 玄武湖菹草种群的发生与水环境变化. 环境监测管理与技术, 2006, 18(6): 25-27.
[16] 张金路, 段登选, 王志忠. 东平湖菹草大面积衰亡的危害及防治对策. 环境研究与监测, 2009, 22(2): 31-33.
[17] Falkowski PG, Raven JA. Aquatic photosynthesis. Oxford: Blackwell, 1997.
[18] Ralph PJ, Gademann R. Rapid light curves: A powerful tool to assess photosynthetic activity.AquaticBotany, 2005, 82(3):222-237.
[19] Durako MJ, Kunzelman JI. Photosynthetic characteristics ofThalassiatestudinummeasuredinsituby pulse-amplitude modulated (PAM) fluorometry: methodological and scale-based considerations.AquaticBotany, 2002, 73(2): 173-185.
[20] 叶子飘, 康华靖, 陶月良等. 不同模型对黄山栾树快速光曲线拟合效果的比较. 生态学杂志, 2011, 30(8): 1662-1667.
[21] 宋玉芝, 黄 瑾, 秦伯强. 附着生物对太湖常见的两种沉水植物快速光曲线的影响. 湖泊科学, 2010, 22(6): 935-940.
[22] 刘 晓, 贺俊芳, 岳 明. 荧光动力学方法研究光系统Ⅱ原初传能过程对低剂量UV-B辐射的响应. 生物物理学报, 2011, 27(10): 839-848.
[23] Wang GH, Hao ZJ, Anken RHetal. Effects of UV-B radiation on photosynthesis activity ofWolffiaarrhizaas probed by chlorophyll fluorescence transients.AdvancesinSpaceResearch, 2010, 45(7): 839-845.
Effects of ultraviolet radiation on rapid light-response curves ofPotamogetoncrispus
WANG Jinqi1,2,3, SONG Yuzhi1,3& XUE Yan1,3
(1:SchoolofAppliedMeteorology,NanjingUniversityofInformationScienceandTechnology,Nanjing210044,P.R.China)
(2:JiangsuKeyLaboratoryofEnvironmentalChangeandEcologicalConstruction,Nanjing210023,P.R.China)
(3:JiangsuKeyLaboratoryofAtmosphericEnvironmentMonitoringandPollutionControl,Nanjing210044,P.R.China)
The adult plants ofPotamogetoncripuswere exposed to UV-B radiation with different doses (50, 100, 150 and 200μW/cm2) in lab, which were checked for the degree of injury to photosystem Ⅱ in the plants by means of modulated chlorophyll fluorometer (DIVING-PAM). The results showed that the maximum leaf photosynthetic rate, light-resistant ability and light-harvesting capacity all increased with the increasing radiation dose at the initial stage. The maximum photosynthetic rate, light-resistant ability and light-harvesting capacity were promoted when the UV-B radiation dose below 100μW/cm2in the initial 16 days, and were inhibited when the dose beyond 100μW/cm2when the inhibitory effect lasted with prolonging the irradiation time. Eventually, the treatment group all declined when the dose beyond 100μW/cm2, and the differences between the treatment groups were small when the dose below 100μW/cm2. It indicated that the maximum plant photosynthetic rate, light-resistant ability and light-harvesting capacity were injured less when the dose below 100μW/cm2, while the photosystem Ⅱ was injured by UV-B radiation when the dose beyond 100μW/cm2, so that the photosynthetic capacity reduced. Because the intensity of ultraviolet radiation on land surface increased in the late spring and early summer, the degree of damage to the plants increases evidently. Thus, the results of this study indicate that UV-B radiation may be an important factor leading to mass mortality ofP.crispusin late spring and early summer.
Potamogetoncrispus; rapid light curves; electron transport rate; light use efficiency; light-resistant ability
*国家自然科学基金项目(41105113,51109109)和江苏省环境演变与生态建设重点实验室开放基金项目联合资助.2014-04-30收稿;2014-10-16收修改稿.王锦旗(1976~),男,博士,讲师;E-mail: w_j_q@sina.com.
J.LakeSci.(湖泊科学), 2015, 27(3): 451-458
http: //www.jlakes.org.E-mail: jlakes@niglas.ac.cn
©2015 byJournalofLakeSciences
