2013年洱海水华期间微囊藻毒素和浮游植物动态变化*
2015-05-10余得昭
朱 荣,王 欢,余得昭,曾 诚,沈 宏,陈 隽*
(1:中国科学院水生生物研究所,东湖湖泊生态系统试验站,淡水生态与生物技术国家重点实验室,武汉430072)
(2:中国科学院大学,北京100049)
(3:华中农业大学水产学院,武汉430070)
2013年洱海水华期间微囊藻毒素和浮游植物动态变化*
朱 荣1,2,王 欢1,2,余得昭1,2,曾 诚3,沈 宏1,陈 隽1*
(1:中国科学院水生生物研究所,东湖湖泊生态系统试验站,淡水生态与生物技术国家重点实验室,武汉430072)
(2:中国科学院大学,北京100049)
(3:华中农业大学水产学院,武汉430070)
2013年秋季,洱海再次出现大规模水华,周边几十万居民的饮用水安全引起当地政府的极大关注. 为了解水华发生期间洱海水体微囊藻毒素的含量和浮游植物的种类及丰度,分别在2013年9月和10月两次在洱海采集水样,测定其中两种主要微囊藻毒素MC-LR和MC-RR含量,探讨微囊藻毒素含量对洱海周边水源地的安全影响. 同时也对水华期间的浮游植物特别是蓝藻进行研究,从而分析微囊藻毒素与浮游植物种类和丰度的关系. 结果表明,洱海水体中微囊藻毒素含量偏低,暂不会对人类健康产生威胁,但在洱海的水鸟体内仍然检测到微囊藻毒素的富集,显示洱海蓝藻水华对水生生物的潜在危害不容忽视. 浮游植物的研究发现,洱海水华的优势种属为微囊藻(Microcystis)和暗丝藻(Psephonemaaenigmaticus).9月份暗丝藻更占优势,10月份则是微囊藻更占优势. 研究结果显示处于富营养化初期的洱海水体中湖湾微囊藻毒素的含量与浮游植物中产毒蓝藻的种类和丰度密切相关.
洱海;蓝藻水华;微囊藻毒素;浮游植物
洱海地处云南省大理市,是云南省第二大淡水湖泊,也是国内外颇具声名的旅游度假胜地. 随着近年经济开发日益增强,富营养化问题也日趋突出[1]. 以螺旋鱼腥藻(Anabaenasporoides)为优势的蓝藻水华自1996年9月在洱海首次大面积发生以来,每年夏、秋季都会频繁地在大部分湖湾发生[2]. 调查显示,我国淡水湖泊中发生的水华80%有毒[3],水华过程中产生的藻毒素对动物甚至人的健康都会有威胁,而微囊藻毒素(microcystins, MCs)是分布最广、毒性最大的种类之一. MCs具有肝脏毒性和肿瘤促进作用[4],它不仅对水生生物产生毒害作用,还可能通过饮用水和食物链的生物富集危害人类健康[5-6]. 而且MCs分布广泛,具有稳定的化学结构,在常规饮用水处理中并不能被有效地去除[7]. 流行病学研究表明,中国南方原发性肝癌的高发病率可能与饮水中的MCs污染有关[8]. 因此,MCs对人们的饮水安全造成严重的威胁,水体中MCs的含量是否达标是公众非常关注的问题. 洱海作为大理市主要的水源地,周围分布着大大小小9个水厂,而关于洱海全湖特别是水厂附近水体中MCs含量的调查研究却十分缺乏. 浮游植物特别是蓝藻门有些种类是形成水华的原因种,在国内许多湖泊中引起水华并严重影响水体生态服务功能. 洱海处于富营养化初期这一敏感时期,浮游植物的变动对洱海水质的影响非常重要,且浮游植物的种类和丰度也会影响水体中的MCs含量. 因此,我们在此次洱海水华暴发较为严重的9月对全湖43个位点包括9个水源地的MCs浓度、浮游植物种类与丰度以及水体多项理化指标的动态变化进行了监测,并在10月再次重点对水源地进行跟踪调查,以期为洱海的富营养化现状、水源的安全问题等提供基础数据.
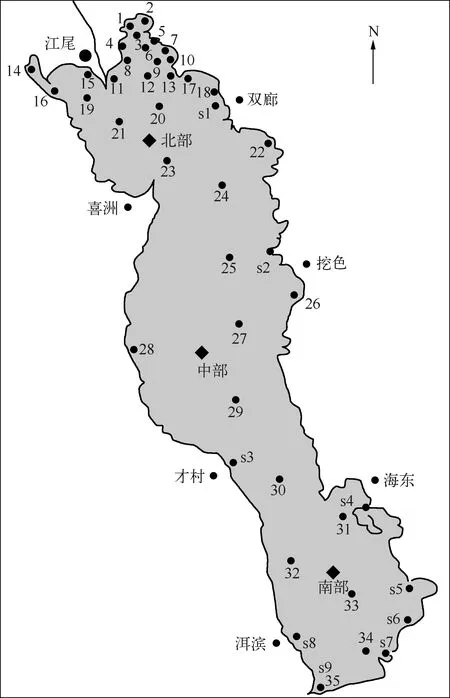
图1 洱海采样点分布Fig.1 Distribution of sampling sites in Lake Erhai
1 材料与方法
1.1 采样时间和样点设置
采样时间为2013年9月和10月. 9月份,在洱海全湖共计设置43个采样点:湖湾采样点20个(1~20),大湖采样点15个(21~35),水源地采样点9个(s1~s9),其中水源地s9与大湖采样点35重合. 对9月份水体中的MCs测定后发现,洱海水体中MCs含量总体偏低,因此10月份的采样重点关注水源地的情况,采集了9个水源地水样,同时设置了南部、北部、中部3个采样点,共计12个采样点(图1).
1.2 水样采集与理化指标测定

1.3 浮游植物分析
用于浮游植物鉴定的水样(1 L)用酸化的鲁哥试剂进行现场固定[10]. 样品带回实验室后,通过静置沉淀48 h,浓缩至50 ml. 将浓缩样品充分摇匀后,取0.1 ml放置于计数板(0.1 ml,20 mm×20 mm)中,用显微镜在400倍放大率下进行鉴定和计数. 浮游植物种类鉴定参照文献[11].
1.4 微囊藻毒素的萃取与分析
1 L混合水样用真空泵经过玻璃纤维滤膜(Whatman GF/C,UK)过滤后分为滤液和滤膜两部分,滤膜上的藻细胞用于测定胞内毒素(intracellular MCs),滤液用于测定胞外毒素(extracellular MCs). 滤膜用30 ml甲醇(75%)提取,在4℃下振荡3 h(200 转/min),并连续提取3次,得到的悬浊液用高速冷冻离心机(Jouan KR22i, France)离心30 min(4℃,15000转/min),分离得到上清液用去离子水稀释6倍. 滤液和稀释过的上清液再分别用C18固相萃取柱(0.5 g)富集,富集前萃取柱用10 ml甲醇(100%,分析纯)和10 ml去离子水活化调节,接着用20 ml甲醇(100%,分析纯)洗脱萃取柱中的MCs. 洗脱液经旋转蒸发仪蒸干后得到的固态物质用100 μl去离子水溶解并定容,最后用LC-MS(Thermo Electron Corporation, USA)进行MCs的定性和定量分析测定,具体方法参见文献[13].
采样过程中在洱海水体中发现了两只死亡的水鸟,经鉴定分别为秧鸡科和翠鸟科的幼体. 由于此前关于死鸟及死龟的报道仅见于高浓度MCs污染水体[12-13],故在洱海这样富营养化初期水体中死鸟的发现引起了我们的关注. 将死鸟带回实验室解剖,分别测定其肝脏、肠、肾脏、肌肉、嗉囊中的MCs含量,参考Wang等[14]的方法进行测定.
2 数据结果
2.1 理化参数分析
研究期间洱海的采样点pH均大于8.5,部分采样点甚至超过9,水温在23℃左右,除去部分靠近岸边的采样点外,水深均超过5 m,透明度在1.3 m左右,全湖平均TN含量为0.71 mg/L,TP含量为0.031 mg/L,Chl.a为0.02 mg/L,而且相较于9月,10月的DO明显降低(表1).
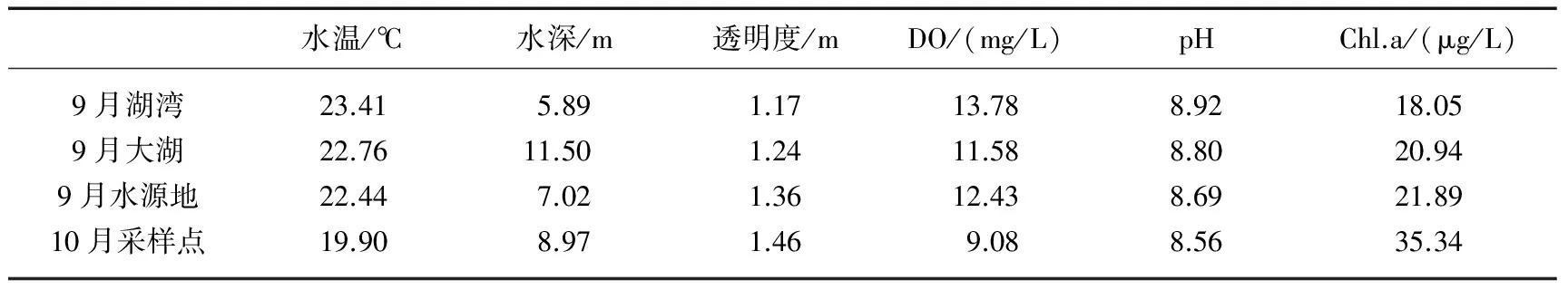
表1 洱海2013年9、10月理化数据
2.2 微囊藻毒素浓度
此次调查中,洱海水体所有采样点均检测到MC-RR和MC-LR.9月份,洱海全湖胞外MCs含量都非常低,不超过0.020 μg/L. 而胞内MCs则明显高于胞外MCs含量,其中湖湾采样点的胞内MCs含量(均值为0.069 μg/L,最高值为0.297 μg/L)高于大湖采样点的胞内MCs含量(均值0.016 μg/L,最高值0.075 μg/L)和水源地采样点的胞内MCs含量(均值0.023 μg/L,最高值0.120 μg/L),利用SPSS进行t检验,发现水源地和大湖胞内MCs无显著差异,但两者均显著低于湖湾的MCs含量(P<0.01). 所有采样点,无论是胞外还是胞内MCs含量都远低于饮用水的安全标准(<1 μg/L). 鉴于9月洱海水体中MCs含量普遍偏低的状况,10月份的采样重点为水源地. 除继续关注9个水源地水样外,为了解全湖状况,同时设置南部、北部、中部3个采样点,对全湖12个采样点的水质安全进行监测. 结果显示,10月份洱海水体胞外MCs含量依然很低,为0.0032 μg/L,但胞内MCs含量明显升高,水源地胞内MCs含量平均达到0.487 μg/L,最高可达0.694 μg/L,远远高于9月份水源地的胞内MCs含量,但与南部、北部、中部3个点的胞内MCs含量相比,差别不大(均为4.87 μg/L).12个采样点中,与北部湖湾位置较近的水源地1#点的胞内MCs含量明显大于其他采样点,这与9月份的趋势一致,显示洱海的重要生态风险区在北部湖湾及附近水源地(图2、图3). 另外,在洱海发现的水鸟体内也检测到了MCs,其中肠道中的含量最高,为0.057 μg/kg,肝脏中为0.02 μg/kg,肾脏中为0.005 μg/kg,肌肉、心脏含量分别为0.005 μg/kg和0.002 μg/kg,嗉囊中为0.004 μg/kg.
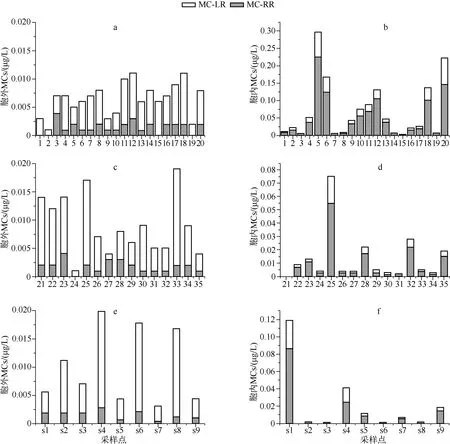
图2 洱海2013年9月湖湾(a、b)、大湖(c、d)和水源地(e、f)的胞外和胞内MCs含量Fig.2 Concentrations of extracellular and intracellular MCs in Lake Erhai in September of 2013

图3 洱海2013年10月全湖胞外和胞内MCs含量Fig.3 Concentrations of extracellular and intracellular MCs of Lake Erhai in October of 2013
2.3 浮游植物分析
浮游植物种类及丰度的镜检结果显示,水华期间大部分采样点浮游植物的丰度超过107cells/L. 此次调查共鉴定出蓝藻、绿藻、硅藻、甲藻、隐藻和金藻6门39属的浮游植物,较为常见的种属包括微囊藻属、暗丝藻、小环藻属、伪鱼腥藻属和小球藻属. 优势种属为微囊藻和暗丝藻,其中9月份暗丝藻更占优势,而10月份则是微囊藻更占优势. 浮游植物的空间差异性非常明显.9月份,湖湾浮游植物丰度均值为1.33×107cells/L,大湖浮游植物丰度均值为2.27×107cells/L,水源地浮游植物丰度为2.08×107cells/L,湖湾浮游植物的丰度小于大湖和水源地,但是蓝藻门所占比例却明显高于大湖和水源地.10月水源地浮游植物丰度均值为1.48×107cells/L,而南部、北部、中部3个点的浮游植物丰度均值为9.26×106cells/L. 与9月份水源地浮游植物丰度相比,10月份的浮游植物丰度较低,但是蓝藻门比例大于9月份,而且硅藻的比例有所增加(图4).
由于调查期间胞外MCs含量非常低,而且受各种环境因子影响较大,因此进行相关性分析时,仅对胞内MCs含量和微囊藻丰度(剔除惠氏微囊藻(Microcystiswesenbergii)丰度)进行分析,结果发现,两者呈正相关关系,而且湖湾呈显著性正相关(r=0.517,P<0.05),但大湖相关性不显著(r=0.405,P>0.05).
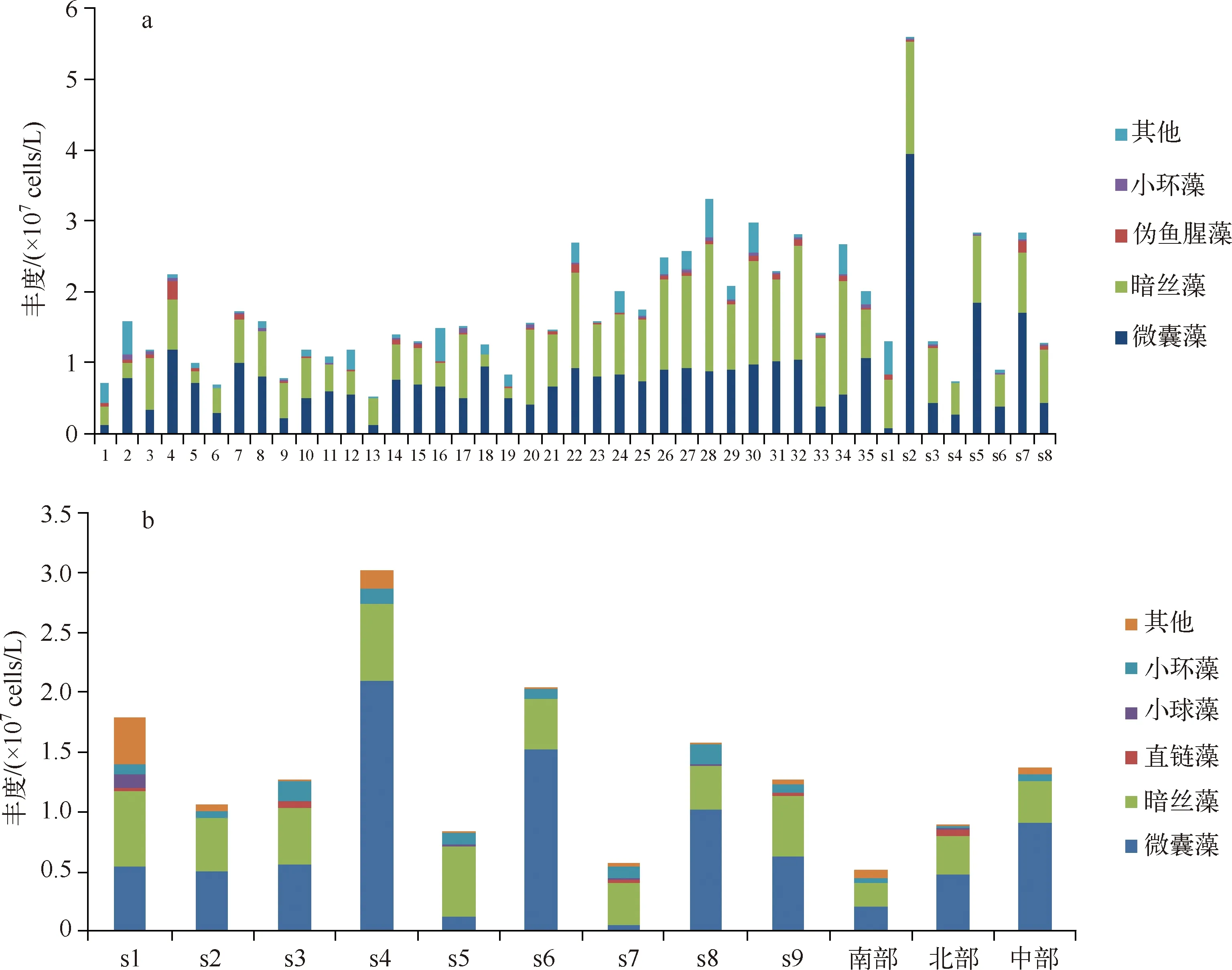
图4 洱海2013年9月(a)和10月(b)浮游植物丰度Fig.4 The phytoplankton abundance of Lake Erhai in September(a) and October(b) of 2013
3 讨论
洱海全湖TN含量为0.71 mg/L,TP含量最高可达0.031 mg/L. 据文献报道,蓝藻最适宜生长的温度是25℃. 在这种温度条件下,营养盐含量高、有机质丰富的碱性水体极有利于蓝藻的生长[15]. 日本湖泊学家坂本也曾研究指出,当湖水的TN和TP浓度比值在10∶1至25∶1的范围时,处于最佳氮磷比值范围,藻类生长与氮、磷浓度存在着直线相关关系[16]. 洱海为磷限制湖泊,N/P是蓝藻丰度变化的重要影响因子之一[17]. 本研究期间,洱海的水温、营养盐状况及pH值接近蓝藻最适生长条件,平均水温23.2℃、N/P均值23∶1、pH>8的环境条件非常适宜藻类生长.
洱海水体中MCs的含量呈现明显的空间差异,由9月份MCs数据可知,湖湾胞内MCs含量要高于大湖胞内MCs含量. 由于湖湾较为封闭,水的流动性较差,Romo等的研究指出,微囊藻的产毒种占蓝藻生物量的比例及其产毒能力与水体停留时间呈正相关[18],这部分解释了湖湾微囊藻丰度小于大湖,但MCs含量却大于湖湾的结果. 而且浮游植物调查结果显示,湖湾中微囊藻属和蓝藻门所占浮游植物比例都高于大湖,而MCs主要是由微囊藻和蓝藻门的其他一些藻类产生,因此湖湾中MCs含量高于全湖水平. 另外,湖湾水生植物丰富,沉水植物和浮叶植物的覆盖度都比大湖大,浮游植物与其他水生植物对资源的利用存在竞争关系,在有竞争的情况下,产毒微囊藻更有优势[19],浮游植物数据结果也表明湖湾惠氏微囊藻的比例要低于大湖,因此湖湾地区产毒微囊藻比不产毒的微囊藻占据更大的比例,最终导致湖湾的MCs含量高于大湖.
洱海水体中MCs含量在时间上也存在差异. 不论是胞外还是胞内MCs,10月份的浓度均明显大于9月份,虽然调查期间洱海水体胞外MCs含量一直很低. 在蓝藻暴发期微囊藻产毒基因的丰度显著增加[20-21],处于暴发期的蓝藻可能合成更多的藻毒素[22],因此通过9月份的累积效应,10月份胞内藻毒素含量显著增加. 但是,即使蓝藻已进人稳定期或达到很高的丰度也可能只有少部分藻细胞死亡,所以胞外藻毒素含量依然很低.2013年秋季洱海蓝藻水华发生期间,胞外藻毒素平均含量低于0.005 μg/L,胞内藻毒素平均含量也低于0.7 μg/L,而这两者都低于集中式生活饮用水地表水源地对该项目的限定值1 μg/L,因此,民众不必过于恐慌. 但是随着水华的持续,大量藻细胞死亡,这会导致水体中MCs浓度升高. 而且,9月份通过对洱海水鸟体内MCs含量的测定,发现MCs在水鸟体内有富集,最高达到0.057 μg/kg (DW),这表明长时间低浓度的MCs暴露环境,依然会对水生生物产生较为严重的影响. 因此虽然不能确定这两只鸟是否直接死于MCs在体中的富集,但是MCs对水生生物和人类的健康会产生威胁[23]却是毋庸置疑的,因此处于富营养化初期的洱海水体中的MCs污染需要密切关注.
通过对洱海9、10月浮游植物的研究发现,无论在9月还是10月,浮游植物均以蓝藻和绿藻为主,占浮游植物丰度的85%以上,9月份更是占到95%. 但是从9月份到10月份,浮游植物的组成发生了明显变化. 首先,蓝藻的比例增加,绿藻比例减少,硅藻和隐藻在10月占据了一定的比例. 吕兴菊等[24]指出洱海藻类群落的演替方向从冬季到来年冬季为:硅藻和绿藻—水华束丝藻(Aphanizomenonflosaquae)—微囊藻—鱼腥藻—硅藻和绿藻,因此从9月观察到硅藻,到10月比例进一步增加,符合这种演替规律. 同时针对MCs含量,特别关注了蓝藻中的微囊藻. 洱海水体中微囊藻以铜绿微囊藻(Microcystisaeruginosa)和惠氏微囊藻为主,占到90%以上. 9月,惠氏微囊藻占微囊藻总丰度的15%左右,而在10月,这一比例降低至8%左右. 已有研究证明,惠氏微囊藻无产毒基因,不产微囊藻毒素[25],这也在一定程度上解释了为什么10月MCs含量高于9月份. 而对MCs含量和微囊藻丰度(除惠氏微囊藻)的相关性分析发现,在湖湾这两者呈显著正相关,而在大湖这两者相关性不显著,这可能是由于大湖水域开阔、流动性强、风浪也较大,而湖湾较为封闭、水体流动性不强等导致的.
回顾洱海历年来的水华浮游植物研究可以发现,洱海浮游植物的丰度和水华优势种一直处于波动之中.1996年洱海首次发生水华时,浮游植物平均丰度为1.22×107cells/L[24], 2003 年9月洱海蓝藻水华发生期间,浮游植物丰度达6×107cells/L[26],2006年蓝藻水华期间浮游植物丰度最大值出现在7月,浮游植物丰度达1.64×107cells/L[27],2011年浮游植物丰度为5.9×107cells/L[28],本次调查期间,洱海全湖的浮游植物丰度均值为1.3×107cells/L.1996年洱海水华首次发生时,以鱼腥藻为主,2003年优势属为微囊藻,在2006年,则演替为鱼腥藻,2011年以鱼腥藻为优势属,而在2013年,优势种属为微囊藻和暗丝藻.
综上所述,洱海2013年秋季,洱海水体中胞外、胞内MCs含量较低,水华的发生对当地水源地安全影响较小,周边水厂作为大理市的水源还是安全的. 本次水华优势种相较于以前也发生了变化,浮游植物的丰度并没有达到历史最高,但是也是近几年水华较为严重的一次,应该引起重视.
[1] 董云仙. 洱海蓝藻水华研究. 云南环境科学, 1999, 18(4): 28-31.
[2] 王 芸. 洱海夏秋季蓝藻种群动态变化及水华成因分析. 大理学院学报, 2008, 7(12): 39-42.
[3] 吴幸强, 龚 艳, 王 智等. 微囊藻毒素在滇池鱼体内的积累水平及分布特征. 水生生物学报, 2010, 34(2): 388-393.
[4] Dawson RM. The toxicology of microcystins.Toxicon, 1998, 36: 953-962.
[5] Xie LQ, Xie P, Guo LGetal. Organ distribution and bioaccumulation of microcystins in freshwater fishes with different trophic levels from the eutrophic Lake Chaohu, China.EnvironmentalToxicology, 2005, 20: 292-300.
[6] Chen T, Cui J, Liang Yetal. Identification of human liver mitochondrial aldehyde dehydrogenase as a potential target for microcystin-LR.Toxicology, 2006, 220: 71-80.
[7] 陈 艳, 俞顺章, 林玉娣等. 太湖流域水中微囊藻毒素含量调查. 中国公共卫生, 2002, 18: 1455-1456.
[8] 俞顺章, 赵 宁, 资晓林等. 饮水中微囊藻毒素与我国原发性肝癌关系的研究. 中国肿瘤学杂志, 2001, 23(2): 96-99.
[9] Zheng L, Xie P, Li YLetal. Variation of intracellular and extracellular microcystins in a shallow, hypereutrophic subtropical Chinese lake with dense cyanobacterial blooms.BulletinofEnvironmentalContaminationandToxicology, 2004, 73: 690-706.
[10] Maita Y, Parsons TR, Lalli CM. A manual of chemical and biological methods for seawater analysis. Oxford: Pergamon Press, 1984.
[11] 胡鸿钧, 魏印心. 中国淡水藻类——系统、分类及生态. 北京: 科学出版社, 2006.
[12] Krienitz L, Ballot A, Kotut Ketal. Contribution of hot spring cyanobacteria to the mysterious deaths of Lesser Flamingos at Lake Bogoria, Kenya.FEMSMicrobiologyEcology, 2003, 43(2): 141-148.
[13] Nasri H, Herry SE, Bouaïcha N. First reported case of turtle deaths during a toxicMicrocystisspp. bloom in Lake Oubeira, Algeria.EcotoxicologyandEnvironmentalSafety, 2008, 71(2): 535-544.
[14] Wang Q, Xie P, Chen Jetal. Distribution of microcystins in various organs (heart, liver, intestine, gonad, brain, kidney and lung) of Wistar rat via intravenous injection.Toxicon, 2008, 52: 721-727.
[15] 山东省水产学校. 淡水生物学. 北京: 农业出版社, 1997: 12-14.
[16] 严力蛟,金晓辉,全为民等.千岛湖水体营养主控因子分析.当代生态农业,2001,(3):89-93.
[17] 金相灿, 刘鸿亮, 屠清瑛等. 中国湖泊富营养化. 北京: 中国环境科学出版社, 1990: 373-388.
[18] Romo S, Soria J, Fernandez Fetal. Water residence time and the dynamics of toxic cyanobacteria.FreshwaterBiology, 2013, 58: 513-522.
[19] Briand E, Yéprémian C, Humbert JFetal. Competition between microcystinm and non-microcystin-producingPlanktothrixagardhii(cyanobacteria) strains under different environmental conditions.EnvironmentalMicrobiology, 2008, 10: 3337-3348.
[20] Ye W, Liu X, Tan Jetal. Diversity and dynamics of microcystin—Producing cyanobacteria in China’s third largest lake, Lake Taihu.HarmfulAlgae, 2009, 8(5): 637-644.
[21] Kim SG, Joung SH, Ahn CYetal. Annual variation ofMicrocystisgenotypes and their potential toxicity in water and sediment from a eutrophic reservoir.FEMSMicrobiologyEcology, 2010, 74: 93-102.
[22] 王经结, 杨 佳, 鲜殷呜等. 太湖微囊藻毒素时空分布特征及与环境因子的关系. 湖泊科学,2011, 23(4): 513-519.
[23] de Magalhaães VF, Soares RM, Azevedo SMFOetal. Microcystin contamination in fish from the JacarepaguLagoon (Rio de Janeiro, Brazil): ecological implication and human health risk.Toxicon, 2001, 39: 1077-1085.
[24] 吕兴菊, 朱 江, 孟 良. 洱海水华蓝藻多样性研究. 环境科学导刊, 2010, 29(3): 32-35.
[25] Xu Y, Wu Z, Yu Betal. Non-microcystin producingMicrocystiswesenbergii(Komrek) Komrek(Cyanobacteria) representing a main water bloom-forming species in Chinese waters.EnvironmentalPollution, 2008, 156(1): 162-167.
[26] 杜宝汉. 洱海富营养化研究. 云南环境科学, 1997, 16(2): 30-34.
[27] 李泽红. 洱海流域水污染预测与对策研究[学位论文]. 昆明: 昆明理工大学, 2006.
[28] 卫志宏, 张利仙, 杨四坤等. 洱海浮游植物群落结构及季节演替. 水生态学杂志, 2012, 33(4): 21-25.
Dynamic changes of microcystins and phytoplankton during the cyanobacterial bloom in Lake Erhai in 2013
ZHU Rong1,2, WANG Huan1,2, YU Dezhao1,2, ZENG Cheng3, SHEN Hong1& CHEN Jun1
(1:StateKeyLaboratoryofFreshwaterEcologyandBiotechnologyofChina,DonghuExperimentalStationofLakeEcosystems,InstituteofHydrobiology,ChineseAcademyofSciences,Wuhan430072,P.R.China)
(2:UniversityofChineseAcademyofSciences,Beijing100049,P.R.China)
(3:CollegeofFisheries,HuazhongAgriculturalUniversity,Wuhan430070,P.R.China)
In the autumn of 2013, a cyanobacterial bloom outbreak happened again in Lake Erhai, which caused huge public outcry and concern of the local government. In order to characterize the variations in microcystins concentrations, phytoplankton composition and density during a cyanobacterial outbreak and to evaluate the impact of microcystins on the safety of water source, a large-scale survey across the lake was conducted in September and October of 2013. Results indicated that microcystins were detected in all samples although the concentrations were low compared with those of Lake Taihu or Lake Chaohu. Both the intracellular and extracellular MCs concentrations were far less than the standards recommended by WHO (<1 μg/L), suggesting Lake Erhai as a water source for Dali City is relatively safe. However, we still found the microcystins accumulation in the body of aquatic birds in the lake. During the study period, 39 genera phytoplankton belonging to 6 phyla were recorded, with microcystins (Cyanophyta) andPsephonemaaenigmaticus(Chlorophyta) as the dominant genera(species). In September, the abundance ofP.aenigmaticuswas more than that ofMicrocystis, while the situation was opposite in October. The composition and abundance of toxin-producing cyanobacteria have impacts on the concentrations of microcystins in the bay.
Lake Erhai; cyanobacterial bloom; microcystins; phytoplankton
*淡水生态与生物技术国家重点实验室项目(2014FBZ02)和国家水体污染控制与治理科技重大专项(2012ZX07105-004)联合资助.2014-06-24收稿;2014-10-09收修改稿. 朱荣(1991~)女,硕士研究生;E-mail:zrfcug@163.com.
J.LakeSci.(湖泊科学), 2015, 27(3): 378-384
http: //www.jlakes.org.E-mail: jlakes@niglas.ac.cn
©2015 byJournalofLakeSciences
**通信作者;E-mail:chenjun@ihb.ac.cn.
