利用单片段代换系检测玉米花期相关性状QTL
2015-05-10张晓祥孙高阳张兴瑞陈永强刘晓阳李卫华
张晓祥,时 夏,孙高阳,张兴瑞,陈永强,刘晓阳,李卫华
(河南农业大学农学院,河南郑州450002)
适宜的开花期是玉米的重要育种目标之一,与玉米最终产量、光周期反应特性以及地域与季节的适应性有着密切关系。在中国重要的玉米产区——黄淮海夏玉米区,由于特殊的一年两熟(小麦-玉米)耕作制度,尤其对夏玉米的开花期、散粉期、开花-散粉间期等相关性状有着重要的要求,这些开花期相关性状也是培育适宜生产需求的超高产宜机收玉米新品种的重要改良目标,深入研究其遗传机制和调控机制将为定向选育玉米新品种提供必要的理论依据和技术支撑。
玉米开花期的相关性状是典型的多基因控制的数量性状,并利用 BC1,F2,RIL或DH等初级作图群体定位了许多影响玉米生育时期的QTL[1-6]。随着次级作图群体在农作物重要农艺性状和产量性状的遗传机制研究中不断获得重要应用,染色体单片段代换系(SSSL)群体已经成为农作物重要性状遗传研究的较为理想群体,在玉米、水稻等重要作物的QTL分析和精细定位中获得广泛应用[7-11],因其消除了遗传背景与 QTL之间的互作干扰,只需通过对SSSL与受体表型性状的差异显著性分析即可以进行相关性状的QTL定位[12-14]。在前期的研究中,构建了一套包含105个纯合的许178背景的综3单片段代换系群体,包含74个不重复代换片段,分布在玉米10条染色体上,覆盖玉米基因组的47.85%[15],利用这套群体对玉米开花期相关性状的QTL进行分析,共鉴定出47个控制玉米开花期相关性状的QTL,包括14个散粉期QTL,16个吐丝期QTL,17个控制散粉-吐丝间期的QTL,其中,1个散粉期的 QTL、2个吐丝期的QTL和4个散粉-吐丝间期的QTL在2种环境下被重复检测到[16]。但是因为该套群体中插入的片段较长,检测到的重复QTL数量较少,为了探索在不同遗传背景下玉米开花期的遗传机制,本研究利用构建的以优良玉米自交系Lx 9801为受体亲本、昌7-2为供体亲本的另一套单片段代换系群体,在2个环境条件下对玉米开花期相关性状的QTL分析,以期继续鉴定出控制玉米开花期相关性状的重要QTL,并结合前期结果分析它们在不同遗传背景下的差异表现,同时寻找与这些性状紧密连锁的分子标记,为进一步剖析玉米开花期相关性状的遗传机制和基因克隆奠定基础。
1 材料与方法
1.1 试验材料
本研究所用材料为184个纯合的以Lx 9801为遗传背景的昌7-2染色体单片段代换系(SSSLs)群体,以优良玉米自交系Lx 9801为受体亲本、昌7-2为供体亲本,通过杂交、连续回交,回交后代自交和SSR(simple sequence repeats)标记跟踪供体染色体片段的方法筛选而成[17]。
1.2 田间试验设计
2013年夏将184个单片段代换系群体和作为对照的2个亲本分别种植于河南省长葛市尚官曹村试验田和鹤壁市农科院刘寨试验田,每个地点设3个重复,随机区组设计单行区,行长3 m,行距和株距分别为0.67 m和0.23 m,每行13株,常规田间管理。在田间对每一个家系的散粉期和吐丝期分别记载,其中散粉期指从播种至每行50%以上植株雄穗开始散粉的天数,吐丝期指从播种至每行50%以上植株雌穗吐丝的天数,散粉-吐丝间期(ASI)是指吐丝期与散粉期相差的天数。
1.3 数据分析
采用SPSS 19.0统计软件,对184份材料的散粉期、吐丝期和散粉-吐丝间期进行表型描述统计和相关分析[18]。以Lx 9801多个小区的观察值合并作为对照,通过方差分析和t测验比较各代换系花期与受体亲本Lx 9801花期的显著性水平,若代换系的花期与受体亲本的花期达到P≤0.05的显著水平,则认为该单片段代换系中来自于昌7-2代换片段与受体亲本Lx 9801相对应的染色体片段具有差异效应,即存在目标性状的QTL,参照ESHED[19]的方法估算各QTL的加性效应值,加性效应值=(SSSL表型值-Lx 9801表型值)/2。
2 结果与分析
2.1 单片段代换系群体玉米开花期相关性状表型分析
从表1可以看出,受体亲本自交系Lx 9801和供体昌7-2在同一环境条件下的相关性状存在差异。轮回亲本 Lx 9801吐丝较早,散粉较晚,散粉-吐丝间期较长,而供体亲本昌7-2的吐丝期和散粉期相对较为接近,散粉-吐丝间期较短,尤其在长葛点表现为同时散粉吐丝;并且花期相关性状的表现和试验环境存在联系,表现为在长葛点双亲的吐丝期和散粉期均晚于浚县。单片段代换系群体的花期性状在2个环境中均存在较大的变异范围,如浚县吐丝期 50.33 ~56.67 d,散粉期52.33 ~60.00 d,长葛吐丝期 53.00 ~58.67 d,比浚县的吐丝期短,而散粉期相近,其吐丝期和散粉期的平均值在长葛点的均大于浚县点,说明长葛的吐丝期和散粉期比浚县晚。另外,玉米单片段代换系在散粉期、吐丝期及散粉-吐丝间期这3个花期性状均符合正态分布,体现出数量性状遗传的特点,可用来进行QTL分析。造成试验两点差异的原因可能与两点间的的气候条件、播种日期、土壤肥力、光周期等环境因素有关。
2.2 玉米花期相关性状的QTL分析
利用单片段代换系群体在浚县、长葛两试验点玉米花期相关性状的表型值与对照受体亲本的表表型值进行统计分析,在P<0.01水平下,在2个试验地点共检测到51个玉米花期相关性状的QTL(表2),包括16个吐丝期 QTL、15个散粉期 QTL和20个散粉-吐丝间期QTL。
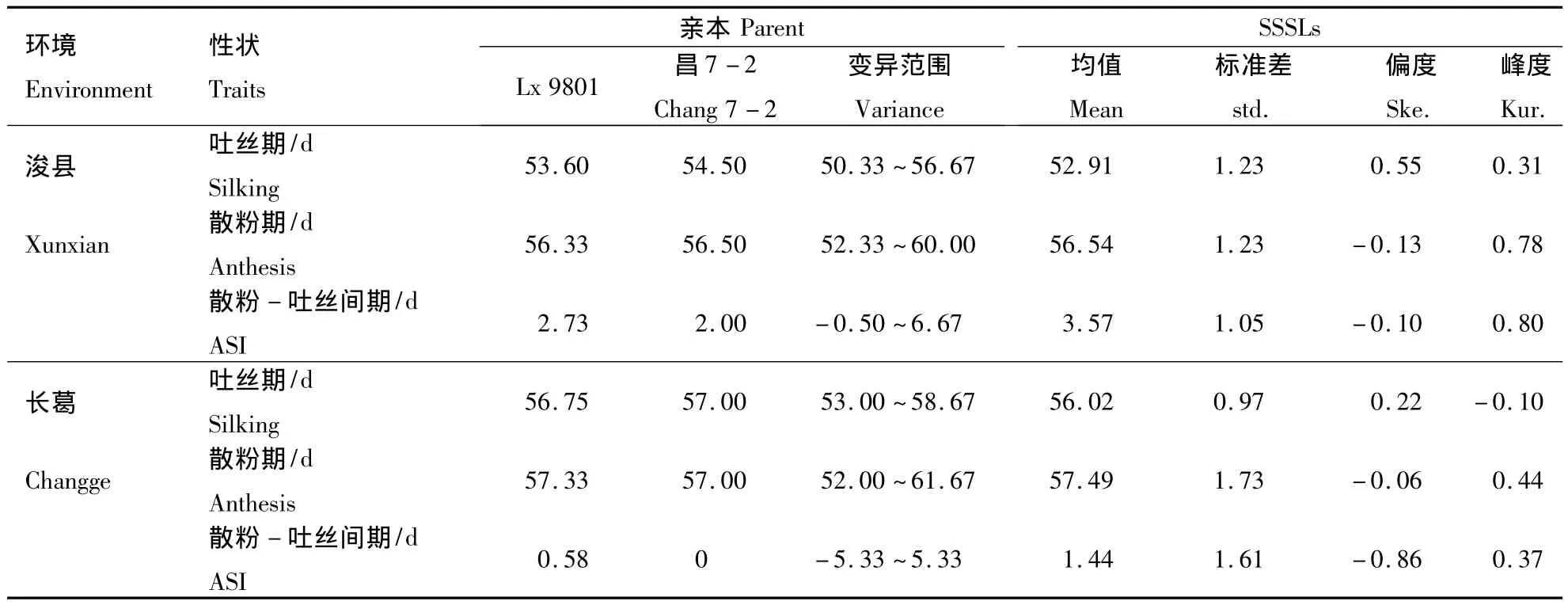
表1 亲本及SSSLs群体生育时期性状表现Table 1 The performance of flowering related traits for the parents and SSSLs populations
在检测到的16个吐丝期QTL中,浚县点检测到8个 QTL,其加性效应值范围为 -1.47~2.2;长葛点检测到12个 QTL,其加性效应值范围为-1.04~0.63;在两地点间共重复检测到4个一致性 QTL,分别为 qDTS4a(位于 4.01 bin,标记区间为 umc1017-umc1757-umc2280),qDTS6a(位于6.00 bin,标 记 区 间 为 phi075 - bnlg238 -umc2309),qDTS6b(位于 6.04 bin,标记区间为umc1105-umc1979 -nc009),qDTS6c(位于 6.07 bin,标记区间为 umc1653-umc2059-phi123),这4个QTL位点在浚县点的加性效应值分别为-1.63,-0.47,-1.47 和 -1.3,在长葛点的加性效应值分别为 -1.21,-0.71,-1.21 和 -0.88。
散粉期一共检测到15个QTL,包括在浚县点定位的8个QTL和长葛点定位的9个QTL,其中qDTA2a和qDTA4a在2个环境中同时被检测到,标记区间分别为位于 2.03 bin的 umc2195-umc1555-bnlg1064和位于4.01 bin的umc1232-phi072-umc1228,qDTA2a在浚县和长葛的加性效应值分别为1.00和1.33,qDTA4a在浚县和长葛的加性效应值分别为-1.33和-1.00。
在浚县点检测到12个控制散粉-吐丝间期的QTL,在长葛点则检测到10个QTL位点,其中在2个地点间重复检测到2个位点,即位于7.02 bin的qASI7b,其标记区间为 umc1433-bnlg1380-bnlg1792,在浚县点和长葛点的加性效应值分别为1.47和2.17;以及位于 9.06 bin 的 qASI9b,其标记区间为umc1310-umc2207-dupssr29,在浚县点和长葛点的加性效应值分别为1.47和-2.67。
从表2可以看出,在浚县点检测到的8个吐丝期QTL和12个散粉-吐丝间期的QTL中,存在4个同时控制吐丝期和散粉-吐丝间期的位点,分别存在于 3.04,6.07,7.02 和 7.04 bin,而且位于6.07 bin控制吐丝期性状的QTL在2个环境中都能重复检测。而在长葛点检测到的控制吐丝期、散粉期和散粉-吐丝间期的所有31个QTL中,有3个QTL同时控制吐丝期、散粉期和散粉-吐丝间期,分别位于玉米染色体的 2.04,6.07,6.00 和9.06 bin;还有1个位于4.01 bin同一标记区间umc1017-umc1757-umc2280内的位点同时控制吐丝期和散粉-吐丝间期,另外值得注意的还有一个位于6.04 bin标记区间为umc1105-umc1979-nc009的位点同时控制散粉期和吐丝期。
3 结论与讨论
本研究利用184个纯合的以Lx 9801为遗传背景的昌7-2染色体单片段代换系群体,在浚县、长葛两试验点共检测到51个玉米花期相关性状的QTL,包括16个吐丝期QTL、15个散粉期QTL和20个散粉-吐丝间期QTL,其中在2个环境中重复检测到4个吐丝期QTL、2个散粉期QTL和2个散粉-吐丝间期QTL。从该结果可以看出,玉米花期相关性状作为典型的数量性状基因,虽然受环境条件影响较大,但有些基因还是能够在不同环境中稳定表达,而重复检测到得QTL较少则暗示着玉米开花期性状受环境因素的影响较大,同时也预示着玉米开花期性状有着广泛而复杂的遗传基础。
本研究中,检测到的QTL在玉米10条染色体上均有分布,但是每条染色体上检测到的QTL位点数目存在极大差异。较多的如在玉米第2、第6和第9染色体上分别分布着8个花期性状QTL位点,但在第8条和第10条染色体上各自仅仅存在1个花期性状QTL位点。本研究定位的51个控制玉米花期性状的QTL多数集中在第2、4、6、9染色
体上的4个区间内,具有明显的热点区域,如第2染色体区段存在1个控制吐丝期QTL、4个散粉期的QTL和3个散粉-吐丝间期QTL;第4染色体区段存在2个吐丝期QTL、2个散粉期的QTL和2个散粉-吐丝间期QTL;第6染色体区间发现了3个控制吐丝期的QTL、3个散粉期QTL和2个散粉-吐丝间期QTL;在第9染色体区间发现了3个吐丝期QTL、2个散粉期的QTL和3个散粉-吐丝间期QTL。

表2 2个环境中玉米花期相关性状的QTL分析Table 2 The QTL detected for maize flowering related traits in two sites
一般认为,控制同类或相近性状的QTL,在玉米染色体上的分布体现出一定规律性,即相关基因在染色体上的集中分布,上述热点区域暗示这些染色体区间可能存在一些相关性状的基因家族。利用许178背景的综3单片段代换系进行玉米开花期相关性状QTL分析获得的结果[16],发现利用两套单片段代换系群体检测到的QTL位点存在一致性热点区域,如2.04 bin和6.00 bin,在不同遗传背景下都同时存在控制散粉期、吐丝期和散粉-吐丝间期的QTL位点,表明这些位点内可能真正存在能够控制玉米花期相关性状的基因,不受环境的影响而稳定表达。另外,检测到的 QTL位点qDTS4a,qDTA4a 与李卫华等[11]报道的控制穗长(qEL4)和行粒数(qKN4)QTL位置区间相同,这种簇集分布的特征存在多种预测,其中一因多效,或者控制不同性状的基因紧密连锁可能是其主要原因[20-21]。这些位点在染色体上的成簇分布为相关基因的克隆及分子标记辅助选择提供了有利的条件,但要实现这些目标,必须构建亚片段代换系群体,这也是下一步利用单片段代换系群体进行QTL分析和重要位点克隆的。
[1] AUSTIN D F,LEE M.Genetic resolution and verification of quantitative trait loci for flowering and plant height with recombinant inbred lines of maize[J].Genome,1996,39:957-968.
[2] RIBAUT J,H0ISINGT0N D,DEUTSEH J A.Identification of quantitative trait loci under drought condition in tropical maize.2.Flowering parameters and the anthesis-silking interval[J].Theor Appl Genet,1996,92:905-914.
[3] VELDBO0M L R,LEE M.Molecular-marker-facilitated studies of morphological traits in maize.II.Determination of QTLs for grain yield and yield components[J].Thero Appl Genet,1994,89(4):451 -458.
[4] 兰进好.玉米开花期相关性状的QTL分析[J].西北植物学报,2010,30(3):471 -480.
[5] 胡彦民,吴 欣,李翠香,等.玉米制种花期相关性状的QTL分析[J].南京农业大学学报,2008,31(1):11-16
[6] 孙婷婷,姜 昱,沈 鑫,等.利用F2:3群体对玉米花期相关性状的QTL分析[J].玉米科学,2013,21(2):42-46.
[7] 王 军,周 勇,杨 杰,等.利用染色体单片段代换系定位水稻粒重QTL[J].农业科学与技术:英文版,2014,15(8):1288 -1294.
[8] 张月雄,颜 群,黄大辉,等.利用单片段代换系鉴定水稻稻瘟病抗性座位[J].西南农业学报,2014,27(4):1478-1482.
[9] 曹金良,陈志伟,林德塨,等.通过构建单染色体片段代换系验证水稻细菌性条斑病抗性QTL qBlsr3d[J].分子植物育种,2014,12(3):416-420.
[10]许 诚,王 彬,毛克举,等.利用单片段代换系群体定位玉米株型性状 QTL[J].玉米科学,2014,22(2):28-34.
[11]李卫华,王洪秋,袁 亮,等.利用单片段代换系群体定位玉米穗部性状的QTL[J].河南农业大学学报,2013,47(2):143 -146.
[12]王玉民,席章营,尚爱兰,等.作物单片段代换系的构建及应用[J].中国农学通报,2008,24(3):67-71.
[13]席章营,吴建宇.作物次级群体的研究进展[J].农业生物技术学报,2006,14(1):128-134.
[14]王立秋,赵永锋,薛亚东,等.玉米衔接式单片段导入系群体的构建和评价[J].作物学报,2007,33(4):663-668.
[15]毛克举,李卫华,付志远,等.玉米自交系许178背景的综3染色体单片段代换系的构建[J].河南农业大学学报,2013,47(1):6-9.
[16]曹浩飞,王 彬,毛克举,等.基于单片段代换系群体的玉米开花期性状QTL分析[J].河南农业大学学报,2014,48(1):6-10.
[17]袁 亮,丁 冬,李卫华,等.玉米优良自交系单片段代换系的构建[J].玉米科学,2012,20(2):52-55.
[18]杜家菊,陈志伟.使用SPSS线性回归实现通径分析的方法[J].生物学通报,2010,45(2):4-6.
[19] ESHED Y,ZAMIR D.A genomic library of lycopersicon pennellii in Lesculentum:a tool of fine mapping of genes[J].Euphytica,1994,79:175-179.
[20] JIANG C J,ZENG Z B.Multiple trait analysis of genetic mapping for quantitative trait loci[J].Genetics,1995,140:1111-1127.
[21] LIMA M,SOUZA C,BENTO D.Mapping QTL for grain yield and plant take care,traits in a tropical maize[J].Molecular Breeding,2006,17(3):227 -239.
