SynphiLin-1 siRNA对6-OHDA诱导帕金森病大鼠黑质区NF-κB表达影响
2015-05-09张永军薛莉魏梅谢安木
张永军,薛莉,魏梅,谢安木
(青岛大学附属医院,山东 青岛 266003 1 神经内科; 2 康复科; 3 内分泌科)
·论著·
SynphiLin-1 siRNA对6-OHDA诱导帕金森病大鼠黑质区NF-κB表达影响
张永军1,薛莉2,魏梅3,谢安木1
(青岛大学附属医院,山东 青岛 266003 1 神经内科; 2 康复科; 3 内分泌科)
目的 研究SynphiLin-1 siRNA对6-羟基多巴胺(6-OHDA)诱导的大鼠黑质区核转录因子(NF-κB)表达的影响,探讨SynphiLin-1及NF-κB在帕金森病(PD)炎性发病机制中的作用。方法 选择Wistar大鼠36只,随机分成4组,每组9只,分别向大鼠左侧黑质致密部注入6-OHDA、SynphiLin-1 siRNA、抗坏血酸生理盐水及siRNA作为PD组、siRNA组、阳性对照组、siRNA对照组。采用免疫组织化学法检测各组大鼠黑质区酪氨酸羟化酶(TH)、SynphiLin-1及NF-κB表达,并进行比较。结果 与阳性对照组比较,PD组大鼠黑质区SynphiLin-1、NF-κB阳性细胞显著增加,TH阳性细胞数下降;与PD组比较,siRNA组大鼠黑质区NF-κB、SynphiLin-1阳性细胞明显减少,TH阳性细胞数显著增加,差异均有显著性(F=8.6~14.8,P<0.05)。siRNA组TH阳性细胞数与阳性对照组比较差异无统计学意义(P>0.05)。结论 SynphiLin-1可能是6-OHDA诱导的PD大鼠中脑黑质区炎症反应重要上游调节蛋白,与NF-κB相互作用,参与PD发病的神经炎性过程。
SynphiLin-1;NF-κB;羟多巴胺;帕金森病;酪氨酸单氧化酶
帕金森病(PD)是一种常见的中枢神经系统变性疾病,其发病机制尚未完全阐明,目前普遍认为是遗传易感性和环境因素共同作用的结果。PD主要的病理改变为黑质路易体(LB)的形成和神经元的缺失。SynphiLin-1是构成LB 的主要成分,有研究表明SynphiLin-1可能在PD的发病中具有重要意义[1-4]。已有研究证实,PD和阿尔茨海默病(AD)作为中枢神经系统变性疾病有相似的发病机制,神经炎症反应均介导疾病的发生与发展,而且核转录因子(NF-κB)为调节炎症反应的主要的信号通路,其激活与AD的发病有关[5-6]。在PD发生过程中,SynphiLin-1是否参与NF-κB表达调控以及二者之间表达的关系尚不清楚。本研究基于NF-κB信号通路探讨SynphiLin-1在PD发病机制中的作用,以期为PD防治药物的开发提供理论依据。
1 材料和方法
1.1实验材料
选择清洁级健康成年雄性Wistar大鼠36只,体质量200~220 g,购自青岛实验动物中心,饲养条件:室温(25±2)℃,自然光照,单笼喂养,自由饮食。6-羟基多巴胺(6-OHDA)(美国Sigma公司);兔抗大鼠NF-κB多克隆抗体(武汉博士德公司);一抗TH、SynphiLin-1(美国Chemicon公司);免疫组织化学SABC试剂盒购自武汉博士德公司。SynphiLin-1 siRNA反义链:5′-dTdTGCUGCUCUUGCC-UUUGUUA-3′,正义链:5′-CGACGAGAACGGAA-ACAAU-3′;阴性对照siRNA正义链:5′-AUAGUC-ACACAGGCAUGACdTdT-3′,反义链:3′-dTdUAU-CAGUGUGUCCGUACUG-5′,均由广州锐博生物工程有限公司合成。
1.2实验方法
1.2.1动物分组及模型的建立Wistar大鼠随机分为阳性对照组(A组)、PD组(B组)、siRNA组(C组)、siRNA对照组(D组),每组9只。大鼠腹腔注射100 g/L水合氯醛(30 mg/kg)麻醉后,固定于大鼠脑立体定位仪上,参照PAXINOS等[7]方法确定左侧黑质致密部(SNc)坐标:前囟后4.8 mm,矢状缝左侧1.7 mm,硬脑膜下7.5 mm。PD组:应用微量注射泵在大鼠左侧SNc注入6-OHDA 18 μg(溶于含2 g/L抗坏血酸生理盐水3 μL中),注射速度为0.5 μL/min,术毕留针10 min,随后连续2 d注入含2 g/L抗坏血酸生理盐水6 μL;siRNA组:大鼠左侧SNc连续2 d注入1 nmol(3 μL)SynphiLin-1 siRNA,第3天注入6-OHDA 3 μL;siRNA对照组:大鼠左侧SNc注入siRNA 3 μL,随后连续2 d注入2 g/L抗坏血酸生理盐水3 μL;阳性对照组:左侧SNc连续3 d注入2 g/L抗坏血酸生理盐水3 μL,局部消毒常规缝合切口。所有大鼠每日腹腔注射青霉素10万单位预防感染,在第10天时处死。
1.2.2免疫组织化学检测 用100 g/L水合氯醛麻醉大鼠并固定在木板上,用40 g/L多聚甲醛灌注液快速灌注固定、断头并分离出中脑,置于40 g/L多聚甲醛中固定4~6 h,石蜡包埋,4 μm厚切片,置于60 ℃烤箱中烘烤30 min,依次进行二甲苯脱蜡、封闭内源性过氧化物酶活性、抗原修复等步骤。加入1∶4 000的TH一抗(SynphiLin-1一抗1∶200,NF-κB一抗1∶200)于玻片上,阴性对照用PBS代替一抗。DAB显色,显微镜下适时终止显色,自来水冲洗,苏木精复染细胞核,梯度乙醇脱水、二甲苯透明、中性树胶封片。高倍镜(200倍)下随机取5个视野观察、摄片,采用德国KONTRONIBAS 2.0全自动图像分析系统,分别计数SynphiLin-1、TH、NF-κB阳性细胞数。
1.3统计学处理
应用SPSS 11.5软件进行统计学分析,组间比较采用单因素方差分析和SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1实验动物数量分析
纳入大鼠36只,造模过程中死亡3只,进入结果分析33只,其中阳性对照组9只,PD组8只,siRNA组8只,siRNA对照组8只。
2.2各组黑质区TH阳性细胞数量比较
阳性对照组黑质区可见大量的TH阳性神经元,且排列整齐,呈条带状;与阳性对照组比较,PD组TH阳性神经元数量减少54.5%;与PD组大鼠比较,siRNA组TH阳性神经元数量明显增加,差异有显著意义(F=12.4,P<0.05);siRNA对照组TH阳性神经元数量与PD组比较差异无显著意义(P>0.05)。见表1。
2.3各组黑质区SynphiLin-1和NF-κB阳性细胞数量比较
与阳性对照组比较,PD组黑质区SynphiLin-1和NF-κB阳性细胞数显著增加;与PD组大鼠比较,siRNA组黑质区SynphiLin-1和NF-κB阳性细胞显著减少,差异均有显著意义(F=14.8、8.6,P<0.05);siRNA对照组黑质区SynphiLin-1和NF-κB阳性细胞数与PD组相比较差异无统计学意义(P>0.05)。见表1。
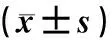
表1 各组黑质区TH、SynphiLin-1和NF-κB阳性细胞数比较
3 讨 论
PD是一种常见的中枢神经系统退行性疾病,主要病理改变是中脑黑质DA能神经元进行性变性缺失。近年研究显示,神经炎症所介导的神经毒性在PD的发生发展过程中起到非常重要的作用,是黑质多巴胺能神经元变性死亡的决定因素。诸多研究结果表明,抑制神经炎症具有神经保护效应[8]。因此,抗炎药物防治PD的研究日益受到人们的关注。NF-κB是一种具有多向转录调节作用的蛋白质,参与多种基因的转录调控、炎症反应、免疫应答以及细胞的增殖、转化和凋亡等重要的生理病理过程。NF-κB通过调控多种与凋亡相关基因的表达产生神经细胞损伤、炎症导致的氧化应激及依赖于细胞因子的毒性作用,可能会导致黑质纹状体通路变性,从而加速PD的进展。有研究结果显示,PD发生时存在小胶质细胞的活化、炎症因子的聚集、NF-κB通路的激活及氧化应激损伤等[9]。本研究采用6-OHDA立体定向毁损大鼠黑质-纹状体系统多巴胺能神经元制备偏侧PD模型,以黑质TH蛋白表达反映多巴胺能神经元的数量和功能状态。本文结果显示,与阳性对照组比较,PD组TH阳性细胞数显著减少,NF-κB阳性细胞数明显增加,提示6-OHDA可能激活炎性因子NF-κB,破坏多巴胺能神经元,进而参与PD的发病过程。既然NF-κB作为炎性因子参与PD的发病过程,那么研究NF-κB表达的调控影响因素,对探讨多巴胺神经元的保护作用机制有重要意义。
SynphiLin-1蛋白主要表达于脑组织中,表达量随着年龄的增加而增加[10]。研究表明,SynphiLin-1与α-synucLein相互作用能够明显促进包涵体的形成[11],在一些神经变性疾病神经细胞包涵体中都发现了SynphiLin-1蛋白的表达。也有研究结果显示,SynphiLin-1在中枢神经系统的沉积使SynphiLin-1转基因鼠表现出了运动损伤[12]。提示SynphiLin-1作为α-synucLein的伴侣蛋白之一,在PD发病中发挥重要作用。本研究应用SynphiLin-1 siRNA阻断SynphiLin-1基因的表达,探讨其对NF-κB表达的影响及黑质多巴胺能神经元的作用。结果显示,PD组与阳性对照组比较,NF-κB阳性细胞数明显增加,TH阳性细胞数明显减少,但siRNA组(即阻断SynphiLin-1基因表达组)与PD组比较,NF-κB阳性细胞数明显减少,TH阳性细胞数明显增加,表明阻断SynphiLin-1基因的表达能够逆转6-OHDA处理的大鼠黑质区NF-κB表达的上调和TH表达的下调,提示SynphiLin-1可能与NF-κB存在相互作用;阻断SynphiLin-1基因表达能够抑制NF-κB表达和活化,从而减低其介导的神经炎性反应,从而间接增强了大鼠黑质区多巴胺能神经元对神经毒性物质6-OHDA的抵御能力。
综上所述,NF-κB作为炎性因子参与PD的发病过程,SynphiLin-1可能与NF-κB相互作用,SynphiLin-1 siRNA的阻断效应抑制了NF-κB信号通路的激活,最终抑制NF-κB所调控的多种炎性因子的产生,从而发挥神经保护作用。但SynphiLin-1是通过何种机制影响NF-κB信号通路尚有待于进一步研究。
[1] KABIRAJ P, MARIN J E, VARELA-RAMIREZ A, et al. Ellagic acid mitigates SNO-PDI induced aggregation of Parkinsonian biomarkers[J]. ACS Chemical Neuroscience, 2014,5(12):1209-1220.
[2] HUMBERT J, BEYER K, CARRATO C, et al. Parkin and synphilin-1 isoform expression changes in Lewy body diseases[J]. Neurobiology of Disease, 2007,26(3):681-687.
[3] SMITH W W, LIU Z H, LIANG Y D, et al. Synphilin-1 attenuates neuronal degeneration in the A53T alpha-synuclein transgenic mouse model[J]. Human Molecular Genetics, 2010,19(11):2087-2098.
[4] 谢安木,薛莉,刘焯霖. SynphiLin-1 寡核苷酸对帕金森病酪氨酸羟化酶表达的影响[J]. 青岛大学医学院学报, 2007,43(3):199-201.
[5] HIRSCH E C, HUNOT S. Neuroinflammation in parkinson’s disease: a target for neuroprotection[J]? The Lancet Neurology, 2009,8(4):382-397.
[6] WANG S Y, LIU J P, JI W W, et al. Qifu-Yin attenuates AGEs-induced alzheimer-like pathophysiological changes through the RAGE/NF-κB pathway[J]. Chinese Journal of Natural Medicines, 2014,12(12):920-928.
[7] PAXINOS G, WATSON C. The rat brain in stereotatic coordinates[M]. 2nd ed. San Diego: Academic Press,1998:36.
[8] NADELLA R, VOUTILAINEN M H, SAARMA M, et al. Transient transfection of human CDNF gene reduces the 6-hydroxydopamine-induced neuroinflammation in the rat substantia nigra[J]. Journal of Neuroinflammation, 2014,11(1):209.
[9] TANSEY M G, GOLDBERG M S. Neuroinflammation in Parkinson’s disease: its role in neuronal death and implications for therapeutic intervention[J]. Neurobiology of Disease, 2010,37(3):510-518.
[10]GRUNBLATT T, MANDEL S, YOUDIMM B. MPTP and 6-hydroxydopamine-induced neurodegeneration as modeLs for Parkinson’s disease: neuroprotective strategies[J]. NeuroL, 2000,247 (Suppl 2): Ⅱ95.
[11]KRYGOWSKA-WAJS A, LENDA T, ADAMEK D, et al. Increased synphilin-1 expression in human elderly brains with substantia nigra Marinesco bodies[J]. Pharmacological Reports: PR, 2009,60(6):914-924.
[12]XIE Y Y, ZHOU C J, ZHOU Z R, et al. Interaction with synphilin-1 promotes inclusion formation of alpha-synuclein: mechanistic insights and pathological implication[J]. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2010,24(1):196-205.
(本文编辑 黄建乡)
THE EFFECT OF SYNPHILIN-1 SIRNA ON THE EXPRESSION OF NF-κB IN SUBSTANTIA NIGRA OF PARKINSON DISEASE RAT MODEL INDUCED BY 6-HYDROXYDOPAMINE
ZHANGYongjun,XUELi,WEIMei,XIEAnmu
(Department of Neurology, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
ObjectiveTo investigate the effect of SynphiLin-1 on expression of nuclear factor kappa B (NF-κB) in substantia nigra (SN) in rats induced by 6-Hydroxydopamine (6-OHDA) and explore SynphiLin-1 and NF-κB in the inflammatory pathogenesis of Parkinson’s disease (PD).MethodsThirty-sixWistarrats were equally randomized to four groups and injected into left substantia nigra (SN) with 6-OHDA, SynphiLin-1 siRNA, ascorbic plus normal saline and siRNA of rats in PD group, siRNA group, positive control group and siRNA control group, respectively. Immunohistochemical method was used to detect and compare the expressions of tyrosine hydroxylase (TH), SynphiLin-1 and NF-κB in the SN.ResultsCompared with the positive control group, the number of positive NF-κB and SynphiLin-1 cells in the PD group increased, and that of positive TH cells decreased; compared with PD group, the number of positive NF-κB and SynphiLin-1 cells in siRNA group decreased, and that of TH cells increased (F=8.6-14.8,P<0.05). No statistical difference was noted in the number of positive TH cells between siRNA group and positive control group (P>0.05).ConclusionSynphiLin-1 might be an important upstream regulatory protein in inflammatory reaction in substantia nigra of midbrain in rat induced by 6-OHDA, which interacts with NF-κB and involves in the pathogenesis of Parkinson’s disease and its process of neuritis.
SynphiLin-1; NF-kappa B; oxidopamine; Parkinson disease; tyrosine 3-monooxygenase
2015-04-29;
2015-08-18
山东省自然科学基金资助项目(ZR2012CM028)
张永军(1978-),男,硕士,主治医师。
谢安木(1966-),男,博士,主任医师,博士生导师。
R742.5
A
1008-0341(2015)06-0658-03
