饲喂黄曲霉毒素B1对奶山羊乳中黄曲霉毒素M1分泌规律与转化率的影响
2015-05-09王丽芳姚一萍连海飞张欣昕李秀萍内蒙古农牧业科学院资源环境与检测技术研究所呼和浩特010031
王丽芳 姚一萍 连海飞 张欣昕 李秀萍 曾 杰(内蒙古农牧业科学院资源环境与检测技术研究所,呼和浩特010031)
饲喂黄曲霉毒素B1对奶山羊乳中黄曲霉毒素M1分泌规律与转化率的影响
王丽芳 姚一萍 连海飞 张欣昕 李秀萍 曾 杰
(内蒙古农牧业科学院资源环境与检测技术研究所,呼和浩特010031)
摘 要:为研究饲粮中添加单一剂量黄曲霉毒素B1(AFB1)后奶山羊乳中黄曲霉毒素M1(AFM1)的分泌规律及AFB1转化为AFM1的转化率,选择3只健康、体重接近的泌乳中期关中奶山羊,每只羊饲喂1 mg AFB1。饲喂后0、4、8、24、32、48、56、72、80、96、104及120 h采集羊乳,测定AFM1含量。结果表明:1)饲喂AFB1前(0 h),羊乳中未检出AFM1,但是饲喂AFB1后4 h,在收集的羊乳中均检出了AFM1;2)3只试验在羊乳中AFM1含量存在差异,但是其分泌规律非常相似,均呈先升高后急剧下降再缓慢下降的趋势;3)羊乳中AFM1的峰值出现在饲喂AFB1后4~8 h;4)羊乳中AFM1平均含量在56 h时为0.39 μg/kg,低于我国限量值(0.5 μg/kg),到120 h平均含量为0.02 μg/kg,低于欧盟限量值(0.05 μg/kg);5)各时间点AFB1转化为AFM1的最大平均转化率为0.19%,出现在4 h;6)饲喂AFB1后24 h内的AFM1平均转化率之和占AFM1总转化率的81%。结果提示,AFM1在奶山羊乳中的排出时间主要集中在采食AFB1后的24 h内。
关键词:奶山羊;黄曲霉毒素B1;羊乳;黄曲霉毒素M1分泌规律;转化率
黄曲霉毒素B1(AFB1)是一种强致癌物质,被联合国癌症委员会确定为一类致癌物[1]。温暖潮湿气候的粮食和饲料[2]极易污染AFB1,尤其是谷物、棉籽和花生在收割前后均易污染AFB1[3]。动物摄入AFB1后,在肝脏中通过微粒体细胞色素P⁃450转化为黄曲霉毒素M1(AFM1),AFM1也是一种强致癌物,通过血液循环进入到乳中,危害食品安全。因此非常有必要研究饲料中AFB1通过动物机体代谢转化到乳中AFM1的分泌规律及转化率,为有效控制饲料中AFB1污染对乳品质量安全的影响提供基础数据。
为了减少人类和动物污染黄曲霉毒素,许多国家对奶畜饲料中AFB1和乳中AFM1均设置了最大限量值,然而这些限量值在不同国家之间变化范围比较大。对于饲料,欧盟奶畜全价饲料中AFB1限量值是5 μg/kg[4],美国动物饲料和奶畜饲料原料中黄曲霉毒素总和的限量值是20 μg/kg[5],我国奶畜精饲料中AFB1限量值是10 μg/kg。对于乳的限量,欧盟对于液态乳和乳产品等设置的限量值是0.05 μg/kg,婴幼儿用乳中是0.025 μg/kg,美国食品药品监督管理局(FDA)和我国的限量值均是0.5 μg/kg。
对于饲料中AFB1与乳中AFM1的相关性,已有一些学者进行了相关研究[6-10],然而这些研究主要是给奶畜饲喂一段时间自然霉变的饲料,探讨乳中AFM1的变化。实践中可能也会发生只饲喂1次AFB1污染的饲料导致乳中AFM1超过限量值[8],然而对动物只饲喂1次AFB1污染的饲料导致乳中AFM1变化的研究较少。因此,本试验通过给奶山羊饲喂一次性单一剂量的AFB1,研究乳中AFM1的分泌规律及转化率,旨在对实践中偶然发生AFB1污染进行准确风险分析。
1 材料与方法
1.1 试验动物和饲养管理
选择3只健康、体重在(35.00±2.65)kg的泌乳中期[泌乳天数(150±12)d]关中奶山羊,产奶量为(0.36±0.03)kg,胎次为2~3胎。试验羊单笼饲养,每天于08:00和16:00以先粗后精顺序分2次饲喂饲粮,饲粮的精粗比是50∶50,精饲料饲喂600 g/(d·只),苜蓿饲喂376 g/(d·只),青干草274 g/(d·只),自由饮水。试验之前,奶山羊每天挤奶2次,08:30和16:30。
1.2 基础饲粮
基础饲粮满足NRC(1981)奶山羊(体重为35 kg)的推荐量,并参照我国奶山羊饲养标准[11]配制。基础饲粮组成及营养水平见表1。
1.3 试验设计
根据Battacone等[8,12]的试验方法,本试验每只奶山羊饲喂1 mg AFB1,试验所用AFB1为粉末(纯度为99.9%),用甲醇溶解后添加到300 g精饲料中,用于08:00的饲喂,添加后精饲料中AFB1的含量为3 333.3 μg/kg。
在饲喂AFB1后0、4、8、24、32、48、56、72、80、96、104及120 h记录每只羊的产奶量并采集乳样,冷冻保存。
1.4 测定指标
1.4.1 羊乳中AFM1含量
羊乳中AFM1含量的检测方法参照GB 5413.37—2010,具体步骤如下。
1.4.1.1 试液提取
称取20.00 g(精确至0.01 g)混匀的乳样,置于50 mL具塞离心管中,在水浴中加热到35~37℃。在6 000 r/min下离心10 min。收集全部上清液,供净化用。
1.4.1.2 净化
①免疫亲和柱的准备。将一次性的50 mL注射器筒与亲和柱上顶部相串联,再将亲和柱与固相萃取装置连接起来。
②试样的纯化。将以上试液提取液移至50 mL注射器筒中,调节固相萃取装置的真空系统,控制试样以2~3 mL/min稳定的流速过柱。取下50 mL的注射器筒,装上10 mL注射器筒。注射器筒内加入水,以稳定的流速洗柱,然后,抽干亲和柱。脱开真空系统,在亲和柱下部放入10 mL刻度试管,上部装上另一个10 mL注射器筒,加入4 mL乙腈,洗脱AFM1,洗脱液收集在刻度试管中,洗脱时间不少于60 s。然后用氮气缓缓地在30℃下将洗脱液蒸发至近干(如果蒸发至干,会损失AFM1),用乙腈水溶液(10%)稀释至1 mL。

表1 基础饲粮组成及营养水平(风干基础)Table 1 Composition and nutrient levels of the basal diet(air⁃dry basis) %
1.4.1.3 检测条件
采用高效液相色谱(HPLC)串联质谱检测,仪器设备型号为waters UPLC/Quattro Premier⁃XE。
①HPLC条件。色谱柱:ACQUITY UPLC BEH⁃C18,1.7 μm,2.1 mm(内径)×100 mm;流动相:A液,0.1%甲酸溶液,B液,乙腈梯度洗脱;流动相流速:0.3mL/min。柱温:35℃;进样量:
5 μL;保留时间:3.42 min。

表2 高效液相色谱洗脱条件Table 2 The elution condition for HPLC %
②质谱条件。毛细管电压:2.5 kv;离子源温度:120℃;脱溶剂气流:氮气,600 L/h;脱溶剂气温度:450℃;碰撞室压力:3.0×10-4kPa;扫描方式:正离子模式(ESI+);检测方式:多反应监测(MRM);定量离子:328.88>258.94,碰撞能量:25 eV;定性离子:328.88>272.95,碰撞能量:25 eV。
1.4.2 羊乳中AFM1的转化率
AFM1各时间点转化率(%)=100×AFM1各时间点含量×各时间点产奶量/AFB1添加量;AFM1总转化率(%)=∑AFM1各时间点转化率。
1.5 数据统计分析
试验数据基本处理采用Excel 2007,数据统计分析采用SAS 9.0进行方差分析,平均值的多重比较采用Duncan氏法进行。
2 结果与分析
2.1 饲喂AFB1对各试验羊乳中AFM1分泌规律的影响
由图1可知,饲喂AFB1前,3只羊的乳中均未检出AFM1,但是在饲喂AFB1后4 h收集的羊乳中,3只羊均检出了AFM1。在1号和2号羊乳中,峰值出现在饲喂AFB1后的4 h,而在3号羊乳中,峰值出现在8 h。在峰值之后,所有羊乳中AFM1含量迅速下降,在120 h时,只有1号羊乳中未检出AFM1,2号和3号羊乳中仍有微量AFM1检出。虽然3只羊乳中AFM1分泌曲线相似,即呈先增加后下降趋势,但是单一曲线在上升过程中差异较大,2号和3号羊乳中AFM1上升幅度比1号羊大。

图1 饲喂AFB1后各试验羊乳中AFM1含量的分泌规律Fig.1 Excretion pattern of AFM1content in milk of experimental goats after fed AFB1
2.2 饲喂AFB1对羊乳中AFM1平均含量的分泌规律的影响
由图2可知,饲喂AFB1后,羊乳中AFM1的平均含量呈现先增加后下降的趋势,在4 h时达到峰值9.89 μg/kg,接近我国限量值0.5 μg/kg的20倍;在峰值之后,羊乳中AFM1平均含量减少比较快,在56 h时含量为0.39 μg/kg,低于我国限量值,到120 h为0.02 μg/kg,低于欧盟限量值0.05 μg/kg;在4和8 h时,AFM1平均含量显著高于以后其他各时间点(P<0.05),24 h时AFM1的平均含量显著高于56 h及以后其他各时间点(P<0.05),32 h及以后各时间点之间AFM1平均含量差异不显著(P>0.05)。

图2 饲喂AFB1后试验羊乳中AFM1平均含量的分泌规律Fig.2 Excretion pattern of AFM1average content in milk of experimental goats fed AFB1
2.3 饲喂AFB1对羊乳中AFM1平均转化率的影响
由图3可知,随着取样时间的延长,AFB1转化为AFM1的平均转化率逐渐降低,到80 h时为0。其中AFB1转化为AFM1的总转化率为0.53%;饲喂AFB1后4 h时转化率最高为0.19%,8和24 h次之,这3个时间点平均转化率的和为0.43%。
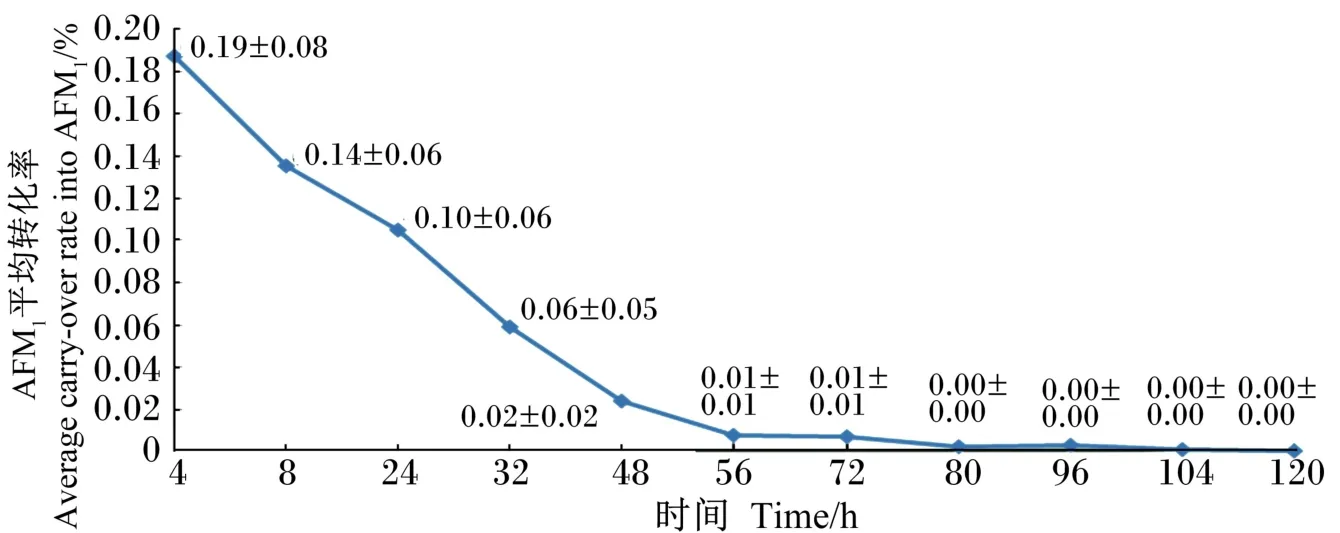
图3 饲料中AFB1转化为羊乳中AFM1的平均转化率的变化Fig.3 The change of average carry⁃over rate of AFB1into AFM1in milk of goats
3 讨 论
3.1 饲喂AFB1后对试验羊乳中AFM1含量的分泌规律的影响
Battacone等[12]报道,给5只奶山羊饲喂单一剂量AFB1后,羊乳中AFM1在上升过程中变化比较大,但5只羊乳中AFM1分泌曲线却相似,这与本试验结果相似。Battacone等[12]给奶山羊饲喂0.8 mg AFB1,在饲喂后3 h时采集乳样检出了AFM1;Gallo等[13]给奶牛饲喂4.9 mg的AFB1,饲喂5 min后采血检出了AFM1;Cook等[14]给肉牛饲喂0.2~0.8 mg/kg BW的混合黄曲霉毒素(AFB1为75%),饲喂后30 min在血液中检出了AFM1,这些结果与本试验结果相似,表明AFB1在成年反刍动物的胃肠道吸收非常快,并且它的羟基化合物AFM1也很快分泌到乳中。
Battacone等[12]报道,给奶山羊饲喂单一剂量AFB1后,羊乳中AFM1的峰值在饲喂后3和6 h达到,为0.6~1.8 μg/kg,这一结果不同于本试验结果4和8 h(5.32~13.47 μg/kg),本试验AFM1峰值含量是Battacone等[12]试验结果的7.5~8.9倍。可能的原因有AFB1不同的喂量、奶山羊的品种、产奶量及体重等。本试验AFB1的喂量是1 mg,奶山羊为关中奶山羊,平均产奶量是0.36 kg,平均体重是35 kg,而Battacone等[12]饲喂的量是0.8 mg,奶山羊为萨能奶山羊,平均产奶量是3.35 kg,平均体重是59 kg,但不同饲粮也可能是导致2个试验峰值AFM1含量不同的原因,本试验饲喂的饲粮是精饲料、青干草与苜蓿,而Battac⁃one等[12]饲喂的只是精饲料和干草,不含苜蓿,因此不同饲粮影响AFB1在瘤胃中的降解不同,导致羊乳中AFM1含量也不同。
3.2 饲喂AFB1对羊乳中AFM1平均含量分泌规律的影响
Battacone等[12]报道,给奶山羊饲喂AFB1后,羊乳中AFM1含量在3和6 h极显著高于其他时间点,与本试验结果AFM1平均含量在4和8 h显著高于其他各时间点相似。
Battacone等[9]报道,给奶山羊连续7 d饲喂AFB1[128 μg/(d·只)],羊乳中AFM1的含量在2~7 d达到一个稳定值,停止饲喂AFB1后,羊乳中AFM1含量迅速下降,在停止饲喂4 d后,羊乳中检测不到AFM1;Battacone等[12]报道,给奶山羊饲喂1次AFB1(0.8 mg),84 h时检测不到羊乳中AFM1;本试验饲喂1次AFB1(1 mg),在饲喂后第5天早晨(120 h)所采集的羊乳中有微量AFM1被检出(0.02 μg/kg),不同于Battacone等[9,12]的试验结果,可能是AFB1饲喂量、饲粮及产奶量不同所致。
Battacone等[12]报道,在饲喂AFB1后36 h收集的羊乳中,AFM1含量低于欧盟限量值0.05 μg/kg;本试验结果表明,120 h羊乳中AFM1含量低于欧盟限量值。
3.3 饲喂AFB1对羊乳中AFM1平均转化率的影响
本试验饲喂AFB1后4、8和24 h 3个时间点AFM1平均转化率之和为0.43%,占AFM1总转化率的81%,暗示了AFB1转化为AFM1主要在AFB1饲喂后的开始时间,即24 h内。Battacone等[8,12]报道AFB1转化为AFM1的总转化率为0.032%~0.170%,Helferich等[15]报道AFB1转化为AFM1的总转化率为0.18%~0.38%,Nageswara等[16]报道AFB1转化为AFM1的总转化率为0.40%,而本试验结果表明,AFB1转化为AFM1的总转化率为0.53%,均高于上述研究结果,可能是AFB1的饲喂量、不同的饲粮及奶山羊产奶量不同所致。
4 结 论
①饲喂AFB1前,羊乳中未检出AFM1,但是饲喂AFB1后4~8 h,羊乳中AFM1含量达到峰值,在峰值之后AFM1含量减少比较快。
②各时间点AFB1转化为AFM1的最大平均转化率为0.19%,出现在4 h;饲喂AFB1后24 h内的AFM1平均转化率之和占AFM1总转化率的81%。
参考文献:
[1] IARC.Some naturally occurring substances:food items and constituents,heterocyclic aromatic amines and mycotoxins[M].Lyon:World Health Organization,1993.
[2] COTTY P J,JAIME⁃GARCIA R.Influences of climate on aflatoxin producing fungi and aflatoxin contamina⁃tion[J].Food Microbiol,2007,119:109-115.
[3] RICHARD J L.Some major mycotoxins and their my⁃cotoxicoses⁃an overview[J].Food Microbiol,2007,119:3-10.
[4] Commission of The European Communities.European Commission Directive 2003/100/EC of 31 october 2003 amending annexⅠto directive 2002/32/EC of the European Parliament and of the Council on unde⁃sirable substances in animal feed[J].European Journal of Communication,2003,285:33-37.
[5] U.S.FDA.CPG Sec.683.100 action levels for aflatox⁃ins in animal feeds[EB/OL].[2015-03-20]http://www.fda.gov/ICECI/ComplianceManuals/Complian⁃cePolicyGuidanceManual/ucm074703.htm.
[6] SMITH E E,PHILLIPS T D,ELLIS J A,et al.Dietary hydrated sodium calcium aluminosilicate reduction of aflatoxin M1 residue in dairy goat milk and effects on milk production and components[J].Journal of Exper⁃imental Animal Science,1994,72:677-682.
[7] VELDMAN A,MEIJS J A C,BORGGREVE G J,et al.Carryover of aflatoxin from cows’food to milk [J].Animal Production Science,1992,55:163-168.
[8] BATTACONE G,NUDDA A,CANNAS A,et al.Ex⁃cretion of aflatoxin M1 in milk of dairy ewes treated with different doses of aflatoxin B1[J].Journal of Dairy Science,2003,86:2667-2675.
[9] BATTACONE G,NUDDA A,PALOMBA M,et al.Transfer of aflatoxin B1 from feed to milk and from milk to curd and whey in dairy sheep fed artificially contaminated concentrates[J].Journal of Dairy Sci⁃ence,2005,88:3063-3069.
[10] BATTACONE G,NUDDA A,PALOMBA M,et al.The transfer of aflatoxin M1 in milk of ewes fed diet naturally contaminated by aflatoxins and effect of in⁃clusion of dried yeast culture in the diet[J].Journal of Dairy Science,2009,92:4997-5004.
[11] 金公亮.奶山羊饲养标准[J].畜牧兽医杂志,1989,8
(2):7-12.
[12] BATTACONE G,NUDDA A,RASSU S P G,et al.Excretion pattern of aflatoxin M1 in milk of goats fed a single dose of aflatoxin B1[J].Journal of Dairy Sci⁃ence,2012,95:2656-2661.
[13] GALLO A,MOSCHINI M,MASOERO F.Aflatoxins absorption in the gastro⁃intestinal tract and in the vagi⁃nal mucosa in lactating dairy cows[J].Animal.Sci⁃ence,2008,7:53-63.
[14] COOK W O,RICHARD J L,OSWEILER G D,et al.Clinical and pathological changes in acute bovine afla⁃toxicoses:rumen motility and tissue and fluid concen⁃trations of aflatoxin B1 and M1[J].American Journal of Veterinary Research,1986,47:1817-1825.
[15] HELFERICH W G,BALDWIN R L,HSIEH D P.[14C]⁃aflatoxin B1 metabolism in lactating goats and rats[J].Animal.Science,1986,62:697-705.
[16] NAGESWARA RAO S B,CHOPRA R C.Influence of sodium bentonite and activated charcoal on aflatoxin M1 excretion in milk of goats[J].Small Ruminant Re⁃search,2001,41:203-213.
Author,WANG Lifang,associate professor,E⁃mail:wanglifang100008@163.com
(责任编辑 王智航)
Excretion Pattern and Carry⁃Over Rate of Aflatoxin M1in Milk of Dairy Goats after Fed Aflatoxin B1
WANG Lifang YAO Yiping LIAN Haifei ZHANG Xinxin LI Xiuping ZENG Jie
(Institute of Resources Enviroment and Detection Technology,Inner Mongolia Academy of Agriculture and animal husbandry Sciences,Hohhot 010031,China)
Abstract:The aim of this study was to determine the excretion patterns and carry⁃over rate of aflatoxin M1(AFM1)in milk of dairy goats fed a single dose of aflatoxin B1(AFB1).Three healthy Guanzhong dairy goats in mid⁃lactation with similar body weight were administered 1 mg of AFB1.Milk samples were collected after 0,4,8,24,32,48,56,72,80,96,104 and 120 h of AFB1administration to determine AFM1content.The results showed as follows:1)AFM1was not detected in milk before AFB1administration(0 h),but was detected in the first milking following AFB1administration(4 h);2)the excretion pattern of AFM1content in milk was very similar in all the experimental goats even if the values differed among animals;3)The peak val⁃ue for AFM1content in milk was observed in milk collected at 4 and 8 h after AFB1administration;4)AFM1average content in milk was 0.39 μg/kg at 56 h and 0.02 μg/kg at 120 h,which moved below the Chinese limit(0.5 μg/kg)and the European Union limit(0.05 μg/kg),respectively;5)the maximum value of aver⁃age carry⁃over rate of AFB1into AFM1in milk was 0.19%which appeared at 4 h;6)the sum of average car⁃ry⁃over rate at different time point in 24 h was 81%of total average carry⁃over rate after AFB1administration.In conclusion,AFM1is mostly excreted in milk of dairy goats in 24 h after AFB1administration.[Chinese Journal of Animal Nutrition,2015,27(6):1915⁃1920]
Key words:dairy goat;AFB1;goat milk;AFM1excretion pattern;carry⁃over rate
作者简介:王丽芳(1975—),女,内蒙古托县人,副研究员,博士,研究方向为生鲜乳质量安全研究。E⁃mail:wanglifang100008@163.com
基金项目:国家农产品质量安全风险评估重大专项(GJFP2014008);内蒙古农牧业科学院创新基金项目;内蒙古自治区人才开发基金项目
收稿日期:2015-01-29
doi:10.3969/j.issn.1006⁃267x.2015.06.030
中图分类号:S826
文献标识码:A
文章编号:1006⁃267X(2015)06⁃1915⁃06
