填充床反应器固定化菊糖果糖转移酶催化合成双果糖酐Ⅲ的研究
2015-05-08鲍士宝周守标
杭 华,鲍士宝,王 波,周守标,江 波
(1.安徽师范大学环境科学与工程学院,安徽芜湖 241003;2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
填充床反应器固定化菊糖果糖转移酶催化合成双果糖酐Ⅲ的研究
杭 华1,鲍士宝1,王 波1,周守标1,江 波2
(1.安徽师范大学环境科学与工程学院,安徽芜湖 241003;2.江南大学食品科学与技术国家重点实验室,江苏无锡 214122)
本文建立了填充床反应器固定化菊糖果糖转移酶水解菊糖的工艺。以菊糖为底物,探究该工艺水解菊糖的条件,以单因素实验为基础,依据正交实验优化,考察菊糖浓度、反应时间、反应温度及底物流速等因素对双果糖酐Ⅲ含量的影响,获得最佳的工艺条件。该工艺采用填充床反应器的容积为20mL,固定化酶的装载量为15mL。结果表明:菊糖浓度为100g/L,反应时间为1h,温度为60℃,底物流速为20mL/h,在该工艺条件下制取双果糖酐Ⅲ的浓度为67.38g/L。该工艺能持续操作48d以上,半衰期为48d,为该工艺大规模生产提供理论与操作的基础。
双果糖酐Ⅲ,固定化菊糖果糖转移酶,正交实验,稳定性
菊糖果糖转移酶(EC4.2.2.18,Inulin fructotransferase,缩写为IFTase)能水解菊糖生成双果糖酐Ⅲ(即DFA Ⅲ)。DFA Ⅲ是低甜度与低热量的新型甜味剂,其生理功能具有增进骨骼的钙吸收、利于排尿、提高矿物质和黄酮类化合物的吸收、预防结肠癌及抑制蛀牙等,因而其能广泛地应用于食品和医药领域[1]。DFA Ⅲ利用微生物产菊糖果糖转移酶催化水解菊糖来制备,已发现10余种微生物(主要为节杆菌属)可以产生此酶[2]。DFA Ⅲ主要是采用IFTase酶直接水解菊糖进行制备,利用微生物产IFTase酶水解菊糖。IFTase游离酶水解制取DFA Ⅲ的问题是耗时且劳动强度大,参与反应的催化剂酶无法重复利用而造成浪费,产物的产率低,反应结束后需要高温或调pH来使酶失活,能量消耗大等不利方面。固定化酶具有重复利用、易回收及生产成本低等优点,应用较为广泛。目前,采用固定化酶的方法制备双果糖酐Ⅲ的报道较少,Kazutomo Haraguchi[3]等报道Chitopearl BCW3510结合戊二醛固定化IFTase酶,重复利用8次酶活力损失少;Ulrich Jahnz[4]等报道利用海藻酸盐结合壳聚糖与戊二醛包埋IFTase表达酶具有较好的耐热性,其适合于重复利用。海藻酸盐包埋固定化酶已经应用于塔格糖制备[5]、氯仿降解[6]、低聚果糖的工业化制取[7]等。采用填充床反应器固定化菊糖果糖转移酶催化制取DFA Ⅲ,其反应条件温和、固定化酶反复利用及利于产物制备。本研究以菊糖为底物,进行单因素实验;在此基础上,采用正交实验优化对填充床反应器固定化菊糖果糖转移酶催化水解菊糖的因素进行探究,获得最佳的操作工艺
1 材料与方法
1.1 材料与仪器
金黄节杆菌 江南大学国家重点实验室;菊糖 上海谱振生物科技有限公司;双果糖酐Ⅲ 日本大阪光纯化学工业公司;海藻酸钠、明胶及其他试剂 均为分析纯,中国国药集团化学试剂有限公司。
恒温水浴锅 上海一恒科学仪器有限公司;冷冻离心机、电子天平 上海精密仪器有限公司;高效液相色谱 日本岛津公司。
1.2 实验方法
1.2.1 菊糖果糖转移酶 菊糖果糖转移酶来源于金黄节杆菌,将金黄节杆菌的发酵液离心,除去菌体,保留上清液即为粗酶液。采用超滤方法除去上清液中的小分子杂质,浓缩液即为简易纯化酶,低温保藏用于固定化酶。
1.2.2 酶的固定化 将海藻酸钠和明胶分别在60℃预先保温溶解,3mL IFTase酶液(酶活约为300U/mL)与6mL海藻酸钠溶液充分混合搅拌,再加入3mL明胶溶液,混合乳化30~40min(50℃)。用注射器混合液滴入氯化钙液中,形成均一光滑的颗粒,0~4℃条件下静置硬化4~6h。将获得颗粒用生理盐水和去离子水洗涤,抽滤干燥即得固定化酶,颗粒状固定化酶的直径约5mm,机械强度较好,酶的比活力为68.4U/g(酶活/固定化酶湿重),保存于0~4℃条件下待用。
1.2.3 固定化酶反应器水解菊糖的持续操作 持续的固定化酶填充床反应器包括:双层玻璃柱和固定化菊糖果糖转移酶。持续反应器系统的示意图,见图1。通过循环水浴加热,填充床反应器维持适宜的反应温度。从反应器底部通入一定流速的底物,便于反应器操作,尽可能减少固定化酶自身挤压而导致堵塞问题。

图1 填充床反应器固定化酶持续水解菊糖的示意图Fig.1 The diagram of bed reactor with immobilized enzyme for continuous inulin hydrolysis
1.2.3.1 单因素实验 按照1.2.2酶的固定化方法,制取固定化菊糖果糖转移酶,将其装入流化床反应器。探究影响固定化酶填充床反应器催化水解菊糖的因素:菊糖浓度(m/V)为20~120g/L,流速为5~30mL/h,温度为30~90℃,反应时间为0~1.5h。反应产物主要有DFA Ⅲ与较少量低聚果糖等。样品收集分析之前,依据每个流速达到稳定态的保留时间,反应器平衡2~10h。采用HPLC检测,研究酶催化水解菊糖生成DFA Ⅲ含量。
1.2.3.2 正交实验 在上述反应因素的实验基础上,选择菊糖浓度(A)、反应时间(B)、反应温度(C)与底物流速(D)4个因素为自变量,设计了一个4因素3个水平的正交实验,各因素依据表1,设定主要考察指标为DFA Ⅲ含量(Y),分析研究影响填充床固定化菊糖果糖转移酶催化制备DFA Ⅲ含量的主要因素。

表1 正交实验分析因素与水平
1.2.4 高效液相色谱分析方法 样品采集:依据1.2.3收集到样品,20g/L菊糖浓度的产物不需要稀释,其他浓度菊糖产物按照菊糖浓度与20g/L菊糖浓度的比例进行稀释。采集的样品过0.22μm纤维素膜后取10μL进HPLC(高效液相色谱)分析。
1.2.5 高效液相色谱分析条件 HPLC检测条件:糖柱(Waters Sugur-PakTM1,6.5×300mm);流动相,超纯水;示差折光检测器(Shodex RI101);柱温,80℃;流速,0.4mL/min;进样量,10μL。
1.2.6 实验数据处理 本文中,实验均进行三次操作,统计数值并计算平均值,平均值表示实验数值,误差棒表示实验重复数值的误差。应用Origin 7.5软件(美国OriginLab 中国分公司,中国广州)来统计分析。
2 结果与讨论
2.1 菊糖水解产物的HPLC图谱
依据1.2.4的HPLC分析方法,IFTase催化水解菊糖的产物为DFA Ⅲ以及少量的低聚果糖,见图2。由图可以看出,未反应菊糖出峰时间为6.394min,低聚果糖(蔗果四糖、蔗果三糖、蔗果二塘)的出峰时间分别为7.197、7.643及8.372min,DFA Ⅲ出峰时间为9.748min。菊糖转化率(生成DFA Ⅲ)能达到80%。
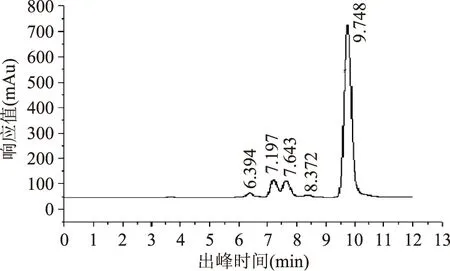
图2 菊糖水解产物的HPLC图谱Fig.2 HPLC scheme of inulin hydrolysis products
2.2 反应因素的确定
2.2.1 菊糖浓度的影响 依据1.2.3.1方法,在反应温度为60℃、反应时间为1h与底物流速为20mL/h的条件下,研究DFA Ⅲ得率与菊糖浓度的关系,见图3。由图3可知,底物菊糖浓度由20~80g/L,DFA Ⅲ含量变化不大;当菊糖浓度大于80g/L时,DFA Ⅲ含量降低较为显著。菊糖浓度为20、40、60、80、100、120g/L时,DFA Ⅲ含量分别为16.7、32.8、48.9、64.6、78.4、90.2g/L。随着菊糖浓度的升高,DFA Ⅲ含量也逐渐提高,反应进程符合酶反应方程动力学,底物浓度的增加会促使反应向产物浓度增加的方向进行。然而,随着底物浓度的持续升高,因高浓度底物对酶具有竞争性抑制作用,菊糖转化效率(即酶的催化效率)降低。综合考虑上述影响因素,选择菊糖的浓度为80g/L。

图3 菊糖浓度与DFA Ⅲ得率的关系Fig.3 Relations of inulin concentration and DFA Ⅲ yield
2.2.2 反应时间的影响 依据1.2.3.1方法,在反应温度为60℃、底物浓度为80g/L与底物流速为20mL/h的条件下,研究反应时间对酶催化水解反应的影响,结果见图4。从图4可以看出,随着反应时间的增加,DFA Ⅲ浓度也逐步提高;反应时间为60min(即1h)时,DFA Ⅲ含量基本保持不变,反应达到平衡。随着反应时间的延长,DFA Ⅲ浓度增加趋于平衡,考虑到反应成本、时间及DFA Ⅲ含量等因素,选择反应时间为1h。

图4 反应时间与DFA Ⅲ含量的关系Fig.4 Relations of reaction time and DFA Ⅲ content
2.2.3 温度的影响 依据1.2.3.1方法,在反应时间为1h、底物浓度为80g/L与底物流速为20mL/h的条件下,研究反应温度对酶催化水解反应的影响,结果见图5。从图5可以看出,随着反应温度的升高,DFA Ⅲ含量也逐步提高;当温度为60℃时,DFA Ⅲ含量达到平衡;温度继续升高,DFA Ⅲ含量增加缓慢;温度过高,DFA Ⅲ含量出现下降趋势,表明温度是影响酶催化水解的主要因素之一。考虑持续实验中酶活力下降及温度等的影响,依据酶的耐受温度范围及升高温度增加酶催化水解效率,选择反应温度为60℃。
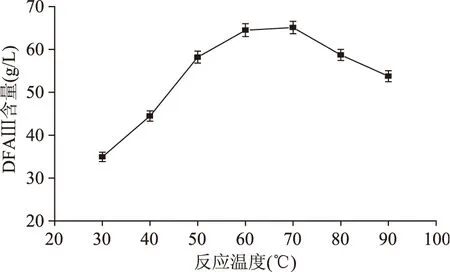
图5 反应温度与DFA Ⅲ含量的关系Fig.5 Relations of reaction temperature and DFA Ⅲ content
2.2.4 底物流速的影响 依据1.2.3.1方法,在反应时间为1h、反应温度为60℃与底物浓度为80g/L的条件下,研究底物流速对酶催化水解反应的影响,结果见图6。从图6可以看出,当底物流速为5~20mL/h时,随着底物流速的增加,DFA Ⅲ含量呈现缓慢下降的趋势;当流速大于20mL/h时,DFA Ⅲ含量下降加快,说明流速过快,底物与酶反应不完全,酶的催化水解效率降低。底物流速适当地增加,能提高单位时间内产物的含量;因此,选择底物流速为20mL/h。
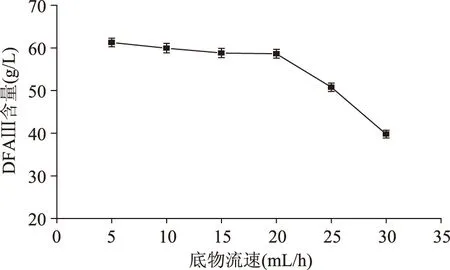
图6 底物流速与DFA Ⅲ含量的关系Fig.6 Relations of substrate velocity and DFA Ⅲ content
2.3 DFA Ⅲ制备条件的正交优化
2.3.1 正交实验 正交实验结果见表2所示,影响酶活的因素依次为B>D>A>C;获取DFA Ⅲ含量最高的组合为A3B2C2D1,通过优化结果进行实验,获得DFA Ⅲ含量为68.62g/L。根据单因素实验的结果,底物流速的提高可以增加单位时间内产物量,这对于实际应用具有重要意义,采用A3B2C2D2进行实验,获得DFA Ⅲ含量为67.38g/L。因此,确定流化床反应器固定化酶水解菊糖的操作条件为:菊糖浓度为100g/L,反应时间为1h,反应温度为60℃及底物流速为20mL/h。

表2 流化床反应器固定化酶操作条件的正交实验
2.3.2 填充床反应器的操作稳定性 在上述研究的基础上,探究填充床反应器的操作稳定性。操作的优化条件:菊糖浓度为100g/L,反应温度为60℃,底物流速为20mL/h。利用HPLC检测并计算菊糖水解液中DFA Ⅲ的含量与相对酶活的变化。由图7可知,持续操作3d,获得DFA Ⅲ的含量为67.38g/L且几乎维持不变;持续操作8d,获得DFA Ⅲ的含量为62.57g/L;持续操作40d,获得DFA Ⅲ的含量为41.32g/L,反应器持续操作48d后,获得获得DFA Ⅲ的含量为34.21g/L。由图8可以看出,首次用于催化水解菊糖的固定化酶相对酶活为100%,随着操作时间的增加,相对酶活逐渐降低;反应器持续操作48d,相对酶活降低至50%。综上所述,填充床反应器持续操作的半衰期为48d。

图7 操作时间与DFA Ⅲ含量的关系Fig.7 Relations of operation time and DFA Ⅲ content
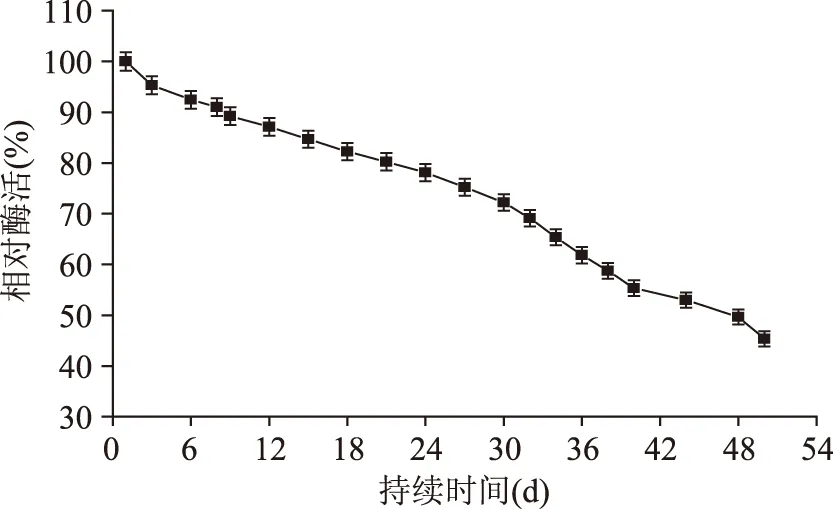
图8 相对酶活与操作时间的关系Fig.8 Relations of operational time and relative enzyme activity
3 结论
本文建立了填充床反应器固定化菊糖果糖转移酶持续水解菊糖制取DFA Ⅲ的操作系统,该系统的容积为20mL,固定化酶的装载量为15mL。探讨了该系统进行菊糖浓度、反应时间、反应温度、底物流速等单因素实验;在此基础上,应用正交实验软件分析菊糖浓度、反应时间、反应温度、底物流速等因素对制取DFA Ⅲ的影响,优化确定填充床反应器固定化菊糖果糖转移酶催化水解菊糖的最适工艺条件:菊糖浓度为100g/L,反应时间为1h,反应温度为60℃,底物流速为20mL/h。该操作系统的持续进行48d,DFA Ⅲ的含量由62.57g/L减少至34.21g/L,相对酶活降低至初始固定化相对酶活的一半,该操作系统的半衰期为48d。
[1]赵萌,沐万孟,张涛,等. 新型食品添加剂双果糖酐Ⅲ的研究发展[J]. 食品与发酵工业,2008,34(8):123-126.
[2]Hang H,Mu W,Jiang B,et al. Recent advances on biological difructose anhydride Ⅲ production using inulase II from inulin[J]. Applied Microbiology and Biotechnology,2011,92:457-465.
[3]Haraguchi K,Ohtsobo K. Production and immobilization of thermostable oligosaccharide DFA Ⅲ producing enzyme fromArthrobactersp. L68-1[J]. National Food Res Inst,2004,68:19-24.
[4]Jahnz U,Schubert M,Baars-Hibbe H,et al. Process for producing the potential food ingredient DFA Ⅲ from inulin:screening,genetic engineering,fermentation and immobilization of inulase II[J]. Intern J Pharm,2003,256:199-206.
[5]Aleksandra M,Natasa B,Zoran V. Cell wall invertase immobilization within calcium alginate beads[J]. Food Chemistry,2007,104:81-86.
[6]Kaushik D,Pranab R. Degradation of chloroform by immobilized cells ofBacillussp. In calcium alginate beads[J]. Biotechnology Letter,2011,33(6):1101-1106.
[7]Jung KH,Bang SH,Oh TK,et al. Industrial production of fructooligosaccharides by immobilized cells of Aureobasidium pullulans in a packed bed reactor[J]. Biotechnology Letter,2011,33(8):1621-1624.
Study on the process of bed reactor with immobilized inulin fructotransferase for catalytic synthesis of DFA Ⅲ
HANG Hua1,BAO Shi-bao1,WANG Bo1,ZHOU Shou-biao1,JIANG Bo2
(1.College of Environmental Science and Engineering,Anhui Normal University,Wuhu 241003,China;2.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
The process of bed reactor with immobilized inulin fructotransferase for inulin hydrolysis was founded. The conditions of inulin hydrolysis were explored. Based on single factors experiments,orthogonal experiment was adopted to investigate the influences of inulin concentration,reaction time,reaction temperature and substrate velocity on DFA Ⅲ contents. The optimal conditions were obtained. This process was adopted with the volume of packed bed reactor for 20mL and loading amount of immobilized enzyme for 15mL. The best results were attained with inulin concentration 100g/L,reaction time 1h,reaction temperature 60℃ and substrate velocity 20mL/h. DFA Ⅲ concentration was 67.38g/L at the conditions of this process. The process could continue to operate over 48 days. The half-life of operation was 48 days. The foundation was provided for the theory and operation of mass production.
difructose anhydride Ⅲ;immobilized inulin fructotransferase;orthogonal experiment;stability
2014-06-25
杭华(1977-),男,博士,讲师,研究方向:食品生物新技术。
2013年校项目培育基金项目(160-71361);安徽师范大学12博士科研启动项目(161-070110)。
TS201.4
A
1002-0306(2015)07-0192-04
10.13386/j.issn1002-0306.2015.07.032
