苏尼特羊钙蛋白酶抑制蛋白基因表达规律及其与肉质的相关性研究
2015-05-08郭月英程海星刘树军
郭月英,程海星,王 乐,刘树军,张 静,任 霆,靳 烨,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018;2.乌拉特中旗农区畜牧业专项推进办公室,内蒙古巴彦淖尔市 015300)
苏尼特羊钙蛋白酶抑制蛋白基因表达规律及其与肉质的相关性研究
郭月英1,程海星1,王 乐1,刘树军2,张 静1,任 霆1,靳 烨1,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018;2.乌拉特中旗农区畜牧业专项推进办公室,内蒙古巴彦淖尔市 015300)
选取40只苏尼特羊为研究对象,采用相对定量PCR技术对不同月龄苏尼特羊背最长肌、臂三头肌、股二头肌中CAST基因的表达规律与肉质相关性进行研究,分析基因表达量与肉质指标的关联。结果表明:CAST在三个实验部位中的表达规律相同,5、6、8月龄有不同程度的增高,12月龄降到最低。4个月龄中,CAST基因的表达量为臂三头肌(Q)>股二头肌(H)>背最长肌(B)。5月龄时股二头肌(H)和背最长肌(B)表达量基本相同,8月龄时,臂三头肌(Q)和股二头肌(H)表达量基本相同。在8、12月龄时,臂三头肌(Q)中CAST基因的表达量显著高于背最长肌(B)。在背最长肌中,CAST基因表达量与剪切力(r=-0.449)、黄度值(r=-0.753)、pH2(r=-0.245)呈负相关;与红度值呈显著负相关(r=-0.950,p=0.050);与亮度值(r=0.171)、pH1(r=0.387)呈正相关;在股二头肌中,CAST基因表达量与剪切力(r=0.520)、黄度值(r=0.846)呈正相关;与红度值(r=-0.091)、亮度值(r=-0.193)、pH1(r=-0.446)、pH2(r=-0.446)呈负相关。在臂三头肌中,CAST基因表达量与剪切力(r=0.333)呈正相关;与红度值(r=-0.494)、黄度值(r=-0.465)、亮度值(r=-0.317)、pH1(r=-0.814)、pH2(r=-0.629)呈负相关。
苏尼特羊,钙蛋白酶抑制蛋白基因,相对定量PCR,表达规律,肉质
苏尼特羊因其具有耐粗饲、耐寒、体格健壮,骨骼结实、采食能力强、生长发育快、宜于牧养、成活率高,生命力强、瘦肉率高、肉质鲜嫩等优点,而成为适应荒漠半荒漠草原环境的地方良种之一[1-2]。肉质是一个综合性状,受到多种因素的影响,从本质上讲,对肉质起决定作用的主要是肌肉本身的组织结构和化学组成。肉质性状的形成是基因和环境相互作用的产物。研究表明,遗传因素即基因对肉质起着关键作用[3-4]。目前,评定肉质的主要指标一般包括嫩度、肉色、风味、保水性、肌内脂肪含量、pH等。
钙蛋白酶抑制蛋白(Calpastatin,CAST)普遍存在于哺乳动物的组织中,是钙蛋白酶的内源性抑制蛋白,由CAST基因编码。CAST基因在肌肉的形成、降解及宰后的嫩化过程中起关键作用[5],是家畜胴体瘦肉率和嫩度的候选基因。国内外已经有一些CAST基因多态与肉质相关性研究的报道,Ciobanu等[6]在猪的CAST基因研究中发现了一个新的等位基因的单倍型,该单倍型具有更好的嫩度和多汁性。杨又兵[7]发现猪的CAST基因的不同酶切多态位点对眼肌面积、个体高度、肌内脂肪、肌内水分等性状有显著影响。张璐等[8]研究得出猪CAST基因的不同基因型的背膘厚存在差异。吴旧生[9]发现金皮猪CAST基因的HinfⅠ多态性对肌纤维的轴比、结缔组织含量有著影响。在牛的研究中也有类似报道,Allais等[10]对法国三个品种牛的研究中发现,CAST基因的不同基因型与牛肉的风味和剪切力存在相关性。王建华[11]对牦牛CAST基因多态性与肉质进行了研究,得出CAST基因的不同基因型分别与牦牛肌肉的剪切力、脂肪含量、失水率、含水量密切相关。金鑫[12]对延边黄牛的肉质性状相关基因的研究中发现,CAST基因的突变位点E1-1、E1-2、C3-1与嫩度和多种脂肪酸含量显著相关,E4-2与蒸煮损失和肉色显著相关。同时,部分学者还对CAST基因表达量与肉质的相关性进行了研究,赵伯阳[13]发现山羊CASTⅡ基因的表达量随着年龄的增长而增加,3岁时的表达量最高;在鸡的研究中发现CAST基因在胸肌中表达量总体呈下降趋势[14]。
苏尼特羊是我国优良的地方品种,经过长期自然和人工选择,其体内蕴藏着丰富的基因资源,而目前对苏尼特羊生长期CAST基因的表达量与肉质的相关性研究尚属空白,因此,本文对苏尼特羊背最长肌、臂三头肌、股二头肌中CAST基因的表达规律进行研究,分析了表达量与肉质指标剪切力、色差、pH的相关性,以期为CAST基因对苏尼特羊肉质的影响提供相关理论数据。
1 材料与方法
1.1 材料与仪器
1.1.1 实验原料 选取内蒙古巴彦淖尔市五原县巴美肉羊养殖示范基地苏尼特羊40只,实验个体在相同饲养条件下饲养,5、6、8、12月龄时分别屠宰10只。
1.1.2 实验药品 RNAiso Plus、Premix Taq® Version2.0(Loading dye mix)、反转录试剂盒、SYBR® Premix Ex TaqTMII、pMD19-T Vector Kit 大连宝生物工程有限公司;琼脂糖凝胶DNA回收试剂盒 中科瑞泰北京生物科技有限公司。
1.1.3 主要仪器 CFX96TMReal-Time PCR Detection System 美国Bio-rad公司;TC-P2A 全自动测色色差计 上海生物生化实验仪器公司;CL-M嫩度仪 上海精密科学仪器有限公司;PCR仪 Biometra;低温台式高速冷冻离心机 Eppendorf5417R德国;BG-power 3500稳压稳流电泳仪 北京百晶生物技术有限公司;凝胶成像系统 美国Bio-rad公司;核酸蛋白分析仪 美国Bio-rad公司;-80℃超低温冰箱 Forma Scientific。
1.2 实验方法
1.2.1 肉样采集 对40只苏尼特羊在屠宰后45min内各取肌肉约100mg,装入标记好的无酶冻存管,投入液氮中,带回后-80℃保存,用于RNA提取。
1.2.2 指标测定 实验用羊在内蒙古渔蒙家食品有限公司进行肉质性状指标测定。肉质指标测定包括嫩度(剪切力)、色差(含红、黄与亮度值)、pH。羊胴体沿脊柱左右劈半,左半胴体宰后45min测其pH,记pH1,4℃冷库中悬挂排酸,24h再次测pH,记pH2。取右半胴体的背最长肌、臂三头肌、股二头肌,按参考文献方法[15-16],测定剪切力与色差。
1.2.3 引物设计 相对定量引物根据NCBI公布的基因序列,用软件Primer premier 5.0和在线软件Primer premier 3.0设计,管家基因(磷酸甘油醛脱氢酶)引物参考文献[17]所列,引物由生工生物工程(上海)有限公司合成。引物信息如表1所示。

表1 实时定量引物
1.2.4 RNA提取 采用TaKaRa RNAiso Plus按试剂盒使用说明进行总RNA提取。取4μL总RNA,加入236μL无酶水,用微量核酸蛋白分析仪测定其浓度,-70℃保存。RNA浓度=60×读取浓度[18]
1.2.5 反转录制备cDNA第一链 稀释RNA样品浓度为500μg/mL。使用宝生物(大连)工程有限公司TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)进行反转录。
1.2.5.1 去除基因组DNA 按表2在冰上配制反应混合液,将体系混合物在PCR仪中42℃、2min,去除基因组DNA,4℃保存。

表2 去除基因组DNA反应体系
1.2.5.2 反转录制备cDNA第一链 采用SYBR® Green qPCR法反转录,发转录体系如表3所示,反转录条件:37℃、15min;85℃、5s;4℃、24h。得到的cDNA浓度为50ng/μL,4℃保存。

表3 反转录体系
1.2.6 相对定量PCR扩增反应体系和反应条件及产物检测 按照CFX96TMReal-Time PCR Detection System操作方法进行程序设置。使用TaKaRa SYBR® Premix Ex TaqTMII(TLi RNaseH Plus)进行相对定量PCR扩增。以上一步反转录获得的cDNA为模板,按表4配制PCR反应液。以GAPDH管家基因,对CAST基因进行相对定量分析。目的基因与管家基因分别做4个平行样与2个阴性对照。PCR反应体系如表4。

表4 实时定量PCR反应体系
PCR反应条件:95℃预变性30s;95℃变性5s;退火30s(各基因对应的退火温度,如表1所示);,72℃延伸30s;35个循环;72℃延伸10min;4℃保存。
Real-time PCR产物检测:吸取5μL上述PCR产物,加入3μL 6×Loading Buffer,混匀,1.0%琼脂糖凝胶、120V电泳15min,凝胶成像系统检测、拍照。
1.2.7 数据统计与处理方法 实验数据均以平均值±标准差表示,应用SPSS12.0软件进行统计分析,用One-Way ANOVA方差分析进行显著性分析,采用最小显著极差法(LSD)检验。
相对定量数据处理采用2-ΔΔCt法,计算公式:①相对表达量(fold change)=2-ΔΔCt;②ΔΔCt=(Ct目的基因-CT内参基因)处理组-(Ct目的基因-Ct内参基因)未处理组[19]。
2 结果与分析
2.1 RNA提取
由图1可见,28S、18S处条带清晰明亮,总RNA完整无降解。经核酸蛋白分析仪检测OD值均在1.7~1.9之间,总RNA纯度较高,浓度均符合实验要求,可用于反转录实验。

图1 总RNA电泳结果Fig.1 Agarose gel electrophoresis of the total RNA注:泳道1、2、3是随机选取的RNA。
2.2 PCR反应产物
PCR反应产物经电泳检测后,用凝胶成像系统检测PCR反应产物的质量。从图2可以看出:GAPDH、CAST基因的PCR扩增产物经凝胶电泳后条带单一,无引物二聚体和非特异性扩增,大小与预期片段相符。切胶回收目的片段,测序分析,与GenBank数据库中的GAPDH、绵羊的CAST基因序列比对,同源性100%,确定产物为目的片段,引物符合实验要求。
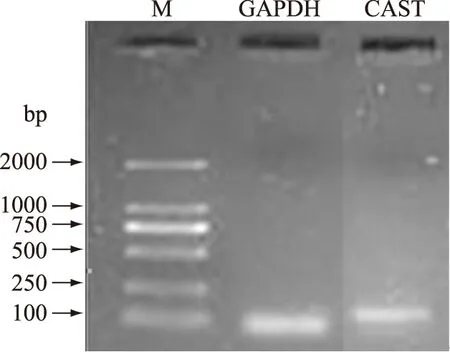
图2 目的基因PCR电泳图Fig.2 Agarose gel electrophoresis of target gene
2.3 苏尼特羊CAST基因表达发育规律
苏尼特羊CAST基因5、6、8、12月龄的表达量规律,如表5所示。

表5 苏尼特羊CAST基因表达发育规律
注:同行小写字母肩注相同,表示差异不显著,肩注不同表示差异显著(p<0.05),纵行大写字母肩注相同,表示差异不显著,肩注不同表示差异显著(p<0.05)。

表6 苏尼特羊5、6、8、12月龄肉质测定结果
注:同行小写字母肩注相同,表示差异不显著,肩注不同表示差异显著(p<0.05),纵行大写字母肩注相同,表示差异不显著,肩注不同表示差异显著(p<0.05)。pH1表示屠宰后45min的pH,pH2表示屠宰后24h的pH。
由表5可以看出,CAST在三个实验部位中的表达规律相同,5、6、8月龄有不同程度的增高,12月龄降到最低。燕凤[20]研究结果显示,80~200日龄的滩羊、蒙古羊、小尾寒羊中CAST基因的表达量随着日龄的增加不断提高,与本研究5~8月龄的实验结果类似。4个月龄不同部位比较,CAST基因的表达量为臂三头肌(Q)>股二头肌(H)>背最长肌(B)。5月龄时股二头肌(H)和背最长肌(B)表达量基本相同,8月龄时,臂三头肌(Q)和股二头肌(H)表达量基本相同。在8、12月龄时,臂三头肌(Q)中CAST基因的表达量显著高于背最长肌(B)。
2.4 苏尼特羊肉质测定结果
由表6可看出,在测定的三个部位中,剪切力值在6月龄时均高于5、8和12月龄,由于剪切力越大,嫩度越低,因此由表可知,5、8和12月龄时苏尼特羊的嫩度较好。经显著性分析可以看出,在背最长肌中,6、8月龄的嫩度存在显著差异;在股二头肌中,6月龄的剪切力显著高于5、8月龄,在臂三头肌中,6月龄与5、8、12月龄的剪切力存在显著差异。同一月龄不同部位间的剪切力经显著性分析可以看出,8月龄时,股二头肌和臂三头肌的嫩度存在显著差异。
在测定三个部位的肌肉中,背最长肌中的红度值,12月龄与5、6、8月龄的红度值存在显著性差异;5月龄与8月龄的红度值存在显著差异;12月龄的红度值最高。在股二头肌中,4个测定月龄间红度值不存在显著性差异。在臂三头肌中,12月龄的红度值显著高于5、6、8月龄。在8月龄时,背最长肌的红度值显著低于股二头肌和臂三头肌。
黄度值在背最长肌和股二头肌中,各个月龄间均无显著性差异。在臂三头肌中,5月龄和6月龄存在显著差异,4个测定月龄中,6月龄时的黄度值最低。同一月龄不同部位间,黄度值无显著差异。
在背最长肌中,8月龄亮度值与5、6月龄存在显著差异;12月龄与5、6月龄存在显著差异,8月龄与12月龄间的差异不显著。在股二头肌中,5月龄的黄度值与6、8、12月龄间存在显著差异,5月龄时的黄度值最高,12月龄最低。在臂三头肌中,5月龄的黄度值与6、8、12月龄间存在显著性差异。5月龄时,背最长肌与臂三头肌的亮度值存在显著性差异。6月龄时,臂三头肌的亮度值分别于背最长肌和股二头肌的亮度值存在显著性差异。8月龄时,背最长肌和臂三头肌中的亮度值存在显著性差异。12月龄时,三个部位间的亮度值差异不显著。
在背最长肌中,5月龄的pH1显著高于6月龄和12月龄。在股二头肌中,5月龄时的pH1显著高于6、8、12月龄的pH1;6月龄pH1值显著高于12月龄。在臂三头肌中,5月龄的pH1显著高于8月龄。6月龄和12月龄时,背最长肌中的pH1显著低于臂三头肌的pH1。
在臂三头肌中,5月龄时的pH2分别与6、8、12月龄间的pH2存在显著性差异。其它两个部位中,各个月龄间的pH2无显著差异。5月龄时,臂三头肌中的pH2显著高于背最长肌和股二头肌。8月龄时,背最长肌的pH2显著低于股二头肌和臂三头肌。
2.5 苏尼特羊CAST基因表达量与肉质的相关性
由表7可以看出,在背最长肌中,CAST基因表达量与剪切力呈负相关,相关系数-0.449;与红度值呈显著负相关,相关系数-0.950(p=0.050);与黄度值呈负相关,相关系数-0.753;与亮度值呈正相关,相关系数0.171;与pH1呈正相关,相关系数0.387;与pH2呈负相关,相关系数-0.245。

表7 苏尼特羊臂三头肌中CAST基因表达量与肉质的相关性
注:肩注*表示相关性显著(p<0.05),**表示相关性极显著(p<0.01)。
在臂三头肌中,CAST基因表达量与剪切力呈正相关,相关系数0.333;与红度值呈负相关,相关系数-0.494;与黄度值呈负相关,相关系数r=-0.465;与亮度值呈负相关,相关系数r=-0.317;与pH1呈负相关,相关系数-0.814;与pH2呈负相关,相关系数-0.629。
在股二头肌中,CAST基因表达量与剪切力呈正相关,相关系数0.520;与红度值呈负相关,相关系数-0.091;与黄度值呈正相关,相关系数0.846;与亮度值呈负相关,相关系数-0.193;与pH1呈负相关,相关系数-0.446;与pH2呈负相关,相关系数-0.446。
实验结果显示,在苏尼特羊的3个测试部位中,CAST基因的表达量与剪切力呈现不同的相关关系。Ilian等[21]研究了宰后72h肉嫩度的变化与钙蛋白酶系统的关系,得出calpastatin mRNA的表达与肉嫩度没有相关性,与本实验结果有所差异,这种差异可能是物种不同引起的。唐仁勇[22]对μ-Calpain,Calpastatin与猪肉嫩度的相关性研究中发现,μ-Calpain基因表达量增加时,猪肉嫩度较好,而Calpastatin基因表达量增加则会使猪肉嫩度降低,与本实验臂三头肌和股二头肌中的实验结果类似。
3 结论与讨论
CAST基因是影响家畜肉质的重要候选基因,近年来受到了广泛的关注。姚慧等[23]的研究显示,CAST基因在牦牛心、肝、脾、肺、肾、胃、眼肌、腹肌等不同组织中均有表达,在不同组织的表达量存在差异。陈春华等[24]在甘肃肉牛CAST基因的研究中发现3个多态位点。管凇等[25]对海南黑山羊CAST基因表达差异和发育规律进行研究,结果表明,骨骼肌中mRNA表达量极显著高于其他组织,2月龄时达到最高水平。本实验结果显示5、6、8月龄时,CAST基因的表达量随月龄增大而升高,12月龄时降到最低。在3个测试部位中,CAST基因的表达量发育规律为臂三头肌(Q)>股二头肌(H)>背最长肌(B),且CAST基因的表达量与剪切力呈现不同的相关关系。CAST基因在不同品种和物种间表达既有一定的相似性也存在差异,因此,本研究结果对苏尼特羊肉质及苏尼特羊品种选育均具有重要意义。
[1]桑布. 苏尼特羊[J].当代畜禽养殖业,1998(7):18-19.
[2]候文慧. 苏尼特羊粗脂肪含量的测定[J].肉类研究,2010(6):63-65.
[3]Lefaucheur L. A second look into fibre typing-Relation to meat quality[J]. Meat Science,2010,84(2):257-270.
[4]Davoli R,Braglia S. Molecular approaches in pig breeding to improve meat quality[J]. Briefings in functional genomics & proteomics,2007,6(4):313-321.
[5]Ranjbari M,Hashemi A,Mardani K,et al. Allelic Polymorphism of Makoei Sheep Calpastatin Gene Identified by Polymerase Chain Reaction and Single Strand Conformation Polymorphism[J]. Journal of Agricultural Science and Technology,2012,14(3):533-538.
[6]Ciobanu D C,Bastiaansen J W M,Lonergan S M,et al. New alleles in calpastatin gene are associated with meat quality traits in pigs[J]. Journal of Animal Science,2004,82(10):2829-2839.
[7]杨又兵.猪 MYOG 基因和CAST基因多态性研究及部分DNA片段的测序[D].武汉:华中农业大学,2003.
[8]张璐,曹洪战,芦春莲,等.4个猪种 CAST 基因与背膘厚关系的研究[J].黑龙江畜牧兽医,2009(1):8-9.
[9]吴旧生,徐宁迎.金皮猪肉质相关组织学特征与 CAST 基因 Hinfl 多态性的关系研究[J].分子细胞生物学报,2007,40(5):295-300.
[10]Allais S,Journaux L,Levéziel H,et al. Effects of polymorphisms in the calpastatin and μ-calpain genes on meat tenderness in 3 French beef breeds[J]. Journal of Animal Science,2011,89(1):1-11.
[11]王建华. 牦牛钙蛋白酶抑制蛋白(CAST)基因多态性及其与肉质性状关系的研究[D].兰州:甘肃农业大学,2010.
[12]金鑫. 延边黄牛肉质性状相关功能基因研究[D].延边:延边大学,2010.
[13]赵伯阳. 山羊CAPN1基因和CAST基因Ⅱ型转录本克隆及在不同组织中的表达[D].雅安:四川农业大学,2011.
[14]张增荣. 鸡 CAPN1,CAPN2,CAPN3 和 CAST 基因的克隆,表达及其在肉质中的遗传效应分析[D]. 雅安:四川农业大学,2009.
[15]靳烨. 高压处理对鲜牛肉感观性能的影响[D].北京:中国农业大学. 1999.
[16]李永鹏. 宰后成熟对藏羊肉肉用品质及挥发性化合物的影响[D].兰州:甘肃农业大学,2011.
[17]French M C,Littlejohn R P,Greer G J,et al. Growth hormone and ghrelin receptor genes are differentially expressed between genetically lean and fat selection lines of sheep[J]. Journal of Animal Science,2006,84(2):324-331.
[18]张佳佳. 沙地雀麦质膜水孔蛋白基因(BiPIP)和Actin基因克隆与序列分析[D].呼和浩特:内蒙古农业大学,2012.
[19]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[20]燕凤. 绵羊 CAPN1,CAST 基因 mRNA的发育性表达规律及其对肉品质的影响[D]. 杨凌:西北农林科技大学,2008.
[21]Ilian M A,Morton J D,Kent M P,et al. Intramuscular variation in tenderness:association with the ubiquitous and muscle-specific calpains[J]. Journal of Animal Science,2001,79(1):122-132.
[22]唐仁勇. μ-Calpain,Calpastatin 与猪肉嫩度的关系及其基因表达的营养调控研究[D].雅安:四川农业大学,2008.
[23]姚慧,陈智华,钟金城,等.CAPN1和CAST基因在牦牛不同组织中的表达差异研究[J].河南农业科学,2014,43(3):139-141.
[24]陈春华,赵生国,雷赵民,等.甘肃肉牛CAST基因的多态性及其与肉质性状的相关性研究[J].中国农学通报,2013,35:17-22.
[25]管凇,周汉林,侯冠彧,等.海南黑山羊MSTN基因的表达差异与发育性变化研究[J].家畜生态学报,2013,11:15-19.
Analysis of expression of calpastatin gene and its correlation with meat traits in Sunit Sheep
GUO Yue-ying1,CHENG Hai-xing1,WANG Le1,LIU Shu-jun2,ZHANG Jing1,REN Ting1,JIN Ye1,*
(1. College of Food Science and Engineering,Inner Mongolia Agricultural University,Huhhot 010018,China;2. Special Advancing Office of Graziery,Urat Middle County,Bayannur 015300,China)
Correlation of the expression with meat quality had been investigated. Relative quantization PCR was used to evaluate the expression of CAST in 40 Sunit sheep of different month ages. The shear force,pH,color were measured after being slaughtered. The correlation between the expression and the quality of meat were analyzed. The results showed that the expression pattern of CAST gene were same in three muscles in Sunit sheep,the expression of 5,6,8 mouth ages were rising and it was lowest in 12 month age. The expression in 4 month age was:triceps>biceps femoris>longissimus dorsi. The expression was nearly same in biceps femoris and longissimus dorsi in 5 month age. The expression was nearly same in triceps and biceps femoris in 8 month age. The expression in triceps was higher than longissimus dorsi significantly in 8 and 12 month age. The expression of CAST gene in longissimus dorsi had negative correlation with shear force(r=-0.449),yellowness(r=-0.753),pH2(r=-0.245), had significant negative correlation with redness-0.950(p=0.050),had positive correlation with lightness(r=0.171),pH1(r=0.387).The expression of CAST gene in biceps femoris had positive correlation with shear force(r=0.520),yellowness(r=0.846),had negative correlation with redness(r=-0.091),lightness(r=-0.193),pH1(r=-0.446),pH2(r=-0.446). The expression of CAST gene in triceps had positive correlation with shear force(r=0.333)and negative correlation with redness,yellowness,lightness,pH1and pH2,the correlation coefficients were-0.494,-0.465,-0.317,-0.814,-0.629 respectively.
Sunit sheep;calpastatin gene;relative quantization PCR;expression;meat quality
2014-05-07
郭月英(1977-),女,博士研究生,讲师,研究方向:畜产品加工与贮藏。
*通讯作者:靳烨(1964-),男,博士,教授,研究方向:畜产品安全生产。
国家自然基金项目(31160330,31360393)。
TS251.1
A
1002-0306(2015)07-0122-06
10.13386/j.issn1002-0306.2015.07.017
