唑类分子修饰的Dawson结构磷钨酸体外抗肿瘤活性比较研究
2015-05-08曲小姝刘树萍杨艳艳
曲小姝,刘树萍,杨艳艳
(1.吉林化工学院化学与制药工程学院,吉林 吉林 132022;2.哈尔滨商业大学旅游与烹饪学院,黑龙江 哈尔滨 150076)
唑类分子修饰的Dawson结构磷钨酸体外抗肿瘤活性比较研究
曲小姝1,刘树萍2,杨艳艳1
(1.吉林化工学院化学与制药工程学院,吉林 吉林 132022;2.哈尔滨商业大学旅游与烹饪学院,黑龙江 哈尔滨 150076)
对唑类修饰的Dawson结构磷钨酸化合物[Cr(H2O)6][BTA]3[P2W18O62]·12H2O(1)(BTA=苯并三氮唑),[Na(BTA)2(H2O)2]2[{Cd(BTA)4(H2O)}2(P2W18O62)]·6H2O(2)(BTA=苯并三氮唑)和[Na2(Himi)2(H2O)2](Himi)2[P2W18O62]·6H2O(3)(Himi=咪唑)进行了体外抗肿瘤活性研究.应用MTT法分析化合物1-3对人的宫颈癌HeLa细胞、卵巢癌SKOV-3细胞、肝癌HepG2细胞、神经母细胞瘤SHY5Y细胞,以及正常对照人脐静脉内皮ECV304细胞的增殖抑制活性.结果表明:化合物1对HeLa细胞具有明显的抑制作用,且呈剂量依赖性,IC50为16.4 μmol/L,其半数有效浓度较小,具有进一步研究价值;化合物2和化合物3对SKOV-3有抑制作用,IC50分别为65.2和67.2 μmol/L.
唑类修饰的Dawson结构磷钨酸;抗肿瘤;体外研究
多金属氧酸盐又称多酸 (polyoxometalates,POMs),通常是由前过渡金属,如钒(V)、铌(Nb)、钽(Ta)、钼(Mo)、钨(W)等以高价态形式与氧原子相连而形成的金属氧簇类配合物.MO6八面体和 MO4四面体是多酸的主要结构单元,这些多面体通过共角、共边或共面的形式相互连接形成了各种类型的多阴离子结构.[1]1971年Raynaud等首次报道了杂多阴离子[SiW12O40]4-的抗病毒活性,开创了多酸的药物化学[2].迄今为止,已报道具有各种药物活性的多酸达200多种[3-4],包括抗艾滋病[5-7]、抗肿瘤[8-9]、抗病毒[10-11]、抗菌[12]等.多酸药物具有以下优点:多酸的优异性质,如极性、氧化还原电势、表面电荷分布、形状和酸度对生物大分子靶识别可以产生重要影响;可以通过用d区或p区元素离子代替d0过渡金属阳离子,或者在POMs上共价连接与人体生理环境相匹配的有机基团来设计合成新型多酸药物分子.
Dawson结构磷钨酸是一种经典的多酸,多阴离子结构为[P2W18O62]6-.它的游离酸、钾盐、铵盐具有抗艾滋病毒、流感病毒、呼吸道合胞病毒、小鼠白血病肉瘤病毒的作用[3];K6(P2W18O62)·H2O具有显著的抑制人乳腺癌MCF-7细胞增殖和诱导细胞凋亡的活性[13].
唑类化合物如咪唑、苯并咪唑、苯并三氮唑及其衍生物是生物医药领域最受青睐的化合物种类之一.一方面,唑类衍生物的苯环及咪唑环上均能很容易引入取代基,这为生物活性分子的筛选提供了巨大的结构多样性空间,使得该类化合物在抗肿瘤、抗菌、抗病毒、消炎和杀虫等方面具有广谱的生物活性;另一方面,唑类衍生物的物理、化学及生物学稳定性也使其更具有成药性,已成为化学领域研究的热点之一.[14-15]
本文依据分子设计思想,将唑类分子组装到Dawson结构磷钨酸中,期望这种杂化物的有机和无机部分能够产生协同效应,形成具有双活性中心的多酸药物.通过常规水溶液合成方法,获得了3种唑类修饰的Dawson结构磷钨酸化合物1-3(分子结构如图1所示)[16-17].本文应用MTT法比较研究这3种化合物对人的宫颈癌HeLa细胞、卵巢癌SKOV-3细胞、肝癌HepG2细胞、神经母细胞瘤SHY5Y细胞,以及正常对照人脐静脉内皮ECV304细胞的增殖抑制活性.
1 实验部分
1.1 试剂与仪器
试剂:3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)及DMSO购自美国Sigma公司;胎牛血清、RPMI 1640 (pH为7.0~7.2)、胰蛋白酶均购自Gibco公司;双抗(青霉素钠、硫酸链霉素)购自西安制药公司;化合物1-3为自制单晶,结构经过X射线单晶衍射、红外光谱、元素分析表征,精密称取化合物1-3溶于DMSO中,再用含10%灭活新生小牛血清的RPMI-1640培养液稀释成终浓度为100 mmol/L的母液,4℃保存备用;人的宫颈癌HeLa细胞、卵巢癌SKOV-3细胞、肝癌HepG2细胞、神经母细胞瘤SHY5Y细胞及正常对照人脐静脉内皮ECV304细胞株由吉林医药学院科学实验室保存.
仪器:苏州苏静集团FLB-lB型超净工作室;美国SHELL/JB型CO2恒温细胞培养箱;日本OlYMPUS倒置相差显微镜;日本KA-1000型低速离心机;BIORAD公司680型酶标仪.
1.2 MTT法测肿瘤细胞活力
用标准培养基培养细胞,用CO2细胞培养箱孵育细胞,每2~3 d换液1次.细胞呈单层生长到70%~90%即可进行细胞传代.把对数生长期的肿瘤细胞调成密度为1×105个/mL,在96孔培养板中每孔加入200 μL密度为1×105个/mL的肿瘤细胞悬液,在37℃、体积分数为5%的CO2中培养,24 h后把肿瘤细胞分成空白对照组及实验组(0.1,1,10,20,50及100 μmol/L的化合物1-3溶液共6组)两大组,用培养基稀释液分别培养24 h.培养结束后每孔加入新鲜配制的MTT溶液20 μL,温育4 h使MTT还原为甲瓒,当在倒置显微镜下看到孔板内的细胞周围出现丝状紫色结晶体时倒掉上清液,每孔加DMSO 150 μL震荡溶解细胞,用平板摇床摇匀后,使用酶标仪测定光密度值(OD)(检测波长570 nm).计算增殖抑制率公式:增殖抑制率= (1-药物试验组吸光度值/对照组吸光度值)×100%.重复试验3次,取平均值.
2 结果与讨论
2.1 化合物1对肿瘤细胞的增殖抑制作用
由于活细胞的线粒体具有还原MTT形成紫色化合物的能力,该化合物在570 nm波长下有强吸收.细胞死亡或增殖功能下降时,还原MTT的能力下降,570 nm波长下吸光度值会降低(如图2a所示),与对照组比较,不同浓度的化合物1可使HeLa细胞的OD值明显减小,表明化合物1对HeLa细胞具有明显的抑制作用,半数抑制浓度IC50为16.4 μmol/L,且随着浓度的增加细胞的存活率下降,具有药物剂量依赖性.但对SKOV-3,HepG2,SHY5Y和ECV304细胞增殖无明显抑制作用,说明该化合物对肿瘤细胞系有一定的特异性,表明其具有较低的毒性.
2.2 化合物2对肿瘤细胞的增殖抑制作用
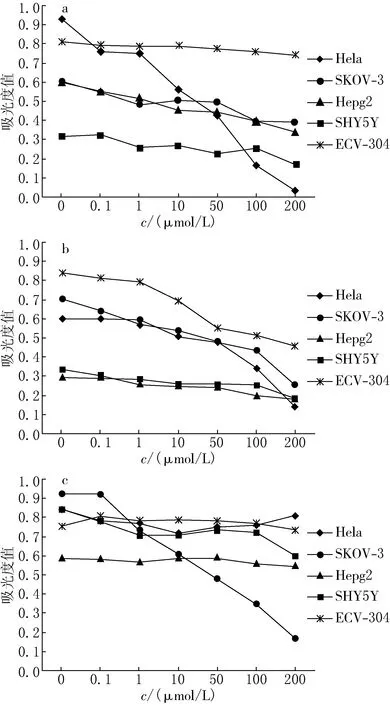
a为化合物1;b为化合物2;c为化合物3图2 不同浓度的化合物1-3对肿瘤细胞的增殖抑制作用
化合物2对SKOV-3的抑制作用见图2b,半数抑制浓度IC50为65.2 μmol/L,随着化合物2浓度的增加细胞的存活率下降,具有药物剂量依赖性.对HeLa,HepG2,SHY5Y和ECV304细胞增殖抑制作用均很弱,IC50分别为178.3,176.2,212.3和251.2 μmol/L.
2.3 化合物3对肿瘤细胞的增殖抑制作用
化合物3对SKOV-3的抑制作用见图2c,半数抑制浓度IC50为67.2 μmol/L,随着化合物3的浓度增加细胞的存活率下降,具有药物剂量依赖性.对HeLa,HepG2,SHY5Y和ECV304细胞基本无增殖抑制作用.
3 结论
用肿瘤细胞系体外培养模型筛选抗肿瘤备选药物是目前新药研究的基本方法,选用化合物1-3对人的宫颈癌HeLa细胞、卵巢癌SKOV-3细胞、肝癌HepG2细胞、神经母细胞瘤SHY5Y细胞及正常对照人脐静脉内皮ECV304细胞的增殖抑制活性进行了对比研究.研究结果表明:化合物1对HeLa细胞具有明显的抑制作用,IC50为16.4 μmol/L;化合物2和化合物3对SKOV-3有抑制作用,IC50分别为65.2和67.2 μmol/L.化合物1-3仅对某一种肿瘤细胞有较强抑制作用,且对正常对照人脐静脉内皮细胞ECV304细胞的增殖均无抑制作用,这说明化合物1-3对肿瘤细胞系有一定的特异性,表明其可能具有较低的毒性.化合物1-3对肿瘤细胞的增殖抑制呈剂量依赖性,半数有效浓度较小,具有进一步研究价值,可为多酸药物在肿瘤治疗领域的开发应用提供依据.
[1] POPE M T,MÜLLER A.Polyoxometalate chemistry an old field with new dimensions in several disciplines[J].Angew Chem Int Ed,1991,30(1):34-48.
[2] RAYNAUD M,CHERMANN J C,PLATA F,et al.Viral inhibitors of murine leukemia sarcoma group tungstosilicate[J].C R Acad Sci Ser D,1971,272(2):347-348.
[3] RHULE J T,HILL C L,JUDD D A,et al.Polyoxometalates in medicine[J].Chem Rev,1998,98:327-357.
[4] YAMASE T.Anti-tumor,-viral,and-bacterial activities of polyoxometalates for realizing an inorganic drug[J].J Mater Chem,2005,15:4773-4782.
[5] WATANABE H,NAKAI M,KOMAZAWA K,et al.Synthesis,characterization,and biological activity of a new potent class of anti-HIV agents,the peroxoniobium-substituted heteropolytungstates[J].J Med Chem,1994,37:876-877.
[6] WITVROUW M,WEIGOLD H,PANNECOUQUE C,et al.Potent anti-HIV (type 1 and type 2) activity of polyoxometalates:structure-activity relationship and mechanism of action[J].J Med Chem,2000,43(5):778-783.
[7] JUDD D A,NETTLES J H,NEVINS N,et al.Polyoxometalate HIV-1 protease inhibitors a new mode of protease inhibition[J].J Am Chem Soc,2001,123:886-897.
[8] COZZI P,MONGELLI N,SUARATO A.Recent anticancer cytotoxic agents[J].Curr Med Chem Anticancer Agents,2004:493-121.
[9] LIU X,GAN Q,FENG C G.Synthesis,characterization and antitumor activity of rare earth (Y,La) substituted phosphotungstates containing 5-fluorouracil[J].J Rare Earths,2012,30(6):604-608.
[10] 于洗河.新型多酸化合物(代号POM-2)抗乙肝病毒的实验研究[D].长春:吉林大学,2008.
[11] JASMIN C,CHERMANN J C,HERVE G,et al.In vivo inhibition of murine leukemia and sarcoma viruses by the hetero-polyanion 5-tungust-2-antimoniate[J].J Nat Cancer Inst,1974,534:69-47.
[12] FUKUDA N,YAMASE T,TAJIMA Y.Inhibitory effect of polyoxytungstates on the production of penicillin-binding proteins and β-lactamase against methicillin-resistant staphylococcus aureus[J].Biol Pharm Bull,1999,22:463-470.
[13] 赵文秀,李妍,董顺福,等.K6[P2W18O62]·14H2O抑制人乳腺癌细胞MCF-7生长的体外研究[J].中国药房,2009,30(7):509-511.
[14] SARDELLA R,LEVENT S,IANNI F,et al.Chromatographic separation and biological evaluation of benzimidazole derivative enantiomers as inhibitors of leukotriene biosynthesis[J].J Pharmaceut Biomed,2014:8988-8992.
[15] SEMPLE G,SKINNER P J,CHERRIER M C,et al.1-Alkyl-benzotriazole-5-carboxylic acids are highly selective agonists of the human orphan g-protein-coupled receptor GPR109b[J].J Med Chem,2006,49 (4):1227-1230.
[16] 杨艳艳,王新龙,曲小姝,等.[Na2(Himi)2(H2O)2[(Himi)2[P2W18O62]·6H2O的合成与晶体结构[J].吉林化工学院学报,2014,31(5):28-31.
[17] 杨艳艳,王新龙.苯并三氮唑修饰的磷钨酸盐化合物合成及性质研究[C]//中国化学会第五届全国多酸化学学术研讨会论文摘要集,哈尔滨:哈尔滨师范大学,2013:15.
(责任编辑:石绍庆)
Comparative study of in vitro anti-tumor activity of Dawson-type polyoxometalates decorated by azoles
QU Xiao-shu1,LIU Shu-ping2,YANG Yan-yan1
(1.Chemical and Pharmaceutical Engineering Institute,Jilin Institute of Chemical Technology,Jilin 132022,China;2.College of Tourism and Cusine,Harbin University of Commerce,Harbin 150076,China)
This paper is studied the in vitro anti-tumor activity of three Dawson-type polyoxometalates decorated by azoles [Cr(H2O)6][BTA]3[P2W18O62]·12H2O(1) (BTA=benzotriazole),[Na(BTA)2(H2O)2]2[{Cd(BTA)4(H2O)}2-(P2W18O62)]·6H2O(2) (BTA = benzotriazole),[Na2(Himi)2(H2O)2](Himi)2[P2W18O62]·6H2O(3) (Himi=imidazole).The inhibitory effect of compound 1-3 on the growth of human cervical carcinoma Hela cell line,human hepatoma HepG2 cell line,neuroblastoma SHY5Y cell line,ovarian carcinoma SKOV-3 cell line and human umbilical vein endothelial 304 cell line were studied by MTT assay.The results show that compound 1 can inhibit HeLa cell proliferation with IC50of 16.4 μmol/L and showing dose-dependent.The value is very low,suggesting it has further research value.Compound 2 and 3 can inhibit SKOV-3 cell proliferation with IC50of 65.2 and 67.2 μmol/L.
Dawson-type polyoxometalates decorated by azoles;anti-tumor;in vitro study
1000-1832(2015)04-0093-04
10.16163/j.cnki.22-1123/n.2015.04.020
2014-12-26
国家自然科学基金资助项目(21301041);吉林省教育厅科学技术研究项目(2015431);吉林市科技计划项目(20156418);吉林化工学院科学技术研究项目(201343,2015031).
曲小姝(1974—),女,博士,教授,主要从事多酸化学研究;通讯作者:杨艳艳(1981—),女,博士,副教授,主要从事多酸化学研究.
O 621.3 [学科代码] 150·20
A
