颈动脉斑块性质、TNF-α、CRP与缺血性脑卒中发病率的相关性研究
2015-05-06司友锋
司友锋
·论著·
颈动脉斑块性质、TNF-α、CRP与缺血性脑卒中发病率的相关性研究
司友锋
目的 分析颈动脉粥样硬化斑块性质、肿瘤坏死因子-α(TNF-α)、C-反应蛋白(CRP)水平与缺血性脑卒中临床发病率的相关性。方法 120例超声检查诊断为颈动脉斑块硬化患者, 均经过超声造影检查确定颈动脉斑块性质, 且根据斑块性质分为颈动脉斑块稳定组(A组, 73例)与颈动脉斑块不稳定组(B组, 47例)。两组患者均给予空腹肘静脉血检测血清中TNF-α、CRP含量, 追踪随访6个月, 统计入组患者缺血性脑卒中发病率。结果 A组与B组患者性别、年龄、体质量指数、血清总胆固醇(TC)、甘油三脂(TG)、低密度脂蛋白(LDL)水平比较, 差异无统计学意义(P>0.05)。A组缺血性脑卒中发病5例, 发病率6.85%;B组缺血性脑卒中发病9例, 发病率19.15%;两组比较, 差异有统计学意义(P<0.05)。依据患者血清中TNF-α、CRP水平分为升高组(C组)32例与正常组(D组)88例。C组缺血性脑卒中发病2例, 发病率6.25%;D组发病6例, 发病率6.82%;两组比较, 差异无统计学意义(P>0.05)。颈动脉斑块不稳定及TNF-α、CRP水平升高患者21例(E组), 颈动脉斑块稳定、TNF-α、CRP指标中任意一项异常患者99例(F组)。E组缺血性脑卒中发病8例, 发病率38.10%;F组发病11例,发病率11.11%;两组比较, 差异有统计学意义(P<0.05)。依据超声声像图表现将斑块分为Ⅰ、Ⅱ、Ⅲ级,Ⅰ级斑块46例, CRP(12.13±3.86)mg/L, TNF-α(23.16±4.91)pg/ml;Ⅱ级斑块34例, CRP(19.54±4.87) mg/L, TNF-α(29.03±4.38)pg/ml;Ⅲ级斑块40例, CRP(34.71±5.38)mg/L, TNF-α(43.61±5.82)pg/ml;3个等级间CRP与TNF-α水平比较, 差异有统计学意义(P<0.05)。结论 颈动脉粥样硬化斑块性质、TNF-α及CRP水平与缺血性脑卒中临床发病率高低关系密切, 颈动脉斑块性质不稳定, TNF-α及CRP水平升高, 患者缺血性脑卒中临床发病率明显增加, 几项联合检测有助于评估近期缺血性脑卒中发病风险。
缺血性脑卒中;C-反应蛋白;肿瘤坏死因子-α;粥样硬化
缺血性脑卒中是临床上常见的脑血管疾病, 其发病机制与多种因素有关[1,2]。其中, 动脉粥样硬化是缺血性脑卒中临床发病的主要病理基础。动脉粥样硬化斑块破裂, 激发体内凝血机制爆发反应, 造成血栓形成是缺血性脑卒中的主要病理生理机制。早期发现缺血性脑卒中的隐匿症状, 及早启动二级预防有助于缺血性脑卒中的发生。既往研究表明[3,4]颈动脉粥样硬化斑块的不稳定性及血清内炎性反应因子水平的升高均可能与脑梗死发生有关。本文试分析颈动脉粥样硬化斑块性质、TNF-α、CRP水平与缺血性脑卒中临床发病率的相关性, 现报告如下。
1 资料与方法
1.1 一般资料 选择2011年10月~2012年2月本院神经内科门诊超声检查诊断为颈动脉斑块硬化患者120例, 男57例, 女63例;平均年龄(57.9±8.2)岁。高脂血症患者35例, 高血压病患者83例, 糖尿病患者47例。颈动脉粥样硬化诊断标准参照2010年欧洲血管外科学会指南中《颈动脉狭窄患者的诊断和检查》标准。缺血性脑卒中诊断标准符合2010年中国急性缺血性脑卒中诊治指南, 且所有患者均经过颅脑影像学检查证实。入组标准:①自愿入组配合研究;②能够配合调查随访。 排除标准:①有急性心肌梗死及脑卒中病史;②临床存在陈旧性脑梗死影像学证据(如脑基底节区CT低密度病灶表现及T2加权MRI高信号表现);③急性感染性疾病;④严重肝肾功能不全及合并恶性肿瘤患者等。本研究得到医院伦理委员会批准, 所有治疗获得患者或者家属的知情同意, 签署知情同意书。入组患者均经过超声造影检查确定颈动脉斑块性质, 且根据斑块性质分为颈动脉斑块稳定组(A组, 73例)与颈动脉斑块不稳定组(B组, 47例)。两组患者性别、年龄、体质量指数、TC、TG、LDL差异无统计学意义(P>0.05), 具有可比性。所有入组患者均经过电话及门诊追踪随访6个月, 统计入组患者研究期间缺血性脑卒中发病率。
1.2 超声检查 颈动脉超声检查采用飞利浦IE330彩色超声诊断仪进行颅外颈总动脉及颈内动脉的纵横断面实时扫描。超声造影剂采用SonoVue, 生理盐水溶解, 经肘正中静脉团注造影, 分段存储动态影像分析。观察双侧颈动脉内中膜厚度, 斑块的形态、大小、内部回声结构等。颈动脉硬化的判断标准为颈动脉内中膜厚度≥1.0 mm。颈动脉斑块稳定性判断为:斑块形态偏心, 纤维帽回声不完整, 表面有溃疡形成。超声造影检查示斑块内有新生血管形成, 造影剂填充效应明显。颈动脉斑块性质分级:Ⅰ级:单侧颈动脉斑块, <3.0 mm;Ⅱ级:单侧斑块, ≥3.0 mm, 或者双侧斑块形成, <3.0 mm;Ⅲ级:单侧斑块≥5.0 mm, 或者双侧斑块形成,≥3.0 mm。
1.3 检验方法 两组患者均给予空腹肘静脉血检测血清中TNF-α、CRP含量, TNF-α采用双抗体夹心酶联免疫法,操作步骤按照说明书进行, CRP水平采用贝克曼特定蛋白仪利用散射比浊原理检测, 试剂盒购自南京建成生物工程公司。
1.4 统计学方法 采用SPSS19.0统计学软件对研究数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 不同水平分组缺血性脑卒中发病率比较 A组缺血性脑卒中发病5例, 发病率6.85%;B组缺血性脑卒中发病9例, 发病率19.15%;两组比较, 差异有统计学意义(P<0.05)。依据患者血清中TNF-α、CRP水平分为升高组(C组)32例与正常组(D组)88例。C组缺血性脑卒中发病2例, 发病率6.25%;D组发病6例, 发病率6.82%;两组比较, 差异无统计学意义(P>0.05)。颈动脉斑块不稳定及TNF-α、CRP水平升高患者21例(E组), 颈动脉斑块稳定、TNF-α、CRP指标中任意一项异常患者99例(F组)。E组缺血性脑卒中发病8例, 发病率38.10%;F组发病11例, 发病率11.11%;两组比较, 差异有统计学意义(P<0.05)。见图1。
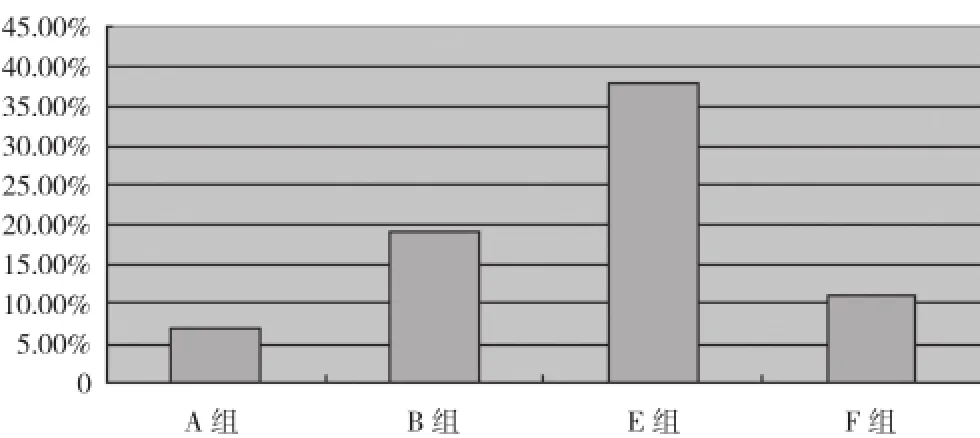
图1 不同水平分组缺血性脑卒中发病率注:A、B组比较, P<0.05;E、F组比较,bP<0.03
2.2 不同斑块性质分组中CRP及TNF-α水平的关系 依据超声声像图表现将斑块分为Ⅰ、Ⅱ、Ⅲ级, Ⅰ级斑块46例, CRP (12.13±3.86)mg/L, TNF-α(23.16±4.91)pg/ml;Ⅱ级斑块34例, CRP(19.54±4.87)mg/L, TNF-α(29.03±4.38)pg/ml;Ⅲ级斑块40例, CRP(34.71±5.38)mg/L, TNF-α(43.61±5.82)pg/ml。3个等级间CRP与TNF-α水平比较, 差异有统计学意义(P<0.05)。见图2。

图2 不同斑块性质分级CRP、TNF-α水平
3 讨论
动脉粥样硬化是心脑血管疾病主要的病理生理基础。既往多项研究表明[5], 颈动脉粥样硬化与缺血性脑卒中发病关系密切。颈动脉斑块形成、血管狭窄与颅内脑血管狭窄有较强的相关性。预防控制颈动脉粥样硬化斑块的发展也是预防缺血性脑卒中发生的主要二级预防措施。临床实际中发现颈动脉斑块的检出率较高, 但预测缺血性脑卒中近期发生的准确性较差。找到如何有效预测缺血性脑卒中发生的方法一直是临床研究的方向。有研究表明[6,7], 缺血性脑卒中发生时,体内炎性介质水平升高, 体内长期处于微炎症状态也是缺血性脑卒中发生的机制之一。由于颈动脉超声多普勒以及超声造影技术的成熟发展, 血清炎性介质之一TNF-α、CRP在临床检验中广泛应用[8]。本文试分析颈动脉粥样硬化斑块性质、TNF-α、CRP水平与缺血性脑卒中临床发病率的近期相关性。
颈动脉斑块的稳定性分析一直是临床超声影像技术研究的重点。颈动脉易损斑块的形成, 是斑块稳定性差的主要原因[8,9]。研究结果显示颈动脉斑块稳定组临床缺血性脑卒中发病率与颈动脉斑块不稳定组比较明显升高, 两组比较差异有统计学意义(P<0.05)。证明了颈动脉易损斑块的形成是缺血性脑卒中发生的易感因素。依据患者血清中TNF-α、CPR水平分为升高组与正常组。研究发现两组患者临床缺血性脑卒中发病率差异无统计学意义(P>0.05)。分析原因可能与血清炎性介质的水平与体内多种因素有关, 机体的氧化应激、各种原因导致的微炎性反应均可能导致血清TNF-α、CRP水平的升高, 单一的检查临床干扰因素较多, 尚不足以准确预测缺血性脑卒中的发生。本文依据颈动脉超声表现将颈动脉斑块依据稳定性分为3级, 研究发现其临床分级与血清炎性介质水平存在明显相关性。超声影像学对于颈动脉斑块稳定性的判断与血清炎性介质水平结合能明显提高临床近期缺血性脑卒中发病率的预测。
综上所述, 颈动脉粥样硬化斑块性质、肿瘤坏死因子-α、C-反应蛋白水平与缺血性脑卒中临床发病率高低关系密切,颈动脉斑块性质不稳定, 肿瘤坏死因子-α及C-反应蛋白水平升高, 患者缺血性脑卒中临床发病率明显增加, 几项联合检测有助于评估近期缺血性脑卒中发病风险。
[1] 夏章勇, 杨华, 曲怀谦, 等.短暂性脑缺血发作患者介入治疗术后炎性因子的动态变化及其与再狭窄的关系.中华神经医学杂志, 2010, 9(7):657-661.
[2] 饶明俐.中国脑血管病防治指南(试行版).北京:人民卫生出版社, 2007:49.
[3] 崔庆宏, 陈慧, 张拥波, 等.脑缺血机制再认识及神经血管单元的保护.中华神经医学杂志, 2012, 11(1):102-105.
[4] 张梅, 田英, 刘翠萍.脑梗死与炎症反应关系研究进展.现代中西医结合杂志, 2011, 20(15):1946-1949.
[5] 张涛, 雷新军.TNF-α、高敏C反应蛋白与颈动脉粥样硬化超声影像的相关性 .中国临床医学影像杂志, 2011, 22(12):849-851.
[6] 刘春霞, 余秀琼.2013AHA老年动脉粥样硬化性心血管疾病患者的二级预防科学声明.心血管病学进展, 2014, 35(3):394-396.
[7] 温学红, 肖继, 杨龙艳, 等.不同程度颈动脉狭窄的脑梗死患者生化指标的变化.医学综述, 2012, 18(4):615-617.
[8] 马玉栋, 李宝民, 王君, 等.超声在老年颈动脉粥样硬化狭窄诊断中的应用.中华老年心脑血管病杂志, 2011, 13(8):686-689.
[9] 元小东, 侯秋霞, 吴寿岭, 等.炎症细胞因子改变与脑梗死的相关性研究.中国神经免疫学和神经病学杂志, 2004, 11(3): 185-188.
Research of correlation in morbidity of ischemic stroke and carotid plaque feature, TNF-α, and CRP
SI You-feng.
Department of Neurology, Feicheng Mining Central Hospital, Taian 271608, China
Objective To analyze correlation in clinical morbidity of ischemic stroke and carotid plaque feature, tumor necrosis factor-α (TNF-α), and C-reactive protein (CRP) levels.Methods There were 120 carotid plaque sclerosis patients diagnosed by ultrasonography, and their carotid plaque features were also diagnosed by ultrasonography.They were divided by carotid plaque features into stable carotid plaque group (group A, 73 cases) and unstable carotid plaque group (group B, 47 cases).Serum contents of TNF-α and CRP were detected from fasting elbow vein blood in both groups.Follow-up lasted for 6 months, and morbidity of ischemic stroke was summarized.Results The differences of gender, age, body mass index, serum total cholesterol (TC), triglyceride (TG), and low density lipoprotein (LDL) between group A and group B had no statistical significance (P>0.05).There were 5 cases with ischemic stroke in group A, with the morbidity as 6.85%, and there were 9 cases with ischemic stroke in group B, with the morbidity as 19.15%.The difference between the two groups had statistical significance (P<0.05).The patients were divided by their serum TNF-α and CRP levels into increased group (group C) with 32 cases and normal group (group D) with 88 cases.There were 2 cases with ischemic stroke in group C, with the morbidity as 6.25%, and there were 6 cases with ischemic stroke in group D, with the morbidity as 6.82%.The difference between the two groups had no statistical significance (P>0.05).There were 21 cases with unstable carotid plaque and increased TNF-α and CRP levels (group E) and 99 cases with stable carotid plaque and abnormal TNF-α and CRP levels (group F).There were 8 cases with ischemic stroke in group E, with the morbidity as 38.10%, and there were 11 cases with ischemic stroke in group F, with the morbidity as 11.11%.The difference between the two groups had statistical significance (P<0.05).Plaques were classified intograde Ⅰ, Ⅱ and Ⅲ by ultrasonic image manifestations.Grade Ⅰ plaque in 46 cases had CRP as (12.13±3.86) mg/L and TNF-α as (23.16±4.91) pg/ml; Grade Ⅱ plaque in 34 cases had CRP as (19.54±4.87) mg/L and TNF-α as (29.03±4.38) pg/ml; Grade Ⅲ plaque in 40 cases had CRP as (34.71±5.38) mg/L and TNF-α as (43.61±5.82) pg/ml.There were statistically significant differences of CRP and TNF-α levels between different grades (P<0.05).Conclusion There are close correlations in clinical morbidity of ischemic stroke and carotid plaque feature, TNF-αand CRP.Unstable carotid plaque feature, increased TNF-αand CRP levels will lead to obviously increased clinical morbidity of ischemic stroke.Combined detection of these indexes is helpful for evaluation of short-term risk in morbidity of ischemic stroke.
Ischemic stroke; C-reactive protein; Tumor necrosis factor-α; Atherosclerosis
10.14163/j.cnki.11-5547/r.2015.22.001
2015-03-24]
271608 肥城矿业中心医院神经内科
