常熟虞山松蕈优良菌株选育及深层发酵条件的优化
2015-05-05郑丽雪翁渝洁
徐 兵,郑丽雪,翁渝洁,冀 宏
(常熟理工学院生物与食品工程学院,江苏常熟 215500)
常熟虞山松蕈优良菌株选育及深层发酵条件的优化
徐 兵,郑丽雪,翁渝洁,冀 宏*
(常熟理工学院生物与食品工程学院,江苏常熟 215500)
针对常熟虞山松蕈菌株筛选及深层发酵条件优化展开研究。以松蕈深层液体发酵的生物量、菌丝球直径、菌丝体密度及菌丝体日生长速率为指标,筛选得到松蕈2号菌株。进一步优化了该菌株的发酵条件。通过单因素实验研究了培养温度、摇床转速及发酵周期对松蕈深层发酵的影响。最后,通过响应面实验优化得到最佳发酵条件为温度25 ℃,摇床转速170 r/min,发酵周期8.5 d。在此条件下培养后,松蕈菌丝体干重达14.5 mg/mL。
虞山松蕈,菌株筛选,深层发酵,优化
松蕈,即松茸,属于真菌门,担子菌亚门,层菌纲,伞菌目,口磨科,口磨属[1],是国家二级保护植物。常熟地区虞山自古以来自然环境使然,适者生存,松林的空气中就含有蕈的孢子,当温湿度条件适宜时,就会生长出松蕈子实体。虞山蕈油面是江苏常熟汉族传统的特色面点,有“素中之王”之称,用蕈油作为面“浇头”的蕈油面,鲜美异常,非一般蘑菇可比。经研究表明,松蕈含有丰富的蛋白质、矿物质、微量元素、人体必需氨基酸及多糖,其中松蕈多糖具有抗肿瘤、免疫调节作用、抗衰老、抗辐射、抗糖尿病、美白、抗炎抗菌等作用[2-6]。食用菌的栽培工艺主要是采用固体菌种技术,采用固体菌种技术已培育出多种食用菌,但固体栽培受到季节、原材料、生长周期、成本和易污染等限制。实践证明,食用菌深层液体发酵工艺制备液体菌种可替代固体菌种用于生产[7],采用深层发酵工艺制备食用菌液体菌种是当前研究的热点。目前,还未见关于人工固体栽培松树蕈及深层液体发酵工艺制备液体菌种方面的研究。
本文针对常熟虞山松蕈菌株筛选及深层发酵条件优化展开研究,旨在为实现松蕈的工厂化生产奠定理论基础。
1 材料与方法
1.1 材料与仪器
松蕈 江苏常熟虞山,6个松蕈子实体分别编号为松蕈1号,松蕈2号,松蕈3号,松蕈4号,松蕈5号,松蕈6号。
5418R型小型台式高速冷冻离心机 eppendorf中国有限公司;MJ-250BS-Ⅱ型霉菌培养箱 上海新苗医疗器械制造有限公司;WGL-45B型电热鼓风干燥箱 天津市泰斯特仪器有限公司;LDZX-30KBS型立式压力蒸汽灭菌器 上海申安医疗器械厂;GHP-9160型隔水式培养箱 上海申贤恒温设备厂;M124A型电子天平 苏州赛恩斯仪器有限公司;ZQLY-180型全温震荡培养箱 上海知楚仪器;CJ-1S型洁净工作台 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 菌种选育培养基制备 固体培养基:PDA培养基。
液体培养基:葡萄糖20 g,胰蛋白胨4 g,磷酸二氢钾3 g,硫酸镁1.5 g,VB10.002 g,蒸馏水1000 mL,pH自然。
1.2.2 发酵条件优化培养基制备 液体培养基:葡萄糖30 g,酵母粉5 g,磷酸二氢钾3.5 g,硫酸镁1.5 g,VB10.002 g,蒸馏水1000 mL,pH自然。
1.2.3 种子液的制备 无菌操作条件下,取活化好的1 cm×1 cm菌种块于三角瓶液体培养基中,每瓶接种3块,于26 ℃,160 r/min条件下培养9 d。三角瓶装液量为100 mL/250 mL。
1.2.4 摇床发酵培养 将松蕈种子液按照5%(v/v)的接种量接种到发酵培养基中,于26 ℃、160 r/min,培养9 d。
1.2.5 优良菌株筛选 在同等条件下,将6株野生松蕈菌种分别接入PDA培养基中,于26 ℃培养活化。然后将活化好的松蕈菌种接种到液体发酵培养基中进行发酵培养,考察菌丝球直径、菌丝球数量、菌丝体干重及菌丝体日生长速率4个指标,筛选出液体发酵优势菌株。
1.2.5.1 菌丝球直径(d)的测定 随机取菌丝球20个,将其拍成一排,测量其总长度,重复三次,取平均值,记为D,菌丝球直径即d=D/20[8]。
1.2.5.2 菌丝球数量的测定 取10 mL的发酵液,过80目标准筛,计数筛网上的菌丝球的个数,此数值记为n个。则100 mL发酵液中菌丝球数目为N=10×n。
1.2.5.3 菌丝体干重的测定 取100 mL发酵醪液于80目标准筛中过滤,用蒸馏水冲洗3次,将过滤所得的菌丝体于60 ℃干燥箱中烘干至恒重,得松蕈菌丝体干重记为W。
1.2.5.4 菌丝体日生长速率的测定 在同等条件下,将不同编号的松蕈菌种分别接入PDA培养基中,放入恒温培养箱中进行培养,设置温度为26 ℃。每天观察菌丝生长情况,当菌丝体开始生长,每2 d在固定时间测定菌落直径,连续测量5次,测量菌丝用十字交叉法。计算菌丝体日均生长速率。计算公式如下:
式(1)
1.2.6 发酵条件优化单因素实验
1.2.6.1 温度对虞山松蕈产菌丝体的影响 以菌丝体干重作为指标,考察不同温度对松蕈发酵产菌丝体的影响。温度分别设定为23、24、25、26、27 ℃。摇床转速160 r/min,培养时间为9 d。
1.2.6.2 摇床转速对虞山松蕈产菌丝体的影响 考察不同摇床转速对松蕈发酵产菌丝体的影响。摇床转速分别设定为120、140、160、180、200 r/min。温度为25 ℃,培养时间为9 d。
1.2.6.3 发酵周期对虞山松蕈产菌丝体的影响 以菌丝体干重作为指标,考察发酵周期对松蕈发酵产菌丝体的影响。培养温度为25 ℃,摇床转速为160 r/min。
1.2.7 响应面实验设计 采用响应面法中的Box-Behnken模型对影响松蕈菌丝体生长的关键因素(温度、摇床转速、发酵周期)进行优化。数据处理软件为Design Expert 8.05 b。
设温度、摇床转速和发酵周期为自变量,分别为A,B,C,每个自变量中的低、中、高水平以-1,0,1进行编码,以菌丝体干重为因变量R进行实验设计,所有实验重复3次。
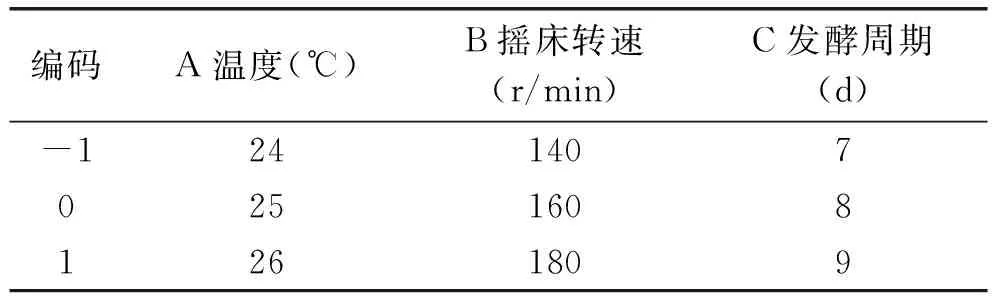
表1 编码与因子的实际浓度的对应关系
2 结果与分析
2.1 优良菌株筛选实验
2.1.1 不同编号松蕈菌丝球直径测定结果 由图1可知,不同编号松蕈菌丝球直径由大到小依次为:松蕈2号>松蕈3号>松蕈4号>松蕈1号>松蕈5号>松蕈6号。其中松蕈2号菌丝球直径和松蕈3号相差不大,分别为0.213 cm和0.208 cm。其他编号的松蕈菌丝球直径均小于0.2 cm,对于液体发酵的菌丝球直径一般要求在0.2 cm左右[9]。
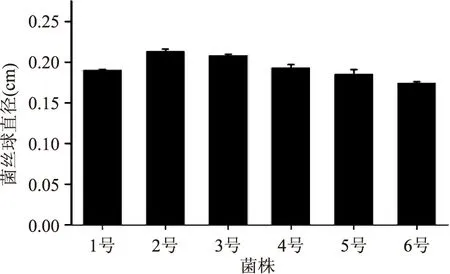
图1 不同编号菌株菌丝球直径Fig.1 Different strains mycelium ball diameter
2.1.2 不同编号松蕈菌丝球数量的测定结果 100 mL发酵液中,不同编号松蕈菌丝球数量见图2。由图2可知,松蕈3号发酵液中菌丝球数量最多,达到了2900个,其次是松蕈2号,每100 mL发酵液中菌丝球数量为2880个。对于液体发酵的菌丝球数量要求在3000个/100 mL左右[9]。所以,基本能够达到液态深层发酵要求的菌株是松蕈3号和松蕈2号。

图2 不同编号菌株菌丝球数量Fig.2 Different strains mycelium ball numbers
2.1.3 不同编号松蕈菌丝体干重的测定结果 不同编号松蕈菌丝体干重如图3所示,由图3可知:松蕈2号菌丝体干重最大,为11.82 mg/mL,其次为松蕈3号,菌丝体干重为10.92 mg/mL,松蕈6号菌丝体干重最小。
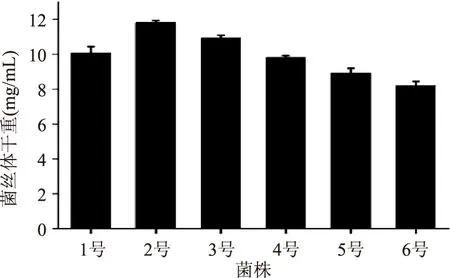
图3 不同编号菌株菌丝体干重 Fig.3 Different strains dry weight of mycelium
2.1.4 菌丝体日生长速率的测定结果 由图4可见,2号和3号的菌丝体日均生长速率最快,2号菌丝体日生长速率为0.46 cm/d,特别是第10~12 d菌丝生长速率大幅度提升,这可能由于此培养基适合2号、3号菌丝体生长,前期可能因为培养基松紧影响,菌丝体处于稳定生长时期,后期当培养基适宜菌丝体生长后,速率大幅度提升。

图4 不同培养时间下的菌丝体日均生长速率Fig.4 Day of mycelium growth rate under different culture time
综合菌丝球直径、数量、干重及日生长速率的测定结果,松蕈2号3号的测定结果相近,但是松蕈2号发酵液菌丝体干重大于松蕈3号,所以,可初步判断松蕈2号更适合液体发酵,本文选择松蕈2号菌株作为进一步研究的实验菌株。
2.2 发酵条件优化单因素实验
2.2.1 温度对虞山松蕈产菌丝体的影响 保持酶活一个重要因素就是温度,因此,在发酵过程中,选择最佳的温度条件,使得酶能维持其活性,才能使微生物生长保持在旺盛状态,得到最多的目的产物[10-11]。
不同发酵温度对松蕈菌丝体产量的影响见图5。

图5 温度对松蕈产菌丝体的影响Fig.5 Effect of temperature on the mycelia of Tricholoma matsutake
由图可知,当发酵温度为25 ℃时,松蕈菌丝体干重最大,为13.2 mg/mL。当温度高于25 ℃时,松蕈菌丝体产量急剧下降,可能是松蕈菌丝体细胞生长代谢相关的酶耐热性差,酶活降低导致。因此,选择25 ℃作为最佳的发酵温度。
2.2.2 摇床转速对虞山松蕈产菌丝体的影响 当水中含有其他物质的时候,氧在水中的溶解度就会降低。所以,在发酵的过程中,为满足菌丝体生长代谢的需要,需要不断的向培养液供给足够的氧,但是,当溶氧过大的时候,菌丝体的生长代谢又会受到抑制,因此,为了提高代谢产物的浓度只能保持合适的溶氧[12]。通过摇床转速可控制培养基中氧的含量。
摇床转速对松蕈产菌丝体的影响见图6。

图6 摇床转速对松蕈产菌丝体的影响Fig.6 Effect of shaking speed on the mycelia of Tricholoma matsutake
由图6可知,摇床转速对松蕈产菌丝体的影响比较明显,当摇床转速为160 r/min时,发酵液中菌丝体产量最高。转速低时,由于通气量小,培养基内溶解氧量不足,不能满足菌丝体生长需求,而转速过高对菌丝球的剪切作用增强,也不利于菌丝体的生长[13]。所以选择160 r/min为最佳的摇床转速。
2.2.3 发酵周期对虞山松蕈产菌丝体的影响 菌丝体的生长分为迟滞期,对数生长期,稳定期及衰亡期四个时期。发酵周期对松蕈菌丝体产量的影响见图7。

图7 发酵周期对松蕈产菌丝体的影响Fig.7 Effect of fermentation cycle on the mycelia of Tricholoma matsutake
从发酵第2 d开始,菌丝生长进入了对数生长期,发酵第7 d,菌丝体产量接近最大,第8 d和第9 d时菌丝体产量相差不大。可能是由于培养过程中菌丝球直径增大,导致营养物和溶解氧向内部传递困难,菌丝体量不再增加。所以,选择8 d作为发酵周期。
2.3 响应面实验设计
响应面实验设计及结果见表3。按照Design Expert 8.05 b软件中的Box-Behnken Design方法,三个因素经过拟合得到的回归方程为:
菌丝体干重=13.42+0.12A+0.97B+1.60C-0.17AB+0.55AC+0.43BC-0.70A2-1.29B2-1.51C2
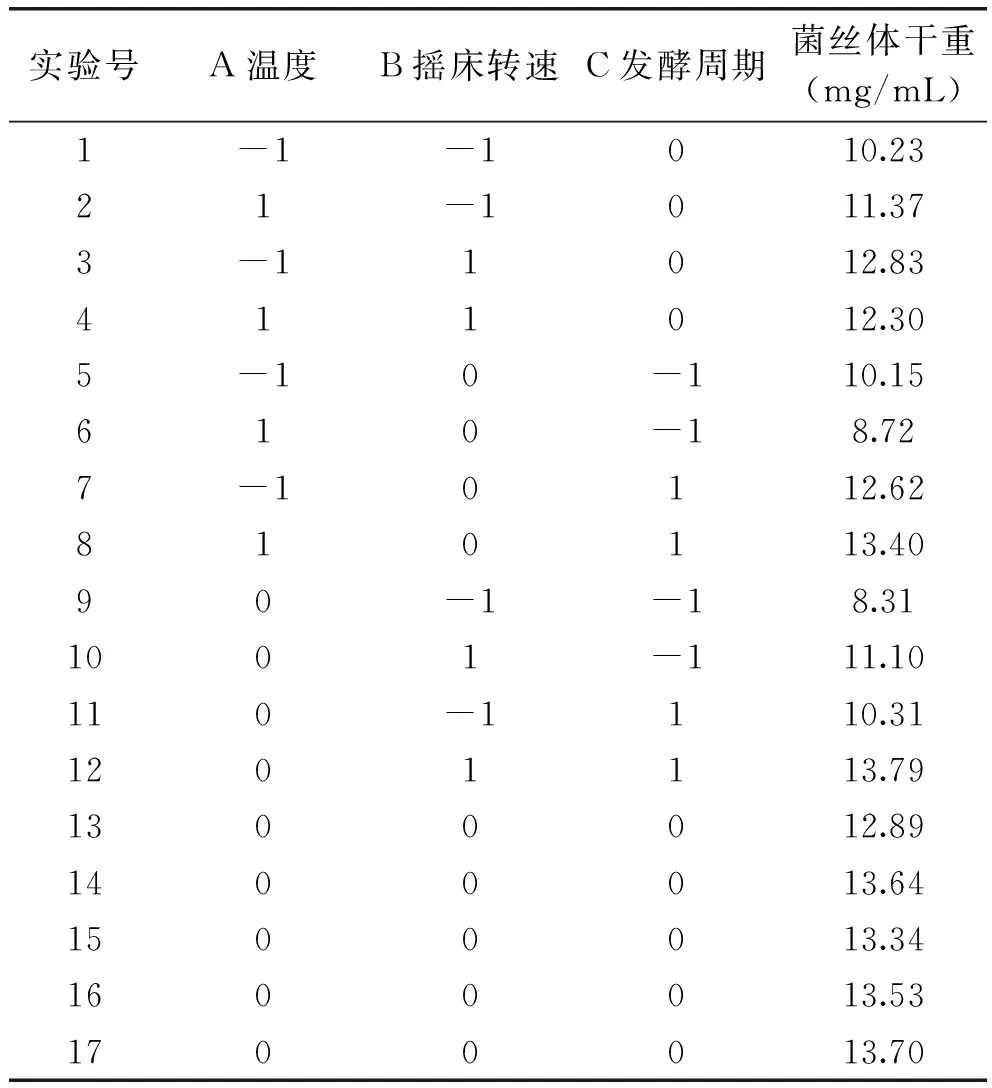
表3 Box-Behnken 实验设计及相关结果
对该回归方程进行方差分析,结果见表4。由表4可知,该模型达到极显著水平(p=0.0005<0.01),该模型的R2=0.9575,说明该模型与实验拟合良好,故可用于设计范围内的预测。
由表4可知,在一次项中,摇床转速和发酵周期对松蕈菌丝体干重的影响显著(p<0.05),温度对于松蕈菌丝体干重的影响不显著。在二次项中,温度、摇床转速和发酵周期的影响都达到了显著水平,交互项中,各因素的交互作用都不显著。
根据Design Expert 8.05 b软件对数据进行二次多元回归拟合,所得到的二次回归方程的响应面图如图8~图10所示,温度、摇床转速、发酵周期及交互作用对响应值的影响可以从图中直观地反映出来,并确定各个因素的最佳水平。
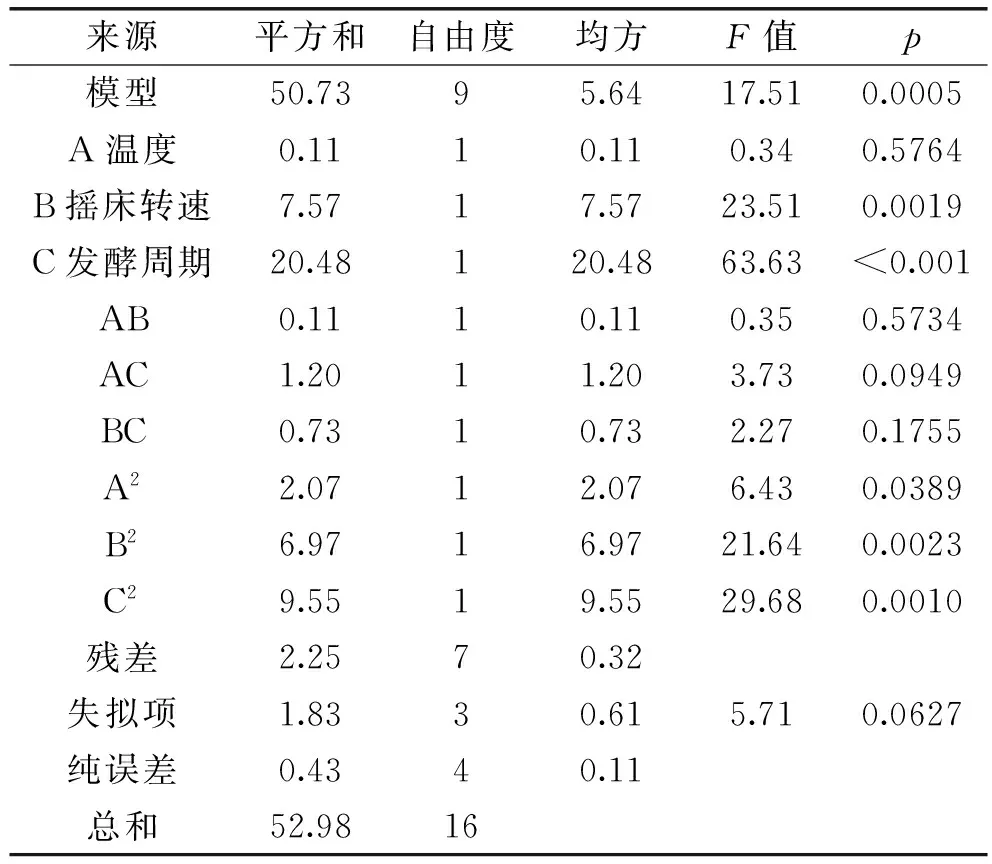
表4 响应面实验方差分析
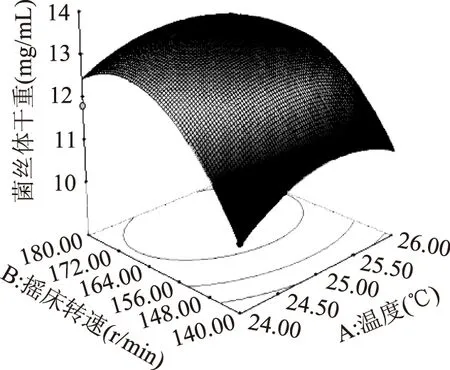
图8 温度及摇床转速对松蕈菌丝体交互效应的响应面图Fig.8 Rsponse surface of the mycelia of Tricholoma matsutake vs fermentation temperature and rotation speed

图9 温度及发酵周期对松蕈菌丝体交互效应的响应面图Fig.9 Response surface of the mycelia of Tricholoma matsutake vs fermentation temperature and fermentation cycle
通过分析预测得到松蕈菌丝体干重最大值为
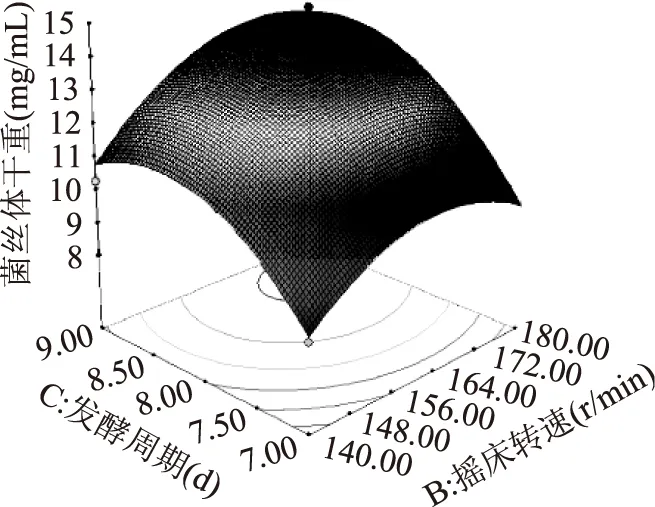
图10 摇床转速及发酵周期对松蕈菌丝体交互效应的响应面图Fig.10 Response surface of the mycelia of Tricholoma matsutake vs rotation speed and fermentation cycle
14.18 mg/mL,即当A(温度)=25.3 ℃,B(摇床转速)=169.4 r/min,C(发酵周期)=8.7 d。考虑到实际操作便利,确定发酵条件的最佳组合为:温度25 ℃,摇床转速170 r/min,发酵周期8.5 d。为了证实预测的结果,用以上得到的最优配方重复实验3次,3次实验菌丝体干重平均值为14.5 mg/mL,与预测值拟合较好,由此可以看出回归方程为松蕈液体发酵提供了一个合适的模型。优化后松蕈菌丝体产量与课题组前期优化的白灵菇深层发酵菌丝体产量接近,这说明液体深层发酵法生产松蕈将指日可待[14]。
3 结论
以菌丝球直径、菌丝球数量、菌丝体干重及菌丝体日生长速率为指标,筛选到液体发酵优势菌株为2号菌株,其菌丝球直径为0.213 cm,每100 mL发酵液中菌丝球数量为2880个,菌丝体干重为11.82 mg/mL,菌丝体日生长速率为0.46 cm/d。
由单因素实验可知,实验菌株液体发酵最佳温度为25 ℃,最佳摇床转速为160 r/min,最佳发酵周期为8 d。响应面实验优化后的最佳发酵条件为温度25 ℃,摇床转速170 r/min,发酵周期8.5 d,在此条件下,松蕈菌丝体干重为14.5 mg/mL,比优化前提高了23%。
本实验首次对常熟虞山松蕈菌丝体深层液态发酵工艺进行了研究,实验用培养基配方简单、价格低廉、容易获取,而且发酵周期短,菌丝体产量可观,此研究对于生产实践具有较好的指导作用。
[1]王悦,薛伟. 不同温度和湿度对松茸保鲜效果的影响[J]. 食品工业科技,2012,33(08):366-368.
[2]蒋谷人,林卓坤,肖夫坤. 担子菌多糖及羊脾RNA对肿瘤的抑制与有关组织中cAMP含量关系的探讨[J]. 生物化学杂志,1985,1(5):149-154.
[3]Kim J.,Byeon Se.,Lee YG. et al. Immunostimulatory activities of polysaccharides from liquid culture of pine-mushroom Tricholom a matsutake[J]. J Microbiol Biotechnol,2008,18(1):95-103.
[4]刘刚,王辉,张洪. 松茸多糖对 D-半乳糖所致小鼠衰老模型的影响[J]. 中国药理学通报,2012,28(10):1439-1442.
[5]Hoshi H,Iijima H,Ishihara Y. et al. Absorption and tissue distribution of an immunomodulatory alpha-D-glucan after oral administration of Tricholoma matsutake[J]. J Agric Food Chem,2008,56(17):7715-20.
[6]Masaru O,Hiroyuki H,Hironori M. Screening of Various Mushroomswith Inhibitory Activity of Adipocyte Conversion[J]. Journal of the Japanese Society for Food Science and Technology,2000,47(5):394-396.
[7]李书倩. 白灵菇深层发酵和多糖提取工艺的研究[D]. 沈阳:沈阳农业大学,2006.
[8]Royse D J,May B. Use of isozyme variation to identify genotypic classes of Agaricus brunnescens[J]. Mycologia,1982,74(1):93-102.
[9]冀宏,齐斌,赵黎明. 白金针菇液体菌种优良菌株选育[J].食品与机械,2013,29(6):49-53.
[10]叶勤. 发酵过程原理[M]. 北京:化学工业出版社. 2005:300-302.
[11]白秀峰. 发酵工艺学[M]. 北京:中国医药科技出版社. 2003:158-162.
[12]何俊勇. 高产谷胱甘肽新菌种的选育及其工艺条件的研究[D]. 杭州:浙江工业大学,2004.
[13]李正鹏.白灵菇液体发酵及其胞外多糖生物活性的研究[D].合肥:安徽农业大学,2006.
[14]冀宏,赵黎明. 基于生物量的白灵菇菌株筛选及其深层发酵培养条件优化[J]. 食品科学,2013,34(23):221-227.
Predominant strains breeding and optimization of submerged fermentation conditions of Changshu YushanTricholomamatsutake
XU Bing,ZHENG Li-xue,WENG Yu-jie,JI Hong*
(College of Biology and Food Engineering,Changshu Institute of Technology,Changshu 215500,China)
Strains breeding and optimization of submerged fermentation conditions of Changshu YushanTricholomamatsutakewere studied in this paper. The predominant strain ofTricholomamatsutakein liquid culture was screened by testing mycelium ball diameter,mycelium ball number,mycelium dry weight of the ball and day of mycelium growth rate under different incubation time. NO.2 was used as experimental strains. Mycelium submerged fermentation culture conditions were optimized. The effect temperature,shaking speed and fermentation cycle onTricholomamatsutakesubmerged fermentation were researched by single factor experiment. The optimal fermentation conditions determined by the response surface test was 25 ℃,170 r/min and 8.5 d,under which the dry weight of mycelium was 14.5 mg/mL.
Tricholomamatsutakeof Yushan;strains breeding;submerged fermentation;optimization
2015-01-26
徐兵(1982-),男,硕士研究生,实验师,研究方向:食用菌工程技术,E-mail:xubing@cslg.cn。
*通讯作者:冀宏(1969-),男,博士研究生,研究员,研究方向:食用菌工程技术,E-mail:jihong@cslg.cn。
TS201.1
A
1002-0306(2015)21-0200-05
10.13386/j.issn1002-0306.2015.21.033
