HCN通道在爪蟾卵母细胞中的功能表达
2015-05-04孙燕张树卓卓仁恭刘晓燕马晓芸魏晓莉刘莹郑建全
孙燕,张树卓,卓仁恭,刘晓燕,马晓芸,魏晓莉,刘莹,郑建全
1.大连医科大学附属一院 心内科,辽宁 大连 116000;2.军事医学科学院 毒物药物研究所,北京 100850;
3.南方医科大学 药学院,广东 广州 510515
HCN通道(hyperpolarization-activated cyclic nucleotide-gated cation channel)即超极化激活的环核苷酸门控阳离子通道,是一种超极化激活的内向阳离子电流,至今共发现4个亚基,分别为HCN1、HCN2、HCN3和HCN4[1-4]。HCN通道是电压门控阳离子通道成员,在结构上类似电压依赖性通道,但不同的HCN亚型通道的mRNA的表达水平和分布情况却并不完全相同[2-3]。HCN2在大脑中广泛表达;HCN1和HCN4分布比较局限,仅在特定的大脑区域表达量高,HCN1主要在新皮质、海马、小脑皮质表达,HCN4主要在内侧缰核、丘脑、嗅球、基底神经节的某些特定神经元表达;HCN3在大脑的大部分区域的表达量低,但在嗅球和下丘脑的一些核团表达量较高[1,5-6]。HCN主要的生物学功能包括调节心脏起搏,调节神经元兴奋性及节律性活动,维持静息膜电位及神经元放电的共振,影响神经元的突触可塑性及突触传递[3,7]。HCN通道与一些疾病密切相关。研究发现,HCN2的缺失可以出现窦性心律失常和癫痫;HCN1的缺失可以出现运动神经学习和记忆的障碍;HCN4的突变可表现为家族性窦性心动过缓、心律失常、心力衰竭等[1,8]。在体内,HCN通道为异聚体,其在不同脑区的生物学功能尚未完全明确。为此,我们建立了爪蟾卵母细胞表达的HCN1及HCN2通道的同聚体模型,以观察HCN通道同聚体电流的生物学特点,为HCN通道性质的研究及药物评价奠定基础。
1 材料和方法
1.1 材料
携带HCN1、HCN2编码序列的质粒由Colum⁃bia University的Steven A.Siegelbaum教授提供,表达载体为pGH19[9];大肠杆菌TOP10转化态细胞购自博迈德公司;质粒提取及互补DNA(cDNA)体外转录试剂盒为Promega公司产品;限制性内切酶NheⅠ、SpeⅠ均为TaKaRa公司产品;青霉素、链霉素均购自北京化学试剂有限公司。
1.2 记录及培养外液的配制
OR-2溶液(mmol/L):NaCl 82,KCl 2.5,MgCl2·6H2O 1,HEPES 5(用 NaOH 调 pH 值至 7.6);ND-96溶液(mmol/L):NaCl 96,KCl 2,CaCl21.8,MgCl2·6H2O 1,HEPES 5(用NaOH调pH值至7.6);记录外液(mmol/L):KCl 96,NaCl 2,MgCl22,HEPES 10(用KOH调pH值至7.5)。
1.3 互补RNA(cRNA)的制备
将含有HCN基因的表达载体pGH19转化大肠杆菌TOP10,涂于含有氨苄西林(100 μg/mL)的固体LB培养基平板上,倒置平板,37℃培养箱中培养12~16 h,挑选单克隆置于液体LB培养基中,250 r/min振荡培养12~16 h,提取质粒,经双酶切鉴定正确后,送测序公司测序鉴定,测序结果与Pubmed数据库比对完成正确。取HCN1和HCN2的cDNA 20~40 μg,分别用NheⅠ、SpeⅠ线性化2 h,经DNA纯化和去RNA酶,用T7体外转录试剂盒转录成cRNA,并进行RNA纯化,纯化后的cRNA存于-70℃备用。
1.4 爪蟾卵母细胞的分离与培养
从低温麻醉的成年雌性爪蟾中取出Ⅴ、Ⅵ期成熟卵母细胞,置于含有胶原酶的OR-2溶液中,消化至无纤维组织及毛细血管残留的单个细胞为止;除去消化液,用含有双抗的OR-2清洗5~6次,置于含有双抗及5%马血清的ND-96培养皿中,挑选外形较圆、色泽清晰、有一定张力、表面光滑的细胞注入cRNA(HCN1 5.5 ng,HCN2 2.8 ng,HCN1+HCN2混合分别为2.8 ng+1.4 ng),孵育在生化培养箱(18~22℃)中,1~3 d后可用于电生理记录。
1.5 电生理学
双电极电压钳记录电流时采用Axoclamp-2B放大器,记录时室内温度保持在23~25℃。采用Sutter Instrument公司的P-97型微电极仪拉制记录玻璃微电极,微电极的尖端开口在1~3 mm,电极内液为3 mol/L KCl,电极电阻为0.3~3 MΩ。电流记录采用episode模式,采样频率10 kHz,钳制电位为-50 mV并以10 mV为步阶递减至-140 mV给予细胞刺激。
1.6 数据分析
用 Clampfit 10.2软件(Axon Instruments)获取电流数据,用OriginPro 8软件处理绘制图形。数据分析使用x±s,采用独立样本t检验进行显著性检验,SPSS软件分析数据,P<0.05为具有显著性差异。
2 结果
2.1 HCN1与HCN2同聚体在爪蟾卵母细胞中的功能表达
采用双电极电压钳技术记录了在爪蟾卵母细胞中表达的HCN通道电流,1 mmol/L的CsCl可以有效阻断这种超极化激活的内向阳离子电流[5,10-11]。图1、2中分别记录了HCN1、HCN2电流,对照组及CsCl阻断前后及其电流-电压(I-V)曲线。无CsCl时,使细胞膜超极化至-140 mV时,诱发的HCN1电流幅度为-4829±357.7 nA(n=5,图1B);添加1 mmol/L的CsCl后6 min,其电流减小到-698.5±366 nA(n=5,图1C);冲洗 15 min后,其电流值恢复至-2140.2±726.6 nA(n=5,图 1D);图 1E 示 3种不同情况下HCN1通道的I-V曲线。无CsCl时HCN2的电流幅度为-1397.9±664.0 nA(n=4,图2A);添加1 mmol/L的CsCl后6 min,其电流值几乎完全被抑制(n=4,图2B);冲洗10 min后,其电流值为-1037.6±580.3 nA(n=4,图2C),在1 mmol/L的CsCl作用下,HCN2电流值显著减少;图2D示3种不同情况下HCN2通道的I-V曲线。由图可知,HCN1激活较快,而HCN2的激活动力学较慢。
2.2 HCN1与HCN2异聚体在爪蟾卵母细胞中的功能表达
HCN1与HCN2为不同的亚基,那么HCN1与HCN2结合后电流数值有什么变化呢?HCN1组每个细胞注入HCN1的cRNA 5.5 ng,其电流值为-4289±357.7 nA(n=5,图5A),HCN2组每个细胞注入HCN2 的 cRNA 2.8 ng,其电流值为-1397.9±664.0 nA(n=3,图4B),HCN1+HCN2组每个细胞混合注入HCN1的cRNA 2.8 ng、HCN2的cRNA 1.4 ng,其电流值为-9471.6±1813.7 nA(n=4,图 3C);图3D为3种不同状态下的I-V曲线。
3 讨论
HCN通道在维持神经元的静息膜电位及神经元的节律性活动等生理过程中起重要作用。HCN通道的改变可能会导致心律失常、癫痫等疾病的发生[12]。本实验中,我们通过建立爪蟾卵母细胞表达的HCN1及HCN2通道的同聚体细胞模型,观察1 mmol/L的CsCl对 HCN1、HCN2的作用;并建立了HCN1及HCN2共表达的异源多聚体模型,观察共表达的异源多聚体通道产生的电流。在目前的实验中,我们已验证了CsCl对HCN1及HCN2的阻断作用,与以往文献报道相符[10-11,13],1 mmol/L的CsCl可以有效抑制Ih电流,说明本研究中HCN通道表达模型建立成功。HCN1与HCN2混合形成了新的异源多聚体通道,该通道具有新的性质,而这些特性不能从单个通道组成简单推论而来。实验证明,新的异源多聚体通道产生的电流比单独HCN1、HCN2亚基产生的电流大,其通道的激活动力学及电压依赖性处于HCN1和HCN2之间,且更接近HCN1亚单位的特性[6]。在海马CA1区,HCN1及HCN2形成的异聚体通道共同表达形成Ih电流,本实验通过体外模拟该通道并研究其性质,有助于我们研究天然通道的独特性质。近年来HCN通道已引起许多研究者的注意,期望通过对该通道的探讨,为研究HCN通道相关疾病提供新的理论依据[1]。本试验建立的细胞模型可作为研究HCN通道在疾病发生机制中的作用的便利模型,同时也是今后药物评价的可靠依据。
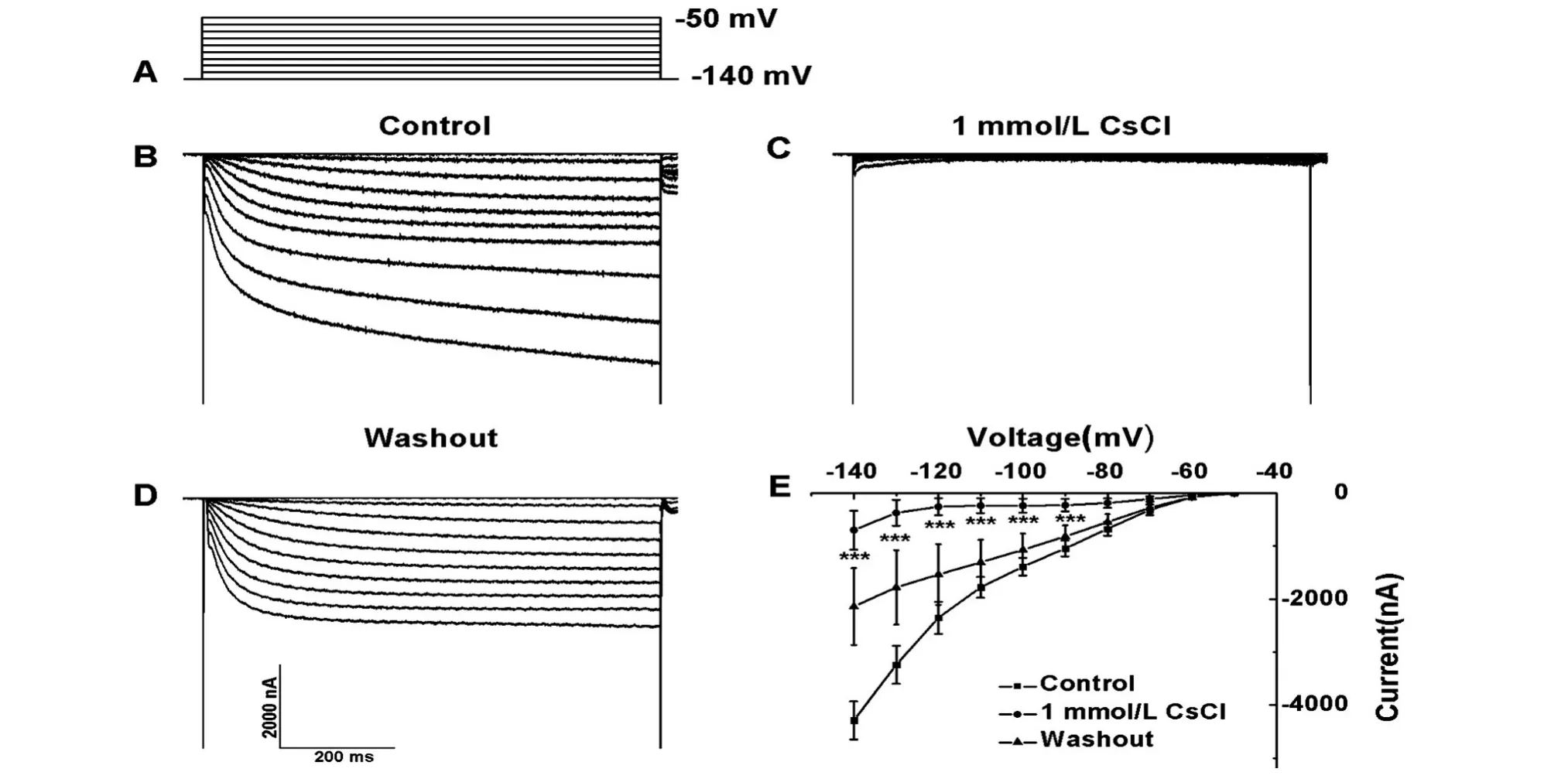
图1 HCN1在爪蟾卵母细胞中的表达A:记录HCN1电流的刺激脉冲;B:HCN1电流;C:1 mmol/L CsCl阻断HCN1;D:冲洗15 min后记录的HCN1电流;E:记录HCN1电流的I-V曲线
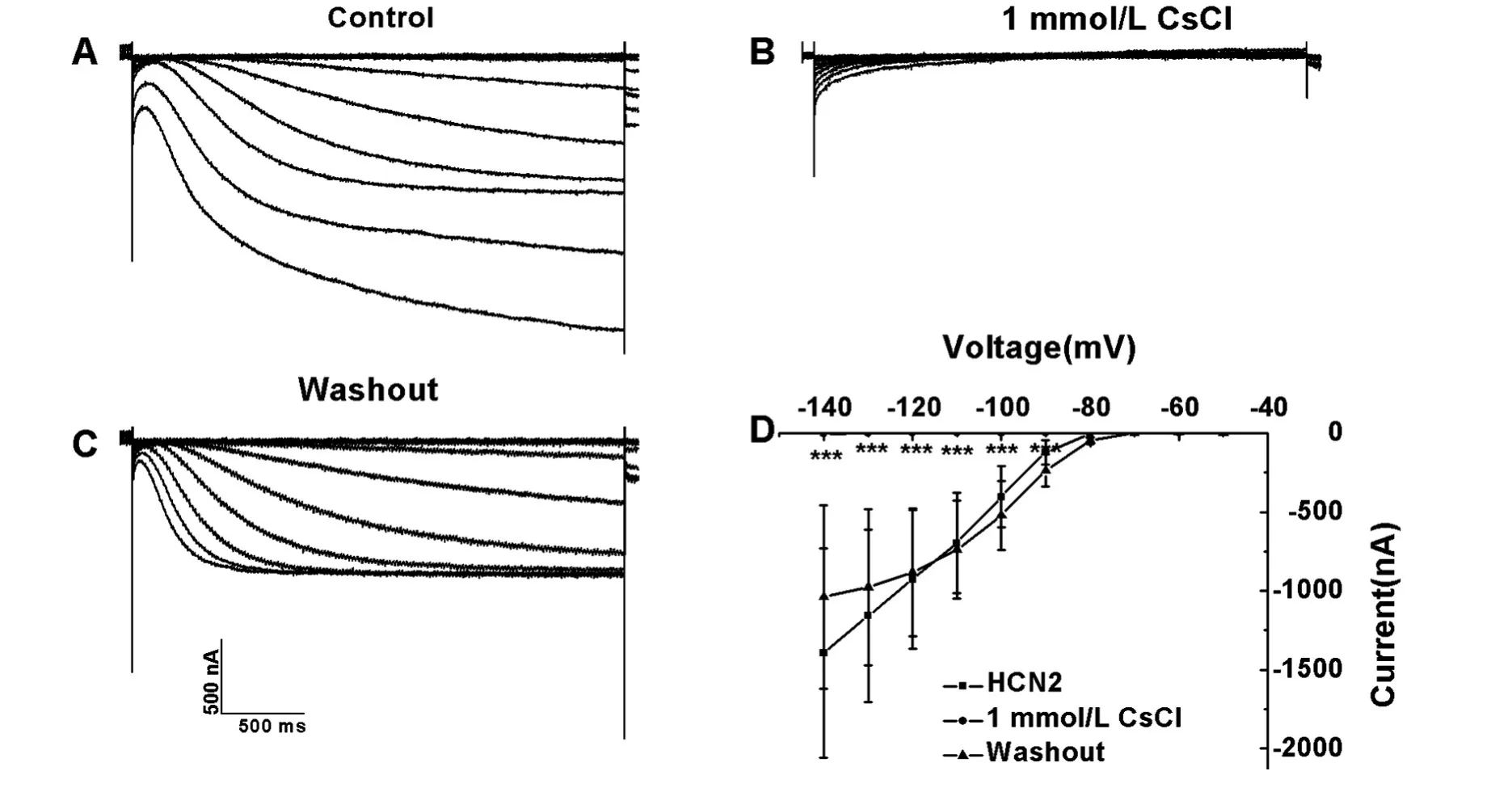
图2 HCN2在爪蟾卵母细胞中的表达A:HCN2电流;B:1 mmol/L CsCl阻断HCN2;C:冲洗10 min后记录的HCN2电流;D:记录HCN2电流的I-V曲线
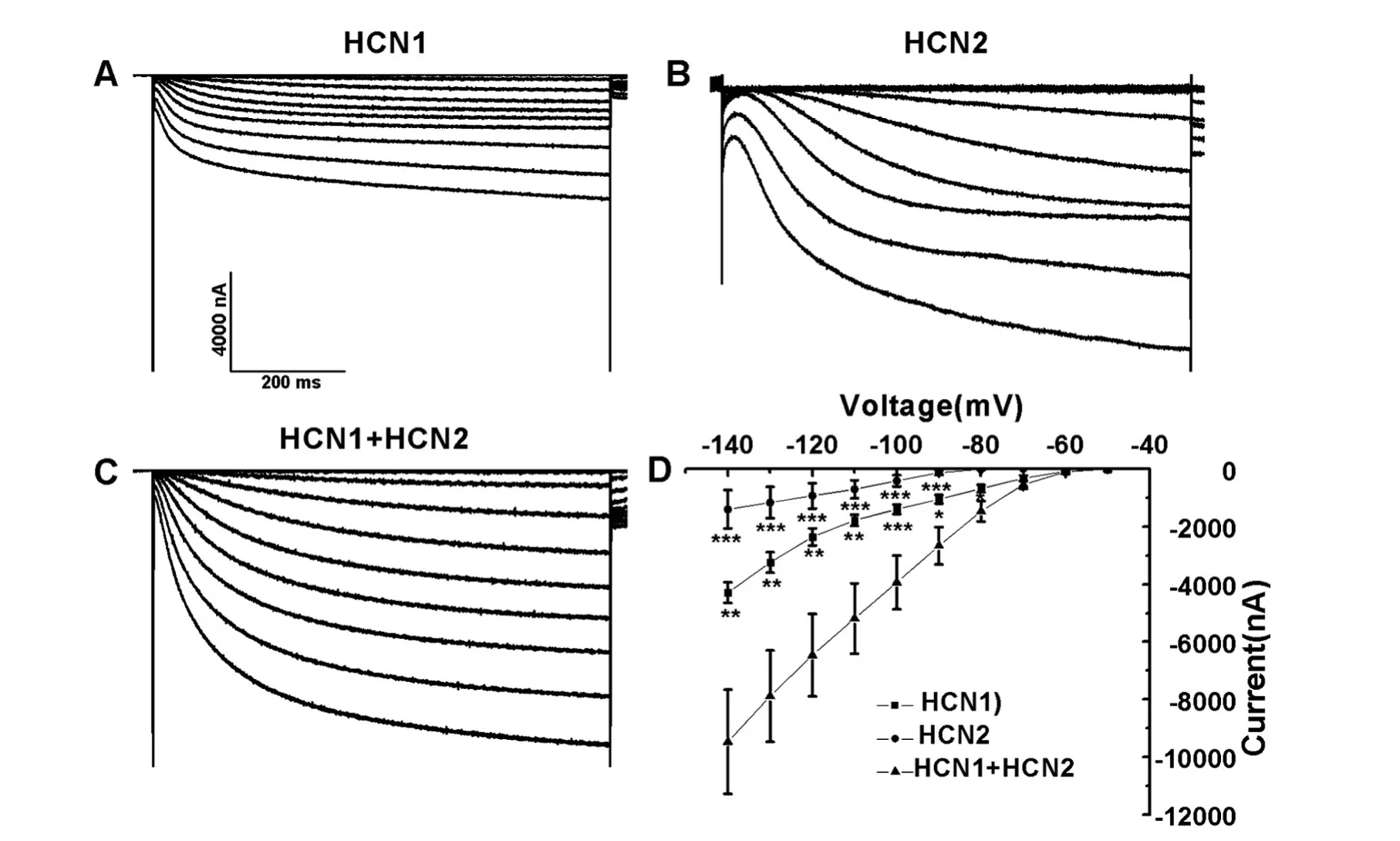
图3 HCN通道同聚体及异聚体在爪蟾卵母细胞中的表达A:HCN1电流;B:HCN2电流;C:HCN1+HCN2异聚体电流;D:HCN通道的I-V曲线
[1] Biel M,Wahl-Schott C,Michalakis S,et al.Hyperpolariza⁃tion-activated cation channels:from genes to function[J].Physiol Rev,2009,89(3):847-885.
[2] Xue T,Marban E,Li R A.Dominant-negative suppression of HCN1-and HCN2-encoded pacemaker currents by an engi⁃neered HCN1 construct:insights into structure-function rela⁃tionships and multimerization[J].Circ Res,2002,90(12):1267-1273.
[3] Wilkars W,Liu Z,Lewis A S,et al.Regulation of axonal HCN1 trafficking in perforant path involves expression of spe⁃cific TRIP8b isoforms[J].PLoS One,2012,7(2):e32181.
[4] Jackson H A,Hegle A,Nazzari H,et al.Asymmetric diver⁃gence in structure and function of HCN channel duplicates in Ciona intestinalis[J].PLoS One,2012,7(11):e47590.
[5] Moosmang S,Biel M,Hofmann F,et al.Differential distribu⁃tion offourhyperpolarization-activated cation channels in mouse brain[J].Biol Chem,1999,380(7-8):975-980.
[6] Chen S,Wang J,Siegelbaum S A.Properties of hyperpolariza⁃tion-activated pacemakercurrentdefined bycoassemblyof HCN1 and HCN2 subunits and basal modulation by cyclic nu⁃cleotide[J].J Gen Physiol,2001,117(5):491-504.
[7] Santoro B,Baram T Z.The multiple personalities of h-chan⁃nels[J].Trends Neurosci,2003,26(10):550-554.
[8] Baruscotti M,Bottelli G,Milanesi R,et al.HCN-related chan⁃nelopathies[J].Pflugers Arch,2010,460(2):405-415.
[9] Santoro B,Hu L,Liu H,et al.TRIP8b regulates HCN1 chan⁃nel trafficking and gating through two distinct C-terminal in⁃teraction sites[J].J Neurosci,2011,31(11):4074-4086.
[10]Li Y L,Tran T P,Muelleman R,et al.Blunted excitability of aortic baroreceptor neurons in diabetic rats:involvement of hyperpolarization-activated channel[J].Cardiovasc Res,2008,79(4):715-721.
[11]Wang Y P,Sun B Y,Li Q,et al.Hyperpolarization-activated cyclic nucleotide-gated cation channel subtypes differentially modulate the excitability of murine small intestinal afferents[J].World J Gastroenterol,2012,18(6):522-531.
[12]LewisA S,SchwartzE,Chan C S,etal.Alternatively spliced isoformsofTRIP8b differentiallycontrolh channel trafficking and function[J].J Neurosci,2009,29(19):6250-6265.
[13]Doan T N,Stephans K,Ramirez A N,et al.Differential distri⁃bution and function of hyperpolarization-activated channels in sensory neuronsand mechanosensitive fibers[J].JNeurosci,2004,24(13):3335-3343.
