幽门螺杆菌毒素相关蛋白A的EPIYA多态性对胃上皮细胞AGS形态及IL-8表达的影响
2015-05-04刘鹿王艳春陶好霞袁盛凌王令春刘纯杰
刘鹿,王艳春,陶好霞,袁盛凌,王令春,刘纯杰
军事医学科学院 生物工程研究所,北京 100071
作为世界第四大癌症,全球每年新发胃癌100余万例,中国占42%;胃癌每年死亡人数约80万,中国占35%。中国是胃癌发病率和死亡率最高的国家之一,发病率和死亡率均2倍于世界平均水平,恶性肿瘤死亡病例中,胃癌位列死亡总数的第二位[1]。
幽门螺杆菌(Helicobacter pylori)是一种可长期定植于人类胃黏膜的革兰阴性菌,在世界范围感染率超过50%,是引起胃炎、消化性溃疡、胃黏膜相关的淋巴样组织淋巴瘤和胃腺癌的重要病原体[2-3]。1994年,幽门螺杆菌被世界卫生组织列为Ⅰ类致癌因子。幽门螺杆菌与胃癌的发展密切相关,其中,幽门螺杆菌毒素相关蛋白A(cytotoxin-associated gene A,CagA)与胃癌的关系已被广泛深入研究[4-6]。
CagA由cagA基因编码,基于C端的谷氨酸-脯氨酸-异亮氨酸-酪氨酸-丙氨酸基序(EPIYA基序)的数量及组合而分类其多态性及分型[7]。EPIYA基序分为A、B、C和D等4类。具有EPIYA-C的CagA属于东亚型CagA,具有EPIYA-D的CagA属于西方型CagA[8]。随着世界人口的流动,目前出现了既不同于东亚型,亦不同于西方型的新型CagA,如美国印第安型(Amerindian)及日本西方型(J-Western),且含新型CagA的菌株范围有日益扩展的趋势[9-10]。许多研究者在体外用CagA(+)的幽门螺杆菌感染胃上皮细胞株AGS,可导致AGS细胞出现以细胞伸长和扩散为特征的独特形态学改变[11];亦有报道CagA可引起NF-κB激活,使白细胞介素8(interleukin-8,IL-8)表达增强,从而增加胃腺癌的发生[12]。这可能预示单独CagA可以作为导致胃癌形成的细菌毒力因子。揭示幽门螺杆菌CagA蛋白致病机制,对于阐明胃癌发生机制具有重要意义。
我们通过设计、人工合成并优化不同cagA基因型,构建相应表达载体,转染胃上皮细胞AGS后,观察与分析比较幽门螺杆菌CagA EPIYA多态性对细胞形态及IL-8的影响,为幽门螺杆菌感染致病机制研究、风险评估及根除治疗提供理论依据。
1 材料与方法
1.1 材料
胃上皮细胞株AGS由本室保存;Fast Pfu DNA聚合酶购自TransGen公司;T4DNA连接酶购自Fer⁃mentas公司;质粒pcDNA3.1(+)购自Invitrogen公司;琼脂糖凝胶PCR产物回收试剂盒购自Promega公司;F12培养基、胎牛血清购自GIBCO公司;细胞裂解液购自Novagen公司;jet PRIME转染试剂盒、OMEGA无内毒素小量质粒提取试剂盒Ⅰ、蛋白酶抑制剂购自Calbiochem公司;CagA抗体、GAPDH抗体HRP酶标山羊抗兔二抗购自Santa Cruz公司;ECL底物显色试剂盒购自TIANGEN公司;OptEIA人IL-8 ELISA检测试剂盒购自Invitrogen公司。
1.2 各型cagA基因的优化、合成及质粒的构建与制备
参考幽门螺杆菌 Ca52、NCTC11637、98-10、F75、Shi470及PNGhigh85株的CagA设计其C端序列;采用CUTG(Condon Usage Tabulated from Gen⁃Bank)提供的人密码子使用频率表对各序列在GC含量、二核苷酸频率、密码子偏性、隐蔽剪接位点及ATTTA序列替换等五方面进行分析。由于CagA蛋白N端极为保守,故N端统一采用98-10株CagA的N端。将优化后的序列交公司合成。采用重组克隆试剂盒法,将各型C端分别和98-10株CagA N端与pcDNA3.1载体进行连接,用质粒提取试剂盒进行各型质粒的提取。
1.3 细胞培养及转染
采用F12培养液(含10%胎牛血清),于37℃、5%CO2细胞培养箱中培养AGS细胞2~3 d,细胞融合达95%左右即可用0.25%胰酶消化,并按1∶3传代培养。转染前1 d,在6孔培养板每孔中接种4×105细胞,于37℃、5%CO2细胞培养箱中培养,当融合达80%~90%时,按照转染试剂盒说明进行转染,每孔加入2 μg各型CagA质粒,转染后48 h内进行相关检测。
1.4 CagA表达检测
转染后24 h,在每孔中加300 μL细胞裂解液,冰浴5 min后收集细胞裂解物进行SDS-PAGE,电泳结束后转膜至NC膜,用5%脱脂奶粉封闭1 h,PBST洗膜5 min,一抗37℃结合1 h,PBST洗膜3次(每次5 min),二抗37℃结合1 h,PBST洗膜3次(每次5 min),加ECL发光试剂检测目的蛋白,GAPDH为内参蛋白。
1.5 细胞形态观察
转染后在不同时间点于光学显微镜下观察AGS细胞的形态,并于转染后24和36 h对伸长的蜂鸟状细胞进行计数。不同型进行6次转染,每次转染3孔,每孔随机截取3张镜下图像,蜂鸟状细胞测量与计数采用ImageJ软件,定义细胞形态针状突出>1.5 μm为蜂鸟状细胞,仅转染空载体的AGS为阴性对照。结果采用Student-Newman-Keulsa(SNK)法进行统计学分析。
1.6 细胞IL-8表达检测
转染后12、36 h分别收集100 μL各型细胞培养上清液,7000 r/min离心10 min,于-80℃储存,
按照OptEIA人IL-8 ELISA检测试剂盒说明进行IL-8表达检测,仅转染空载体的AGS为阴性对照。结果采用SNK法进行统计学分析。
2 结果
2.1 各型cagA基因的优化、合成及质粒的构建与制备
采用重组克隆试剂盒法,对各基因片段进行扩增、回收,将基因片段与载体连接,转化大肠杆菌DH5α,挑选并鉴定携带表1所列CagA各型特征重组质粒的重组菌。测序表明序列正确。
2.2 CagA表达检测
将各型质粒转染AGS细胞,用Western印迹检测CagA的表达,采用ImageJ软件对各型CagA与其对应的内参蛋白GAPDH的比值进行定量分析,发现无统计学差异,说明各型CagA在AGS细胞中均得到了表达,表达水平没有明显差异。
2.3 细胞形态观察
转染cagA的AGS细胞可出现以细胞伸长和扩散为特征的独特形态学改变,形似蜂鸟的嘴,被称为“蜂鸟表型”。在转染后不同时间点对AGS细胞进行镜下观察,可发现与空载体相比较,各型CagA均能引起细胞蜂鸟状改变的增加(NCTC11637株cagA转染AGS细胞后各时间点细胞形态见图2A)。对转染后24、36 h的“蜂鸟表型”细胞进行计数,结果表明各亚型CagA均能引起发生蜂鸟状改变的AGS细胞数量增加。与空载体对照相比较,转染后24和36 h,CagA的6种亚型皆有非常显著差异(P<0.001),CagA ABCCC与其余5种亚型有非常显著差异(P<0.001),CagA ABDD与 CagA ABC 和 CagA J-West⁃ern有非常显著差异(P<0.001);24 h时,CagA ABDD与CagA Amerindian有非常显著差异(P<0.001);36 h时,CagA ABD分别与CagA ABC和Ca⁃gA J-Western有非常显著差异(P<0.01)。

表1 CagA分型及世界分布

图1 Western印迹检测各型CagA的表达A:各型CagA与相应内参蛋白的表达比;B:Western印迹检测转染后空载体及各型CagA的表达;0:pcDNA3.1;1:CagA Amerindian;2:CagA ABD;3:CagA ABC;4:CagA ABDD;5:CagA ABCCC;6:CagA J-Western
2.4 IL-8表达检测
大量实验证明,AGS细胞转染cagA后8~40 h时IL-8处于稳定表达状态,且36 h左右达表达高峰。于转染后12、36 h分别收集100 μL细胞培养上清液,ELISA检测转染各型cagA后细胞的IL-8表达。统计分析表明,转染后12 h,较空载体对照,CagA ABDD存在非常显著差异(P<0.01);转染后36 h,较空载体对照,CagA ABD和CagA J-Western存在非常显著差异(P<0.01),CagA ABDD和CagA ABCCC存在非常显著差异(P<0.001);CagA Amerindian与CagA ABD和CagA J-Western分别存在非常显著差异(P<0.01),与CagA ABDD和CagA ABCCC分别存在非常显著差异(P<0.001);CagA ABDD 和 CagA ABCCC分别与CagA ABD、CagA ABC和CagA JWestern存在非常显著差异(P<0.001)。
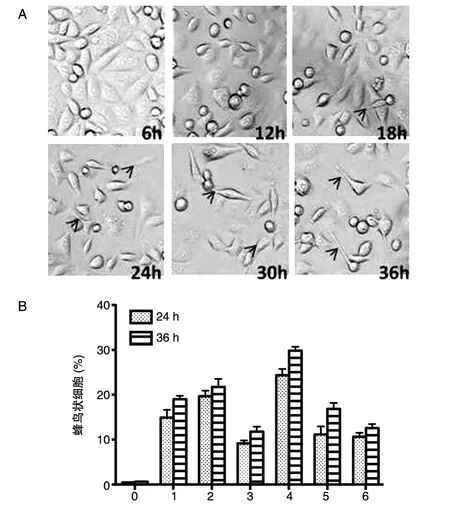
图2 幽门螺杆菌NCTC11637株cagA转染AGS细胞后各时间点的细胞形态(A)及转染后各型蜂鸟状细胞占细胞总数的百分比(B)0:pcDNA3.1;1:CagA ABD;2:CagA ABDD;3:CagA ABC;4:CagA ABCCC;5:CagA Amerindian;6:CagA J-Western
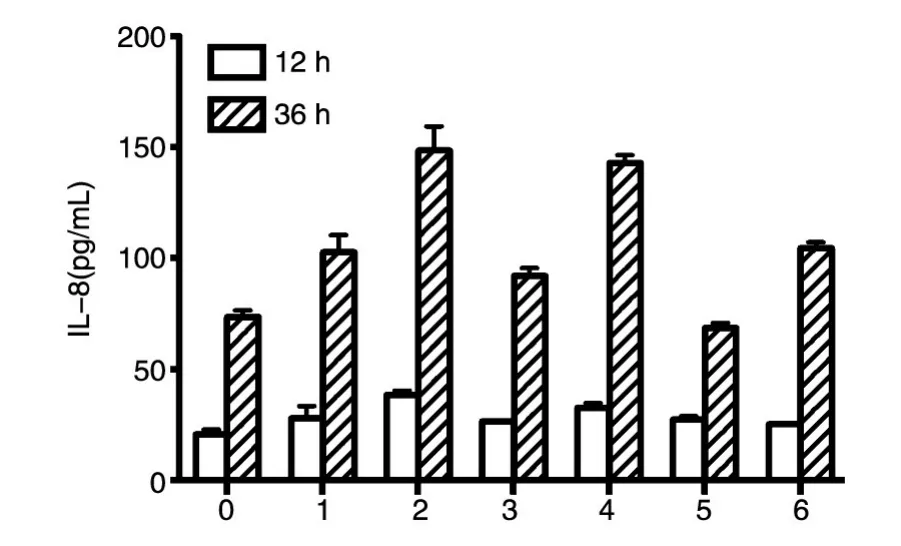
图3 AGS细胞转染各型cagA基因后的IL-8表达
3 讨论
胃癌是一种由多因素引起的疾病,目前CagA阳性的幽门螺杆菌感染在胃癌发病机制中起着至关重要的作用。CagA分型具有地域分布特征,其致病能力也随地域的不同而变化。我们构建含不同CagA分型的质粒转染AGS细胞,旨在消除其他因素对实验结果的干扰,同时对各型CagA序列进行优化,使CagA更好地在哺乳动物细胞中得到表达[13-14]。
SHP-2是蛋白酪氨酸磷酸酶家族成员,其作为一种多功能信号传导蛋白,与细胞生命活动如细胞增殖、分化、移动、死亡的调控密切相关[15-17]。有报道称东亚型CagA与SHP-2的结合能力更强,更能产生强烈的细胞形态改变[18]。此外,含多个EPIYA-C的西方CagA亦拥有更强的与SHP-2结合的能力[19]。细胞是一切生命活动的基础,有报道显示细胞蜂鸟状形态的改变可引起细胞紧密连接的破坏,从而与胃病严重程度相关[6,20]。本实验中,CagA的存在大量增加了AGS蜂鸟状细胞的比例,西方型中,蜂鸟状细胞的形成与EPIYA-C的数量呈正相关;东亚型中,未发现蜂鸟状细胞的形成与EPIYA-D数量的关系。东亚型较西方型产生了更多蜂鸟状细胞,但二者间比较不具有统计学差异。目前尚无证据证明CagA与SHP-2相关引起胃癌的机制,但值得探讨的是,CagA所诱导的蜂鸟状细胞改变很可能与胃黏膜组织的癌变密切相关。
IL-8是趋化因子家族的细胞因子,在炎症形成时可引起中性粒细胞趋化和脱颗粒,引发黏膜局部炎症,导致胃局部炎症-胃癌的发生和发展[21]。有研究显示,CagA阳性的幽门螺杆菌诱导分泌的IL-8水平高于CagA阴性的菌株[22]。大量实验研究了西方型CagA各型与胃病的关系,鲜有研究进行东亚型CagA与西方型CagA的对比。本实验中,CagA的存在增加了IL-8的分泌,IL-8的分泌表达同EPIYA-C和EPIYA-D基序的个数呈正相关。
随着世界人口的流动,目前出现不同于基本分类东亚型和西方型的新型CagA,如在美国出现的CagA Amerindian和在日本冲绳出现的CagA JWestern。本实验中,CagA Amerindian、CagA JWestern分别与空载体、东亚型及西方型间的差异具有统计学意义,这也暗示CagA Amerindian、CagA JWestern与东亚型及西方型间不仅仅是序列的差异,更有可能是由序列的差异引起了宿主细胞功能的差异。有报道称CagA Amerindian与轻度胃炎性疾病相关,而与胃癌关系不大[9,23],这也与本实验中CagA Amerindian所致IL-8表达量相对较低相呼应。
综上所述,幽门螺杆菌CagA蛋白可引起胃上皮AGS细胞蜂鸟状改变及IL-8表达增加,其可变区EPIYA基序C数目的增加与细胞蜂鸟状改变呈正相关,EPIYA基序C和D数目的增加与IL-8表达呈正相关。
[1] Parkin D M.International variation[J].Oncogene,2004,23(8):6329-6340.
[2] Malnick S D,Melzer E,Attali M,et al.Helicobacter pylori:friend orfoe[J]? World JGastroenterol,2014,20(27):8979-8985.
[3] Marshall B J,Windsor H M.The relation of Helicobacter py⁃lori to gastric adenocarcinoma and lymphoma:pathophysiolo⁃gy,epidemiology,screening,clinicalpresentation,treatment,and prevention[J].Med Clin North Am,2005,89(2):313-344.
[4] Ohnishi N,Yuasa H,Tanaka S,et al.Transgenic expression of Helicobacter pylori CagA induces gastrointestinal and hema⁃topoietic neoplasms in mouse[J].Proc Natl Acad Sci USA,2008,105(3):1003-1008.
[5] Neal J T,Peterson T S,Kent M L,et al.H.pylori virulence factor CagA increases intestinal cell proliferation by Wnt path⁃way activation in a transgenic zebrafish model[J].Dis Models Mechanisms,2013,6(3):802-810.
[6] Yamaoka Y.Mechanisms of disease:Helicobacter pylori viru⁃lencefactors[J].NatRevGastroenterolHepatol,2010,7(11):629-641.
[7] Censini S,Lange C,Xiang Z,et al.cag,a pathogenicity is⁃land of Helicobacter pylori,encodes type I-specific and dis⁃ease-associated virulence factors[J].Proc Natl Acad Sci USA,1996,93(25):14648-14653.
[8] Yamaoka Y.Virulence factors of Helicobacter pylori:up-todate[J].Jap J Gastroenterol,2010,107(8):1262-1272.
[9] Kersulyte D,Kalia A,Gilman R H,et al.Helicobacter pylori from Peruvian amerindians:tracesofhuman migrationsin strains from remote Amazon,and genome sequence of an Am⁃erind strain[J].PLoS One,2010,5(11):e15076.
[10]Duncan S S,Valk P L,Shaffer C L,et al.J-Western forms of Helicobacter pylori cagA constitute a distinct phylogenetic group with a widespread geographic distribution[J].J Bacteri⁃ol,2012,194(6):1593-1604.
[11]Backert S,Tegtmeyer N,Selbach M.The versatility of Helico⁃bacter pylori CagA effector protein functions:the master key hypothesis[J].Helicobacter,2010,15(3):163-176.
[12]Brandt S,Kwok T,Hartig R,et al.NF-kappaB activation and potentiation of proinflammatory responses by the Helico⁃bacter pylori CagA protein[J].Proc Natl Acad Sci USA,2005,102(26):9300-9305.
[13]Wright F.The effective number of codons'used in a gene[J].Gene,1990,87(1):23-29.
[14]Rice P,Longden I,Bleasby A.EMBOSS:the European Molec⁃ular Biology Open Software Suite[J].Trends Genet,2000,16(6):276-277.
[15]Saito Y,Murata-Kamiya N,Hirayama T,et al.Conversion of Helicobacter pylori CagA from senescence inducer to oncogen⁃ic driver through polarity-dependent regulation of p21[J].J Exp Med,2010,207(10):2157-2174.
[16]Tsutsumi R,Takahashi A,Azuma T,et al.Focal adhesion ki⁃nase is a substrate and downstream effector of SHP-2 com⁃plexed with Helicobacter pylori CagA[J].Mol Cell Biol,2006,26(1):261-276.
[17]管张燕,王芃,陶好霞,等.幽门螺杆菌CagA蛋白N端片段的表达、纯化及其与磷脂酰丝氨酸的亲和力检测[J].生物技术通讯,2011,22(5):631-635.
[18]Miura M,Ohnishi N,Tanaka S,et al.Differential oncogenic potential of geographically distinct Helicobacter pylori CagA isoforms in mice[J].Int J Cancer,2009,125(11):2497-2504.
[19]Ferreira R M,Machado J C,Leite M,et al.The number of Helicobacter pylori CagA EPIYA C tyrosine phosphorylation motifs influences the pattern of gastritis and the development of gastric carcinoma[J].Histopathology,2012,60(6):992-998.
[20]Sicinschi L A,Correa P,Peek R M,et al.CagA C-terminal variations in Helicobacter pylori strains from Colombian pa⁃tients with gastric precancerous lesions[J].Clin Microbiol In⁃fect,2010,16(4):369-378.
[21]Lee K E,Khoi P N,Xia Y,et al.Helicobacter pylori and in⁃terleukin-8 in gastric cancer[J].World J Gastroenterol,2013,19(45):8192-8202.
[22]Audibert C,Janvier B,Grignon B,et al.Correlation between IL-8 induction,cagA statusand vacA genotypesin 153 French Helicobacter pylori isolates[J].Res Microbiol,2000,151(3):191-200.
[23]Camorlinga-Ponce M,Perez-Perez G,Gonzalez-Valencia G,et al.Helicobacter pylori genotyping from American indige⁃nous groups shows novel Amerindian vacA and cagA alleles and Asian,African and European admixture[J].PLoS One,2011,6(11):e27212.
