常见阿胶伪品的荧光PCR分子检测
2015-05-04陈志宣龚国利
陈志宣, 龚国利
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
常见阿胶伪品的荧光PCR分子检测
陈志宣, 龚国利*
(陕西科技大学 食品与生物工程学院, 陕西 西安 710021)
在普通PCR扩增的基础上,加入一对引物的同时加入一个特异性的荧光探针,使用Real-Time PCR技术对阿胶驴源性成分进行鉴定.将从样品阿胶中提取出的DNA进行实时荧光PCR,使用猪、牛、羊、马、兔、驴的引物和探针进行筛查,结果呈阳性的即为含有此种动物源性成分.市购的三种不同品牌的阿胶使用此方法猪、牛、羊、马、兔均为阴性,驴为阳性结果.Real-Time PCR技术具有省时高效的优点,可一次处理批量样品.
阿胶; 荧光PCR; 检测
0 引言
荧光PCR自1995年由美国Applied Biosystems公司推出开始问世,该技术不仅实现了PCR技术从定性到定量的飞跃,而且比普通PCR特异性更强、操作更加方便快捷,并有效地解决了常规PCR污染及对操作人员健康隐患的问题.目前,荧光PCR已经得到了较为广泛的应用[1].
使用荧光PCR技术必须提到荧光定量PCR仪的使用.荧光定量PCR仪所用的光源为激光器光源,从而保证了高能稳定且无干扰的荧光激发.由一系列的滤镜、透镜和一个双色镜组成的光学系统将激发荧光聚焦到光谱仪上,而光谱仪以间隔的方式将这些荧光按照波长的不同来分开,由CCD相机读取,与荧光定量PCR仪所连接的电脑上安装的序列检测应用软件将从CCD相机中收集那些荧光信号[2],并对数据进行分析.
荧光定量PCR技术在常规PCR的基础上,在PCR扩增过程中加入一对引物的同时加入一个特异性的荧光探针,该探针为一寡核苷酸,两端分别标记一个报告荧光基团和一个淬灭荧光基团[3].探针完整时,报告基团发射的荧光信号被淬灭基团吸收;刚开始时, 探针结合在DNA任意一条单链上;PCR扩增时,Taq酶的5′端-3′端外切酶活性将探针酶切降解,使报告荧光基团和淬灭荧光基团分离,从而荧光监测系统可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步.
本实验选取了市面上常见的三种品牌的阿胶,使用DNAMAN等软件对驴物种进行特异性引物设计,然后对样品阿胶进行Real-Time PCR,旨在从分子水平上对市售阿胶进行真伪鉴定[4,5].
1 材料与方法
1.1 材料、试剂与仪器
1.1.1 实验材料
猪肉、马肉、羊肉、牛肉、兔肉均购于就近农贸市场.收集市面上所售包括东阿阿胶在内的三种品牌的阿胶,产地、采样地以及数量见表1所示.以上样品采集后放置-80 ℃冰箱备用.

表1 采购样品信息
1.1.2 主要试剂
所使用的试剂为氯化钠、Tris盐酸、乙二胺四乙酸二钠、2-巯基乙醇、十二烷基硫酸钠、醋酸钾、氯仿、异戊醇、无水乙醇、十六烷基三甲基溴化铵、PVP、Tris碱、Tris饱和酚,试剂均在天津市红岩化学试剂厂购买,以上试剂均为分析纯.Gene Expression Master Mix为宝生物工程(大连)有限公司生产,引物和探针在上海捷瑞生物科技有限公司合成.
1.1.3 主要仪器
本实验所使用到的仪器:研磨机(MM-301),陕西环宇仪器设备有限公司;电子天平(TXB622L),捷久计量衡器上海有限公司;高速冷冻离心机(TGL-16M),湖南湘仪实验室仪器开发有限公司;净化工作台(SW-CJ-1G),苏州净化设备有限公司;紫外可见分光光度计(UV5200),上海元析仪器有限公司;荧光定量PCR仪(ABI7500),美国ABI公司.
1.2 实验方法
1.2.1 引物和探针设计
利用GenBank数据库中已公布的马科动物驴的基因组序列(图1),采用DNAMAN 6.0.3.99软件进行序列比对,在保守区用Primer Express 5.0根据驴的基因组碱基序列的特异性设计驴的上下引物[6]和探针,引物和探针均由宝生物(大连)有限公司合成.驴以及其他五种动物的引物和探针[7]序列、Tm值与扩增片段大小见表2所示.

图1 驴betaactin基因
表2 引物和探针DNA序列
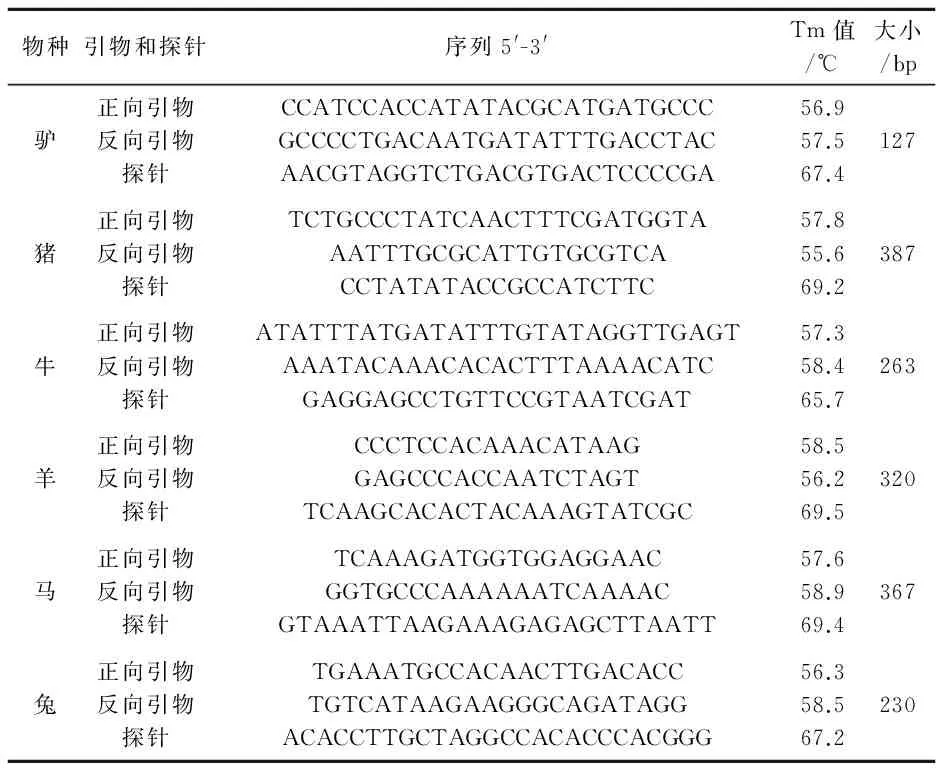
物种引物和探针序列5'-3'Tm值/℃大小/bp驴正向引物反向引物探针CCATCCACCATATACGCATGATGCCCGCCCCTGACAATGATATTTGACCTACAACGTAGGTCTGACGTGACTCCCCGA56.957.567.4127猪正向引物反向引物探针TCTGCCCTATCAACTTTCGATGGTAAATTTGCGCATTGTGCGTCACCTATATACCGCCATCTTC57.855.669.2387牛正向引物反向引物探针ATATTTATGATATTTGTATAGGTTGAGTAAATACAAACACACTTTAAAACATCGAGGAGCCTGTTCCGTAATCGAT57.358.465.7263羊正向引物反向引物探针CCCTCCACAAACATAAGGAGCCCACCAATCTAGTTCAAGCACACTACAAAGTATCGC58.556.269.5320马正向引物反向引物探针TCAAAGATGGTGGAGGAACGGTGCCCAAAAAATCAAAACGTAAATTAAGAAAGAGAGCTTAATT57.658.969.4367兔正向引物反向引物探针TGAAATGCCACAACTTGACACCTGTCATAAGAAGGGCAGATAGGACACCTTGCTAGGCCACACCCACGGG56.358.567.2230
1.2.2 DNA的提取与质量鉴定
由于阿胶为深加工品,特别是在其煎煮过程中驴皮的细胞组织被破坏,DNA部分被分解.所以本实验选择DNA得率较高的SDS提取法[8,9].用0.8%的琼脂糖凝胶电泳来检测提取DNA的质量,并使用朗波-比尔光吸收定律来计算样品DNA浓度[10].
已知A=-lgT=εbc,样品浓度为c=A/εb,又知ε=0.020,在b=1 cm的情况下,c=A/(0.020×1)=50×A,所以初始样品浓度为:50×A×稀释倍数/1 000(mg/mL).
1.2.3Real-TimePCR扩增条件
使用宝生物(大连)有限责任公司合成的引物、探针、mix为原料进行Real-TimePCR扩增[11,12].反应体系为25μL,含mix10μL、去离子灭菌水10μL、上游引物1μL、下游引物1μL、探针1μL、模板DNA 2μL,点于同一96孔PCR板上[13,14].此反应在7 900 ht荧光定量PCR仪上进行,温度控制程序为:95 ℃预变性4 min,45个循环95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,最后72 ℃延伸2 min[15].在96孔的点样板上,每一个品牌的阿胶依次用驴、猪、牛、羊、兔、马六种引物来扩增其序列,由于引物的特异性,扩增成功的小孔会被检测到荧光信号,在显示器上出现图谱.为保证实验结果的准确性,每种引物做三平行.
1.2.4 特异性实验
分别以猪、牛、羊、马、驴、兔的DNA(100 ng/μL)为模板按照方法1.2.3进行实时荧光PCR,来检测引物和探针的特异性[16].
1.2.5 Real-Time PCR最小检测限的测定
检测限是检测方法的重要性能指标,在使用Real-Time PCR仪时,为了使得检测结果不受DNA浓度的干扰,需要测得PCR系统对阿胶中所提取的DNA最小检测浓度.因此,利用浓度梯度分别进行点样出图,以仪器所能够检测到的最小DNA浓度作为Real-Time PCR仪的最小检测限[17].阿胶DNA浓度梯度如表3所示.
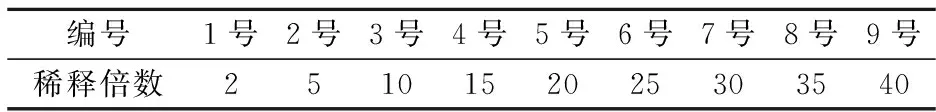
表3 阿胶DNA浓度梯度
1.2.6 市售样品的实际检测
使用在药房购买的三种品牌的阿胶,分别进行荧光PCR检测,根据反应结束后检测器检测到的荧光信号所给出的谱图与Ct值[18],来分析样品中是否含有该引物的物种成分.Ct值则可以反映DNA模板的质量、浓度与反应体系是否协调.Ct值过高,说明体系中模板浓度太小;Ct值过低,说明模板浓度太高,一般标准Ct值在25左右.
2 结果与讨论
2.1 引物探针特异性
分别以猪、牛、羊、马、驴、兔的DNA(100 ng/μL)为模板按照方法1.2.3进行实时荧光PCR,来检测引物和探针的特异性.结果表明,六种动物来源的DNA检测结果为阳性(图2~图7),不使用此物种引物的其他物种在45个循环内均无出现扩增(表4),可见针对目标物种的引物和探针的特异性良好.

表4 引物和探针特异性实验

图2 驴引物和探针特异性实验
图3 猪引物和探针特异性实验

图4 牛引物和探针特异性实验
图6 马引物和探针特异性实验

图7 兔引物和探针特异性实验
2.2 最小检测限样品DNA浓度的确定
使用表3的浓度梯度,将样品稀释到表中浓度,在260 nm的波长下测量其OD值,按上述朗波-比尔定律计算DNA浓度.
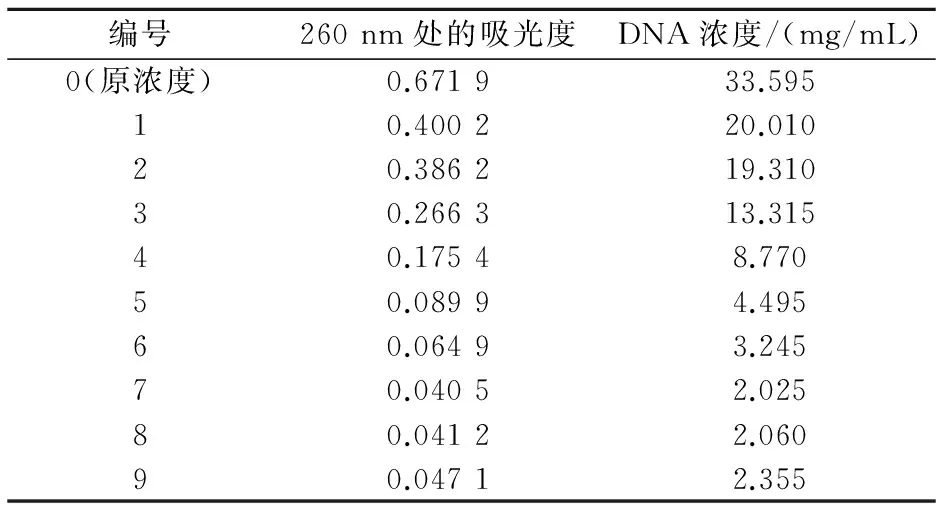
表5 DNA浓度梯度

图8 DNA浓度与Ct值曲线
如表5所示,通过测得不同稀释倍数的DNA溶液在260 nm处的吸光度值,根据朗波-比尔定律公式c=A/εb计算得知DNA浓度.图8为在不同稀释倍数下,DNA浓度与Real-TimePCR结果的Ct值形成的曲线.如图所示,在Ct值为25时,对应的是4号,也就是稀释15倍,此时的DNA浓度是PCR最适浓度为12.5mg/mL.Ct值曲线在后期有一个平台期,这个时期PCR仪所显示的数据已经不能够说明实验结果,此时的DNA浓度已经低于仪器检测灵敏度,所对应的DNA浓度为3.8mg/mL,这个浓度为Real-TimePCR的最小检测限.
2.3 市售样品的实际检测
使用上述方法将东阿、福胶、同仁堂三个品牌的阿胶进行荧光PCR检测,每一个样品都用猪、牛、羊、马、驴、兔的引物与探针进行反应.结果如表6所示.
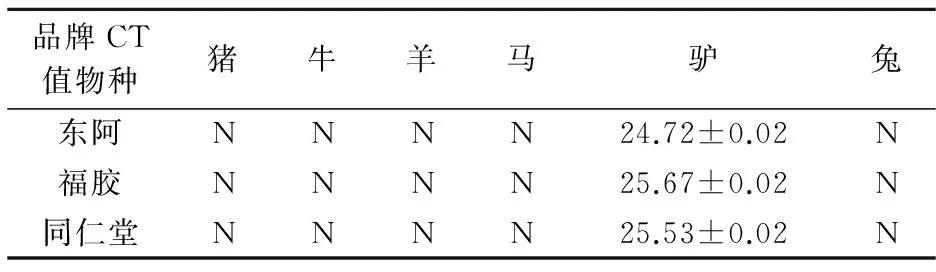
表6 市售阿胶样品鉴定结果

图9 市售阿胶样品鉴定结果
如图9所示,东阿、福胶以及同仁堂的阿胶驴源性成分均有检出,而其余物种检测结果均为阴性,说明市售的三种阿胶均不含有猪、牛、羊、马、兔这五种动物源性成分.三种品牌的阿胶,每种做三组平行试验结果为图中所示九条阳性荧光曲线,这三种品牌阿胶的平均Ct值分别为:24.72、25.67、25.53,均在25上下波动,说明从阿胶中所提取的DNA为驴源性成分,为驴产品无疑.
3 结束语
阿胶中驴源性成分的鉴定属于中药材鉴定范畴,对于此类问题此前一般采用质谱或色谱分析的方法解决,但是这些鉴定方法存在技术操作复杂、鉴定准确性低以及重现性差等问题.目前,较先进的物种鉴定方法是采用分子技术手段.自从1985年Karny Mullis发明了聚合酶链式反应以来,PCR技术已成为分子生物学研究中使用最多、最广泛的手段之一,而引物设计是PCR技术中至关重要的一环.
使用不合适的PCR引物容易导致实验失败:表现为扩增出目的带之外的多条带(如形成引物二聚体带),不出带或出带很弱等.现在PCR引物设计大都通过计算机软件进行,可以在本地计算机上运行引物设计专业软件.
在本实验中,对于驴物种基因片段的分析,应用DNAMAN 6.0.3.99、Primer Express 5.0、Oligo 6 等引物设计软件得到一对能特异性扩增驴产品的鉴别引物.而通过本实验的后续5种常见动物源性引物复筛,其结果皆为阴性扩增,更加说明了所设计的驴引物的特异性.
本实验中使用荧光PCR对市场中可能存在的伪品阿胶的动物来源做了调研,确定了以猪、牛、羊、马、驴、兔在内的六种动物作为排查范围,建立了检测体系,通过本实验的研究,说明基于荧光PCR技术上的对阿胶动物源性检测具有高特异性、高灵敏度,且重复性好、定量准确、自动化程度高、全封闭反应等优点,是辨别阿胶真伪的有效手段.此实验的开展,也为其他肉类食品的动物来源提供了检测方案.
[1] 宗 卉,曾少灵,林庆燕,等.饲料中马、驴源性成分的分子检测技术[J].中国草食动物,2005,25(5):3-6.
[2] 任 亮,朱宝芹,张轶博,等.利用Primer Premier 5.0进行PCR引物的研究[J].锦州医学院学报,2004,25(6):43-46.
[3] 雷初朝,陈 宏,杨公社,等.中国驴种线粒体DNA D-Loop多态性研究[J].遗传学报,2005,32(5):481-486.
[4] 孙伟丽.中国四个地方驴品种mtDNA D-Loop部分序列分析与系统进化研究[D].杨凌:西北农林科技大学,2002.
[5] Harrison S P,Turrion Gomez J L.Mitochondrial DNA:An important famele contribution to thoroughbred racehorse performance[J].Mitochondrion,2006,6:53-66.
[6] 陈 颖,吴亚君,徐宝梁,等.食品及饲料中马属动物源性成分的PCR检测研究[J].中国生物工程杂志,2004,24(5):78-83.
[7] 雷明刚,戴丽荷,李凤娥,等.猪氟烷基因PCR-RFLP检测新引物设计与条件优化[J].养殖与饲料,2005,4(10):52-54.
[8] 侯东军,杨红菊,姜艳彬,等.利用PCR技术鉴定牛羊肉中搀杂猪肉的方法研究[J].宁波农业科技,2009,37(3):41-43.
[9] 曹际娟,卢行安,秦 成,等.实时荧光PCR技术检测MBM中牛羊源性成分的方法[J].生物技术通讯,2002,13(2):158-160.
[10] 高 博,杨晓农,于学辉,等.家兔GAPDH基因实时荧光定量RT-PCR方法的建立[J].中国驯牧兽医,2010,37(1):69-72.
[11] 王全喜,红 海,芒 来.蒙古马肌生成抑制基因(MSTN)的克隆及序列分析[J].华北农学报,2006,21(5):45-49.
[12] 王 冲,谭亚娣,郭爱珍,等.家猫ACE2基因克隆、测序及生物信息学分析[J].武汉大学学报(理学版),2005,76(6):18-21.
[13] 饶 刚,李 明,牛屹东,等.陈旧皮张中DNA提取的新方法[J].动物学杂志,2001,36(4):53-57.
[14] 黄大鹏,陈建华.全血中DNA的5种不同提取方法比较研究[J].动物医学进展,2006,27 (6):96-99.
[15] Calvo J H,Zaragoza P,Osta R.Technical note:A quick and more sensitive method to identify pork in processed and unprocessed food by PCR amplification of a new specific DNA fragment[J].J Anim Sci,2001(79):2 108-2 112.
[16] Soichi T,Eiji M,Kazuhiro M,et al.PCR method of detecting pork in foods for verifying allergen labeling and for identifying hidden pork Ingredients in processed foods[J].Biosci Biotechnol Biochem,2007,71(7):1 663-1 667.
[17] 潘良文,陈家华,丁 燕,等.进口肉骨粉中牛成分检测研究[J].生物技术通报,2001,17(5): 23-26.
[18] 刘文义,王莉丽.阿胶补益成分分析方法的研究进展[J].齐鲁药事,2009,28(11):682-684.
PCR fluorescence detection of common adulterants Ejiao
CHEN Zhi-xuan, GONG Guo-li*
(School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China)
Common PCR reaction system have only one pair of primers,but fluorescent PCR reaction also need to add a fluorescent probe.This study using Real-Time PCR technology to identified donkey donkey-derived ingredients.Extracting the gelatin DNA as a template of PCR system.Use the primers and probes of pig,cattle,sheep,horse,rabbit, donkey for screening, positive results of animal origin shall contain such ingredients.Three different brands of commercially available gelatin using this method,the experimental results is that the pig,cattle,sheep,horse,rabbit were negative,donkey is positive results.Real-Time PCR technique is a method of saving time,and can used in mass detection.
Ejiao; Real-Time PCR; detection
2015-03-17
国家自然科学基金项目(20906058); 陕西科技大学学术骨干培育计划项目(XSG2010009)
陈志宣(1989-),女,陕西咸阳人,在读硕士研究生,研究方向:中药学通讯作者:龚国利(1976-),男,内蒙古丰镇人,教授,博士,研究方向:微生物发酵,84838702@qq.com
1000-5811(2015)03-0135-05
R285
A
