土壤含水量对刺槐光合能力和碳水化合物分配的影响
2015-05-03孙永林刘西平
王 昕,孙永林,刘西平
(西北农林科技大学 生命科学学院,陕西 杨陵 712100)
植物通过光合作用将太阳光能转变为化学能,同时将空气中的CO2固定并还原为碳水化合物。光合作用同化的碳水化合物一部分用于光合器官的生长发育、呼吸消耗,多余的部分被运输到茎干和根系,用于这些非光合器官的生长发育、呼吸消耗和贮存[1-2]。可溶性糖和淀粉是植物体内非结构性碳水化合物的主要形式,其含量反映着碳水化合物的内部有效性。当植物的代谢过程所需的碳水化合物不能直接由光合作用获取时,这些非结构性碳水化合物会被消耗利用[3-4]。因为可溶性糖是碳水化合物运输的主要形式,也直接参与代谢过程,而淀粉是碳水化合物的贮存形式,因此,可溶性糖与淀粉之间的转化、以及二者的含量不仅影响着各个器官的生长发育过程,也影响着植物对环境中各种生物和非生物胁迫的抵御能力[5-6]。
在干旱半干旱地区,由于降水量小、而蒸发量大,水分成为限制植物生长发育和生存的主要非生物学限制因子[7-10]。在轻度水分胁迫下,植物叶片气孔开张度降低或关闭,阻碍CO2进入叶片从而引起叶片光合速率下降[7,11]。而在严重干旱情况下,叶绿体结构破坏、叶绿素含量以及光合作用过程中相关酶活性的降低、叶肉细胞对CO2的固定和还原能力下降,而引起光合速率进一步下降[8-9,12-15]。当叶片光合速率下降、制造的碳水化合物减少时,植物通过调节碳水化合物在不同器官中的分配来提高其内部的利用效率,以保证在干旱条件下的生存和生长发育。前人也报道了干旱胁迫条件下植物叶片光合速率的下降而引起的叶片光合产物含量降低和输出量减少[2,16-17],以及同化物在不同器官中的转移和运输[18]。然而,关于干旱条件下非结构性碳水化合物在植物各个器官中的分配研究较少[2-3]。
刺槐(Robiniapseudoacacia)是我国西北干旱半干旱地区、特别是黄土高原主要的造林树种,在黄土高原的植被恢复和生态建设中发挥着重要的作用[19-21]。本研究以1年生刺槐幼苗为对象,采用盆栽试验进行不同土壤水分含量处理,通过测定光合特征参数以及可溶性糖和淀粉在不同器官中的单位鲜重含量及总量,以分析土壤含水量对刺槐光合能力和碳水化合物在植物不同器官中分配的影响。
1 材料与方法
1.1 试验地概况
盆栽试验在陕西杨陵西北农林科技大学旱区节水农业研究院内进行。海拔521 m;多年平均气温12.9℃,极端最高气温42℃,极端最低气温-19.4℃;年平均日照时数2 150 h,年均降水量632 mm,年均蒸发量1 500 mm,属大陆性暖温带季风气候。
1.2 材料
选用西北干旱半干旱地区常用的造林树种刺槐的1年生苗木作为材料。2013年3月23日,选取大小均一、生长状况良好的刺槐幼苗,单株栽植于直径30 cm、高35 cm,体积约为25 L的塑料桶中。桶中插一根直径1.5 cm、长40 cm的PVC管直到盆底,用于补充水分,并保证补充的水分在底部的均匀分布。桶中装有来自于当地农田深层的褐壤土和蛭石混合物(v/v=1∶1),约9.0 kg(干重8.163 kg)。苗木栽植后,正常供水,使土壤含水量维持在田间持水量的(70±5)%,以保证其萌芽及早期正常生长。生长约45 d后,对刺槐幼苗进行不同水分梯度处理。试验共设置适宜水分、中度干旱和重度干旱等3个土壤水分梯度,其对应的土壤含水量分别维持为田间持水量的(70±5)%、(50±5)%和(35±5)%,每个水分处理设6盆重复。盆栽苗露天生长,若遇雨天,则置于遮雨棚内以避免降雨对土壤含水量的影响。每天傍晚用电子天平称重,计算出当天植物蒸腾作用和桶中裸露土壤蒸发损失的水分体积(即每天耗水量),然后补充水分使土壤含水量维持在设定范围内。水分胁迫处理期间,不断增加的苗木自身重量在计算耗水量时也考虑在内。收样前一天,测定光合相关参数的日变化及光响应曲线。7月9日,在水分处理8周后,对植物材料进行收样。收样时,分别收集刺槐的叶片、茎干、粗根(直径≥1 mm)和细根(直径<1 mm)。称取鲜重后,立刻用液氮进行冷冻,用液氮研磨成粉状后保存于-80℃冰箱内,用于生理生化指标测定。
1.3 测定指标与方法
1.3.1 光合参数的日变化和光响应曲线测定及拟合 光合日变化测定:2013年7月8日,晴朗天气条件下,使用美国LI-COR公司生产的Li-6400XT便携式光合仪测定刺槐幼苗叶片的蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)和净光合速率(Pn)[10]。测定从7:00开始至19:00结束,每隔2 h测定1次。测定时,在每组处理中选择4株植株,每株按不同方位选择枝条中上部3片健康叶片进行测定。测定时使用仪器内置的LED光源,每次测定时根据当时的实际外部光强来设置内置光源强度。测定当日的大气温度和光合有效辐射(表1)。
光响应曲线测定:利用测定光合日变化时选定叶片的对生叶片,于9:00-11:00测定光响应曲线。采用CO2小钢瓶将叶室CO2浓度控制为380μmol·mol-1,并根据大气温度将叶室温度设定为32℃。利用内置的LED光源在光合有效辐射强度为0、20、50、100、200、500、800、1 000、1 200、1 500、2 000、2 500μmol·m-2·s-1时测定不同水分条件下刺槐叶片的光响应曲线,采用Farquhar模型来分析水分胁迫后刺槐的光响应特性[10-11]。

表1 测定光合日变化时大气温度及光合有效辐射变化Table 1 Diurnal variations of air temperature and environmental photosynthetic active radiation(PAR)on the measuring day
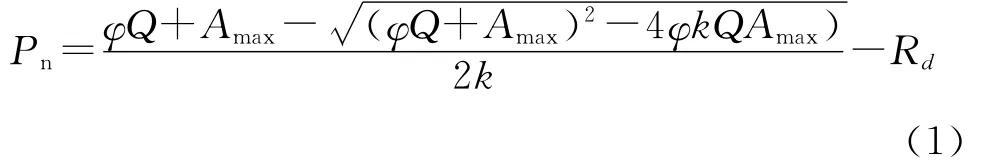
公式中,Pn为净光合速率;Amax为一定CO2浓度下最大净光合速率;Q为光响应曲线的初始斜率,即表观光合量子效率AQY;φ为光合有效辐射PAR;k为曲角,表示光响应曲线的弯曲程度;Rd为暗呼吸速率。当PAR<200μmol·m-2·s-1时,对PARPn进行直线回归,计算光补偿点(LCP)、光饱和点(LSP)和表观量子效率(AQY)等参数。将200 μmol·m-2·s-1以下的线性方程,与非直线双曲线模型计算出的Amax值和X轴这2条平行直线相交,得出交点[22]。其与X轴的交点数值即为LCP,而与Amax在X轴上的交点数值则为LSP。
1.3.2 单位鲜重可溶性糖含量的测定 采用蒽酮比色法测定组织中的可溶性糖含量[23]。称取30 mg研磨成粉状的样品,加入1 mL蒸馏水,沸水浴10 min。冷却后,在4℃下12 000 r·min-1离心5 min。取0.2 mL上清液与1 m L蒽酮试剂混匀,沸水浴10 min中。冷却后,在620 nm波长下进行比色测定。
1.3.3 单位鲜重淀粉含量的测定 利用HCl O4将淀粉降解成可溶性糖[23],然后通过测定可溶性糖的含量,用单位鲜重中葡萄糖的含量表示淀粉含量。
1.3.4 各器官中可溶性糖和淀粉总量的计算 根据不同水分处理下各个器官的生物量及其相应的单位鲜重的可溶性糖或淀粉含量来计算各个器官可溶性糖和淀粉总量[6],即:器官中总量(μmol/器官)=生物量(g)×单位鲜重含量(μmol·g-1)。
1.4 数据分析
本试验每种水分处理设置6个重复。测定数据先用Excel软件进行处理,通过SPSS 17.0软件统计分析(p<0.05),用Origin 8.0作图。
2 结果与分析
2.1 土壤含水量对光合参数日变化及光合特征参数的影响
刺槐幼苗每天蒸腾散失的土壤水分在傍晚进行补充,因而,各处理间刺槐幼苗光合参数的日变化均呈现出相同的变化趋势(图1)。一天当中,衡量气孔传导能力的Gs在7:00-9:00间维持在相对高的水平,之后显著下降直到黄昏;但与适宜水分相比,中度和重度干旱下植株叶片的Gs明显低于适宜水分条件下生长的植株,其中在9:00-13:00间,重度干旱下Gs降低具有显著性(图1A)。Tr从7:00开始持续升高,11:00达到最高值,之后持续降低;但与适宜水分相比,重度干旱导致Tr显著下降(图1B)。Ci在清晨和傍晚的水平显著高于一天中的其他时间(9:00-17:00);不同土壤水分含量对Ci日变化没有显著影响(图1C)。Pn日变化和Tr、Gs相似,和适宜土壤水分含量的处理相比,重度干旱下Pn显著下降(图1D)。
根据光响应曲线拟合的光合特征参数(表2)表明,随着土壤含水量的降低,植物叶片最大光合能力的Amax显著降低;而暗呼吸速率显著增加;LCP显著提高的同时,LSP逐渐降低,因此,光合有效辐射范围随着水分含量的降低而减小;光合量子产量也逐渐下降。
2.2 土壤含水量对不同器官生物量分配的影响
从图2A可以看出,当土壤含水量减少时,中度和重度干旱均引起刺槐地上部分(叶片和茎干)生物量的显著下降,这种显著性差异也表现在中度和重度水分胁迫之间的对比。与正常水分条件相比,中度和重度干旱也引起粗根生物量的下降,但这种响应不具有统计学的显著性。然而,如同对叶片和茎干生物量的效应,中度和重度干旱均引起细根生物量的显著降低。由于干旱引起的地上部分生长量减少的幅度大于地下部分减少的幅度,随着土壤水分的减少,根苗比而显著增大(图2B)。
2.3 土壤含水量对不同器官单位鲜重可溶性糖含量的影响
尽管叶片是碳水化合物制造的主要部位,但刺槐叶片中可溶性糖的含量明显低于茎干和粗根、而高于细根中的糖浓度(图3)。干旱会引起光合速率和碳同化能力的降低,但在本研究中,这种负向效应在叶片可溶性糖的含量上却没有明显的表现出来;在中度和重度干旱下,茎干、粗根和细根中的糖浓度反而明显升高,而且,在中度和重度干旱下粗根中糖浓度的增加、以及重度干旱下细根中糖浓度的增加均具有显著性。
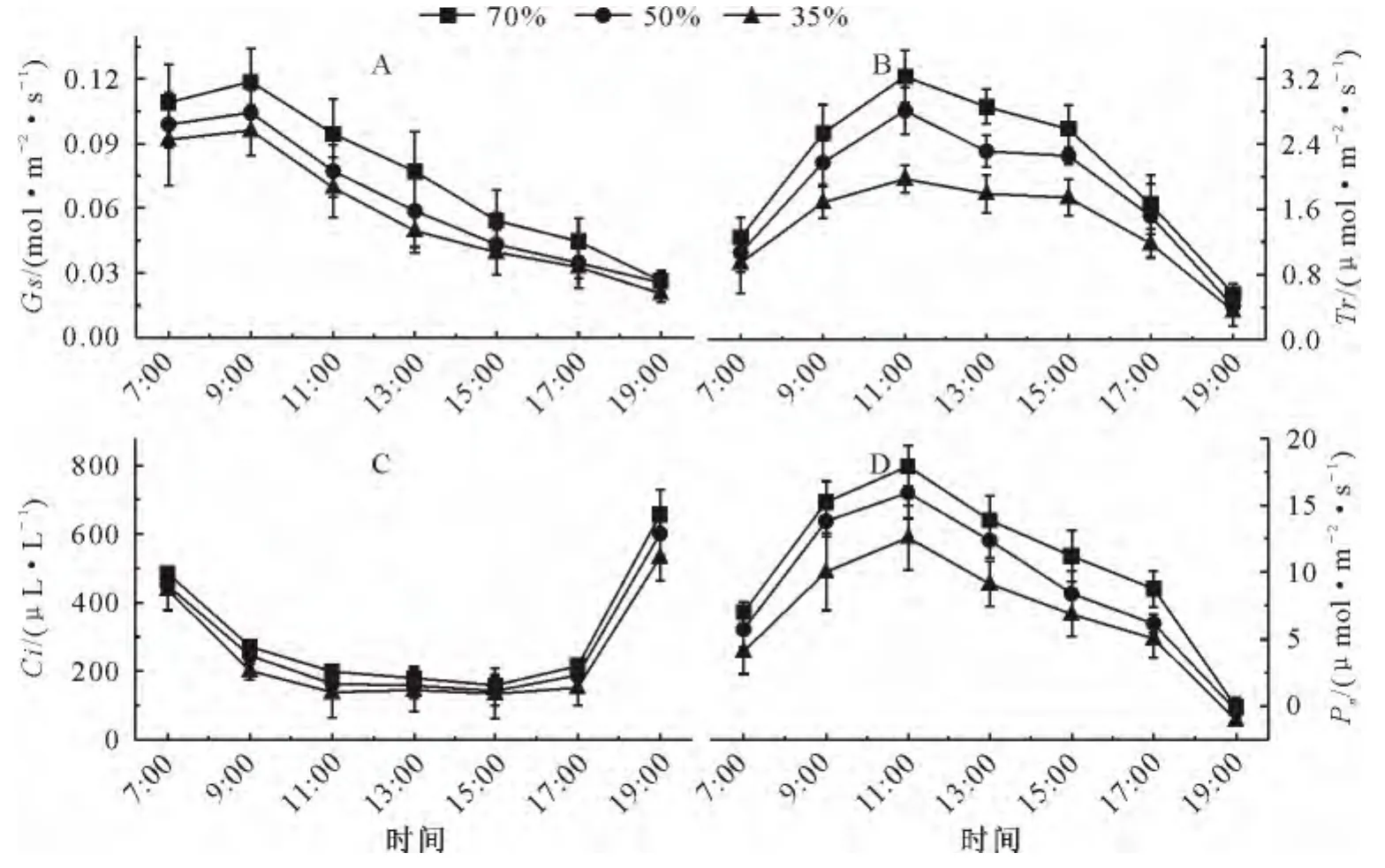
图1 不同土壤水分条件下刺槐叶片主要光合参数日变化Fig.1 Diurnal variations of main photosynthetic parameters of R.pseudoacacia leaves under different soil water conditions

表2 不同土壤水分条件下刺槐叶片的光合特征参数Table 2 Photosynthetic parameters of leaves of R.pseudoacacia growing under different soil water contents
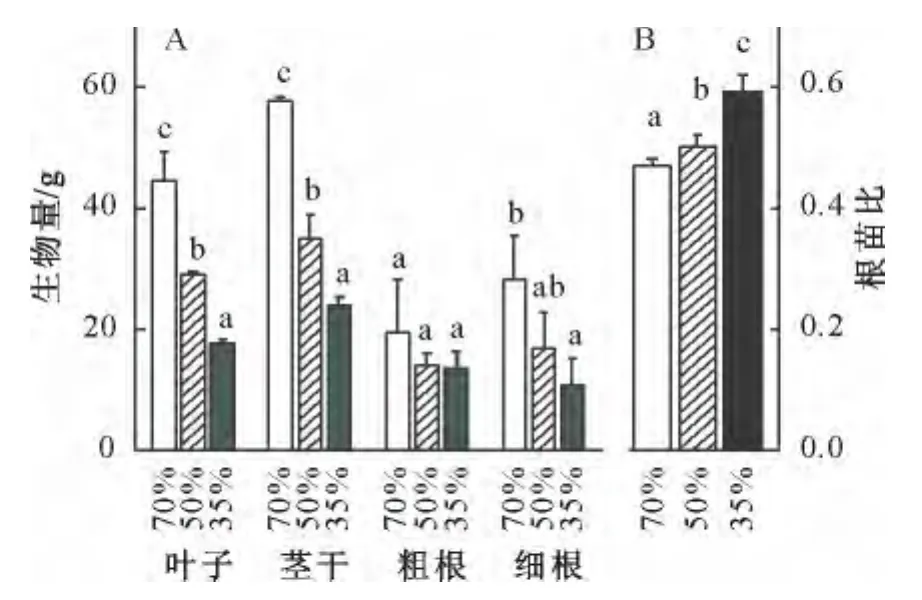
图2 土壤含水量对刺槐不同器官生物量的影响Fig.2 Effects of soil water contents on biomass of different organs of R.pseudoacacia seedlings
2.4 土壤含水量对不同器官单位鲜重淀粉含量的影响
与可溶性糖含量的变化不同,当土壤含水量降低时,中度和重度干旱均引起叶片中淀粉含量的降低(图4)。但与可溶性糖含量变化趋势一致,茎干、粗根和细根这些非光合器官中淀粉的含量却表现出增加的趋势,而且,在重度干旱下,细根中的淀粉含量显著增加。
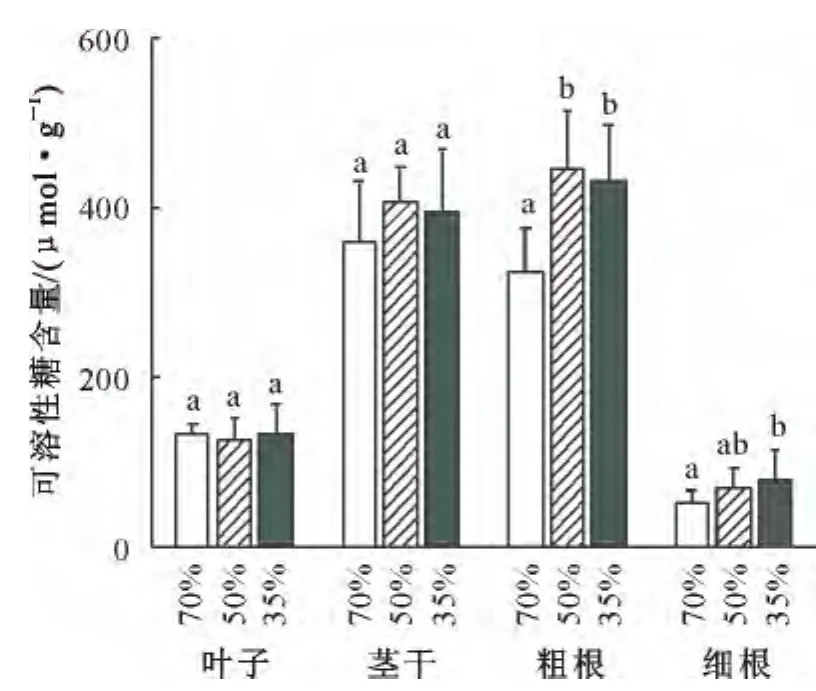
图3 土壤含水量对刺槐各个器官中可溶性糖含量的影响Fig.3 Effects of soil water contents on soluble sugar contents in different organs of R.pseudoacacia seedlings
2.5 土壤含水量对不同器官中可溶性糖总量的影响
基于干旱对刺槐各个器官发育的影响,当土壤水分含量降低时,叶片和茎干以及细根中可溶性糖总量显著减少,但对粗根中可溶性糖的分配没有显著影响(图5)。综合来看,在干旱条件下,地上器官可溶性糖分配的减少量显著高于地下器官的减少量。
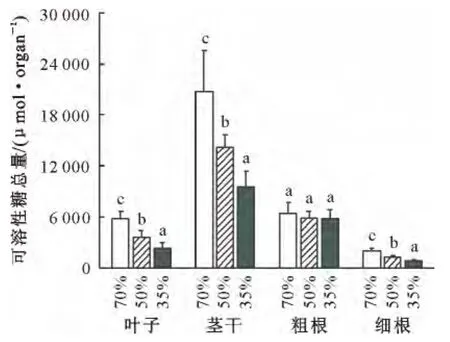
图5 土壤含水量对刺槐各个器官中可溶性糖总量的影响Fig.5 Effects of soil water contents on the total contents of soluble sugar in different organs of R.pseudoacacia seedlings
2.6 土壤含水量对不同器官中淀粉总量的影响
与可溶性糖总量的变化趋势一致,土壤含水量降低也引起叶片和茎干以及细根中淀粉总量的减少,但对粗根中淀粉总量没有显著影响(图6)。因此,在干旱条件下,当叶片的光合作用受到抑制、碳水化合物的同化降低时,分配给地上器官的碳水化合物的数量显著减少,有限的碳水化合物更多地分配给地下器官。
3 结论与讨论
环境条件不仅影响植物叶片和根系对大气中CO2和土壤中营养物质的吸收和同化,而且也影响着同化物在植物不同器官之间的运输和分配[18]。作为影响植物生长、发育和代谢过程重要的非生物学胁迫之一,干旱通过影响气孔和非气孔因素引起光合作用和碳同化速率、以及生长和生产力的下降[24-25]。但是,当叶片光合速率下降、制造的碳水化合物减少时,植物如何通过调节碳水化合物在不同器官中的分配来提高其内部的利用效率、以保证在干旱条件下的生存和生长发育报道较少。
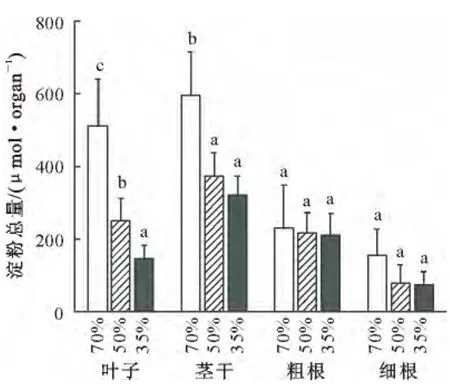
图6 土壤含水量对刺槐各个器官中淀粉总量的影响Fig.6 Effects of soil water contents on the total contents of starch in different organs of R.pseudoacacia seedlings
同化物在植物不同器官之间的分配取决于代谢源和代谢库的大小以及在二者之间的运输能力。环境条件通过影响“源”的同化能力、“库”的需求以及“源”和“库”之间的运输来改变同化物在植物体内的分配,进而引起不同器官生长速率的变化,以适应变化的外部条件。本研究结果表明,土壤含水量降低使刺槐叶片的光合能力下降,但根苗比增大,说明植物将更多的同化物分配给地下器官,用于根系的生长,因此,干旱对地上器官生长量的影响明显大于对根系生长量的影响,这也是植物对水分胁迫的适应性响应[27-28]。这与传统的“干长根、湿长苗”的说法是一致的。本研究中,在干旱条件下,刺槐叶片中单位鲜重可溶性糖含量维持在与对照相同的水平可能是自身的一种保护作用,以防止可溶性糖含量降低对光合作用的反馈刺激,同时,可以保持叶片一定的渗透调节能力,防止叶片过度散失水分[6,29-31]。另一方面,当光合作用受到抑制、碳同化速率降低时,用于叶片生长的碳水化合物减少,表现为叶片生物量的显著降低,进而引起叶片贮存的非结构性碳水化合物总量显著下降。因而,有限的碳可能被分配到茎干、粗根和细根中,引起这些非光合器官中单位鲜重可溶性糖和淀粉含量的增加。非结构性碳水化合物(特别是可溶性糖)含量的增加可能有助于这些器官通过渗透调节来维持一定的含水量,但这种增加是以生长量的降低来实现的。
本研究的结论是,干旱胁迫引起刺槐叶片光合能力的下降;植物通过降低叶片、茎干和细根的生长量使叶片维持较高的可溶性糖含量;通过降低叶片中淀粉含量,将有限的碳水化合物分配给茎干、粗根和细根,以维持这些非光合器官较高的非结构性碳水化合物的含量,并增大根苗比,以适应外部干旱的环境条件。
[1] MULLER B,PANTIN F,GÉNARD M,etal.Water deficits uncouple growth from photosynthesis,increase C content,and modify the relationships between C and growth in sink organs[J].Journal of Experimental Botany,2011,62(6):1715-1729.
[2] LOESCHER W H,MCCAMANT T,KELLER J D.Carbohydrate reserves,translocation,and storage in woody plant roots[J].HortScience,1990,25(3):274-281.
[3] STITT M.Rising CO2 levels and their potential significance for carbon flow in photosynthetic cells[J].Plant,Cell and Environment,1991,14:741-763.
[4] HOELL W.Storage and mobilisation of carbohydrates and lipids[C]//RENNENBERG H,ESCHERICH W,ZIEGLER H.Trees-contributions to modern,Tree Physiology.Leiden:Bacjhuys Publish,1997:197-211.
[5] HEIZMANN U,HREUZWIESER J,SCHNITZLER J P,et al.Assimilate transport in the xylem sap of pedunculate oak(Quercusrobur)saplings[J].Plant Biology,2001,3:132-138.
[6] LIU X P,KOZOVITS A R,GRAMS T E E,etal.Competition modifies effects of enhanced ozone/carbon dioxide regimes on the carbohydrate and biomass partitioning in juvenile spruce and beech[J].Tree Physiology,2004,24:1045-1055.
[7] 程量,林良斌.作物耐旱性生理生化指标研究进展[J].中国农学通报,2014,30(3):27-31.CHENG L,LIN L B.The research progress of physiological and biochemical indexes about drought tolerance in crop[J].Chinese Agricultural Science Bulletin,2014,30(3):27-31.(in Chinese)
[8] TERAZA W,MITCHELL V J,DRISCOLL S D,etal.Water stress inhibits plant photosynthesis by decreasing coupling factor and ATP[J].Nature,1999,401:914-917.
[9] PARRY M A J,ANDRALOGC P J,KHAN S,etal.Rubisco activity:Effects of drought stress[J].Annals of Botany,2002,89:833-839.
[10] LIU X P,FAN Y Y,LONG J X,etal.Effects of soil water and nitrogen availability on photosynthesis and water use efficiency ofRobiniapseudoacaciaseedlings[J].Journal of Environmental Sciences,2013,25(3):585-595.
[11] WANG P T,SONG C P.Guard cell signalling for hydrogen peroxide and abscisic acid[J].New Phytologist,2008,178(4):703-718.
[12] 周朝彬,宋于洋,王炳举,等.干旱胁迫对胡杨光合和叶绿素荧光参数的影响[J].西北林学院学报,2009,24(4):5-9.ZHOU C B,SONG Y Y,WANG B J,etal.Effects of drought stress on photosynthesis and chlorophyll fluorescence parameters ofPopuluseuphratica[J].Journal of Northwest Forestry University,2009,24(4):5-9.(in Chinese)
[13] DIAS M C,BRUGGEMANN W.Limitations of photosynthesis inPhaseolusvulgarisunder drought stress:gas exchange,chlorophyll fluorescence and Calvin cycle enzymes[J].Photosynthetica,2010,48:96-102.
[14] MARKELZ R J C,STRELLNER R S,LEAKEY A D B.Impairment of C4 photosynthesis by drought is exacerbated by limiting nitrogen and ameliorated by elevated[CO2]in maize[J].Journal of Experimental Botany,2011,62(9):3235-3246.
[15] 李秀媛,刘西平,DUONG H,等.美国海滨桤木和薄叶桤木水分生理特性的比较[J].植物生态学报,2011,35(1):73-81.LI X Y,LIU X P,DUONG H,etal.Comparison of waterrelated physiological characteristics ofAlnusmaritimaandA.incanagrowing in America[J].Chinese Journal of Plant E-cology,2011,35(1):73-81.(in Chinese)
[16] DENG X P,JOLY R J,HAHN D T.The influence of plant water deficit on distribution of14C-labelled assimilates in cacao seedlings[J].Annals of Botany,1990,66(2):211-217.
[17] 柴成林,李绍华,徐迎春.水分胁迫期间及胁迫解除后桃树叶片中的碳水化合物代谢[J].植物生理学通讯,2001,37(6):495-498.CHAI C L,LI S H,XU Y C.Carbohydrate metabolism in Peach Leaves during water stress and after stress relief[J].Plant Physiology Journal,2001,37(6):495-498.(in Chinese)
[18] LEMOINE R,LA CAMERA S,ATANASSOVA R,etal.Source-to-sink transport of sugar and regulation by environmental factors[J].Frontiers in Plant Science,2013,4:1-21.
[19] 孙长忠,黄宝龙,陈海滨,等.黄土高原人工植被与其水分环境相互作用关系研究[J].北京林业大学学报,1998,20(3):7-14.SUN C Z,HUANG B L,CHEN H B,etal.Interaction between soil water conditions and different kinds of artificial plant cover in the Loess Plateau[J].Journal of Beijing Forestry University,1998,20(3):7-14.(in Chinese)
[20] 王力,邵明安,李裕元.陕北黄土高原人工刺槐林生长与土壤干化的关系研究[J].林业科学,2004,40(1):84-91.WANG L,SHAO M A,LI Y Y.Study on relationship between growth of artificialRobiniapseudoacaciaplantation and soil desiccation in the Loess Plateau of Northern Shaanxi Province[J].Scientia Silvae Sinicae,2004,40(1):84-91.(in Chinese)
[21] 薛敏,张文辉,杜盛.黄土高原刺槐群落优势植物水分生理生态研究[J].西北林学院学报,2011,26(1):27-34.XUE M,ZHANG W H,DU S.Water physio-ecology of 12 dominant species in theRobiniapseudoacaciacommunity in Yan’an Gonglu Mountain[J].Journal of Northwest Forestry University,2011,26(1):27-34.(in Chinese)
[22] 许大全.光合作用效率[M].上海:上海科学技术出版社,2002.
[23] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006.
[24] PINHEIRO C,CHAVES M M.Photosynthesis and drought:can we make metabolic connections from available data[J].Journal of Experimental Botany,2011,62:869-882.
[25] SAPETA H,COSTA J M,LOURENCO T,etal.Drought stress response inJatrophacurcas:growth and physiology[J].Environmental and Experimental Botany,2013,85:76-84.
[26] 宇万太,于永强.植物地下生物量研究进展[J].应用生态学报,2001,12(6):927-932.YU Y T,YU Y Q.Advances in the research of underground biomass[J].Chinese Journal of Applied Ecology,2001,12(6):927-932.(in Chinese)
[27] 朱维琴,吴良欢,陶勤南.作物根系对干旱胁迫逆境的适应性研究进展[J].土壤与环境,2002,11(4):430-433.ZHU W Q,WU L H,TAO Q N.Advances in the studies on crop root against drought stress[J].Soil and Environmental Sciences,2002,11(4):430-433.(in Chinese)
[28] 吴敏,张文辉,周建云,等.干旱胁迫对栓皮栎幼苗细根的生长与生理生化指标的影响[J].生态学报,2014,34(15):4223-4233.WU M,ZHANG W H,ZHOU J Y,etal.Effects of drought stress on growth,physiological and biochemical parameters in fine roots ofQuercusvariabilisBI.seedlings[J].Acta Ecological Sinica,2014,34(15):4223-4233.(in Chinese)
[29] YANG J,ZHANG J,WANG Z,etal.Water deficit–induced senescence and its relationship to the remobilization of pre-stored carbon in wheat during grain filling[J].Agronomy Journal,2001,93(1):196-206.
[30] NI Y,GUO Y,LÜJ.Physiological and biological changes of legumes under drought stress[J].Chinese Journal of Soil Science,2004,25(3):275-278.
[31] 马惠芳,王进鑫,张青,等.干旱和铅双重胁迫对刺槐叶片有机渗透调节物质的影响[J].西北林学院学报,2012,27(3):1-6.MA H F,WANG J X,ZHANG Q,etal.Influences of drought and lead stresses on organic osmolytes in the leaves ofRobiniapseudoacacia[J].Journal of Northwest Forestry University,2012,27(3):1-6.(in Chinese)
