雷公藤内酯醇抑制COX-2表达调控胰腺癌细胞生物学性状的实验研究
2015-05-03孙运良马建霞吴红玉金晶李淑德
孙运良 马建霞 吴红玉 金晶 李淑德
·短篇论著·
雷公藤内酯醇抑制COX-2表达调控胰腺癌细胞生物学性状的实验研究
孙运良 马建霞 吴红玉 金晶 李淑德
雷公藤内酯醇(triptolide,TPL)是从中国传统中药雷公藤中提取的有效成分。近年来的研究发现,TPL不仅具有抗炎、抗免疫反应等多种药理作用,还具有广谱抗肿瘤作用,是一种多靶点的天然抗肿瘤药物[1-4]。实验表明,TPL能抑制体外培养的胰腺癌细胞增殖及胰腺癌动物移植瘤的生长[1]。环氧化酶-2(cyclooxygenase-2,COX-2)为一种诱导型酶,与多种肿瘤的发生、发展密切相关[5]。研究发现,TPL不仅可通过抑制COX-2表达调控炎症过程,还可通过下调COX-2表达抑制结肠癌细胞的增殖和迁移[2,6]。然而TPL是否也通过下调胰腺癌细胞COX-2的表达而抑制肿瘤生长目前尚不清楚。本研究应用TPL干预人胰腺癌PANC1细胞,观察其对细胞增殖、凋亡、迁移和侵袭的作用,探讨其相关机制。
一、材料和方法
1.细胞增殖检测:人胰腺癌细胞株PANC1为长海医院保存,常规培养、传代。收集对数生长期细胞,调整细胞密度为5×105/ml。96孔板每孔加入100 μl细胞悬液培养过夜,待细胞贴壁后更换为无血清的DMEM培养液,并分别加入终浓度为20、40、80 ng/ml的TPL(Sigma公司,纯度≥98.0%)继续培养24、48 h。以不加TPL干预的细胞作为阴性对照,以PBS作为空白对照。每个浓度设6个复孔。培养到时间点后每孔加入20 μl MTT溶液(5 mg/ml)继续培养4 h,吸去孔内培养液,加入150 μl DMSO,低速振荡10 min,上酶联免疫检测仪测各孔在波长570 nm处的吸光值(A570值)。细胞增殖率=(实验孔A570值/空白对照孔A570值)×100%。
2.细胞凋亡检测:取对数生长期细胞,以1×105/孔接种于24孔板,培养至细胞贴壁后更换培养液,分别加入终浓度为20、40、80 ng/ml TPL继续培养24 h,以不加TPL干预的细胞作为阴性对照。收集细胞,上流式细胞仪检测细胞的凋亡。Annexin V-FITC试剂盒购自晶美生物工程有限公司,按说明书操作。
3.细胞的迁移能力检测:取对数生长期细胞,以5×105/孔接种于6孔板,培养至约90%融合状态时弃去培养液,用10 μl的Eppendorf Tip在平板中间划一条横线,PBS冲洗3次,加入无血清的DMEM培养液。然后分别加入终浓度为20、40、80 ng/ml的TPL继续培养24 h,以不加TPL干预的细胞作为阴性对照。按0、24 h取样,测量划痕的距离。细胞迁移率=[(0 h划痕距离-24 h划痕距离)/0 h划痕距离]×%。
4.细胞侵袭能力检测:Transwell小室购自Coster公司。每个小室的聚碳酸酯膜上加50 μl用无血清DMEM培养液稀释的Matrigel,待其充分聚合。Transwell下室加入600 μl含10% FBS的DMEM培养液,Transwell上室加入200 μl用无血清DMEM培养液制备的5×105/ml的细胞悬液,分别加入终浓度为20、40、80 ng/ml的TPL培养24 h,以不加TPL干预的细胞作为阴性对照。培养24 h 后取出Transwell小室,用棉签拭去聚碳酸酯膜表面的Matrigel,PBS轻轻冲洗,晾干,然后用0.1%结晶紫染色膜10 min,去除多余结晶紫染液,普通光学显微镜下观察。每个干预浓度做3个小室。每个样本随机选取5个200倍视野,计数穿膜细胞数,取均值表示肿瘤细胞的侵袭能力。
5.细胞COX-2、Caspase-3、MMP-9蛋白表达检测:取各组不同浓度TPL干预24 h的PANC1细胞,用RIPA裂解液制备细胞总蛋白,测定蛋白浓度,常规行蛋白质印迹法检测COX-2、Caspase-3、MMP-9蛋白表达。以β-actin为内参。兔抗人COX-2、Caspase-3抗体,山羊抗人MMP-9抗体均购自Santa Cruz公司。最后ECL显影、胶片曝光、显影、定影。用凝胶图像软件分析系统扫描胶片,以目的条带与内参条带的灰度值比表示蛋白的相对表达量。

二、结果
1.PANC1细胞增殖的变化:TPL呈时间及浓度依赖性抑制PANC1细胞的增殖(图1)。
2.PANC1细胞凋亡的变化:阴性对照组及20、40、80 ng/ml TPL干预组的细胞凋亡率分别为(2.6±0.5)%、(4.7±1.0)%、(10.5±2.0)%、(21.1±4.2)%(图2)。各干预组PANC1细胞的凋亡率均显著高于阴性对照组,差异均具有统计学意义(P值均<0.05)。
3.PANC1细胞迁移力的变化:阴性对照组及20、40、80 ng/ml TPL干预组细胞迁移率分别为(79.3±8.2)%、(73.3±7.0)%、(51.0±6.2)%、(32.3±4.5)%(图3)。40、80 ng/ml组均显著低于阴性对照组,差异有统计学意义(P值均<0.01),而20 ng/ml组与阴性对照组的差异无统计学意义(P>0.05)。

与阴性对照组比较,aP<0.05;与24 h组比较,bP<0.05

图2 对照组(2A)及20、40、80 ng/ml TPL干预组(2B、2C、2D)PANC1凋亡细胞
4.PANC1细胞的侵袭力变化:阴性对照组及20、40、80 ng/ml TPL干预组的穿膜细胞数分别为(23.2±4.0)、(46.0±6.2)、(37.2±5.6)、(31.5±4.8)个/200倍视野。各干预组穿膜细胞数均显著高于阴性对照组,差异具有统计学意义(P值均<0.05),但随TPL浓度的增加穿膜细胞数减少(图4)。
5.PANC1细胞COX-2、Caspase-3、MMP-9蛋白表达量的变化:随着TPL浓度的增加, PANC1细胞COX-2、MMP-9蛋白表达量逐渐下降,而Caspase-3蛋白表达量逐渐增加(图5)。

图3 PANC1细胞的迁移能力(划痕实验 ×100)

图4 对照组(4A)及20、40、80 ng/ml TPL干预组(4B、4C、4D)PANC1细胞的侵袭能力(Transwell小室 ×200)
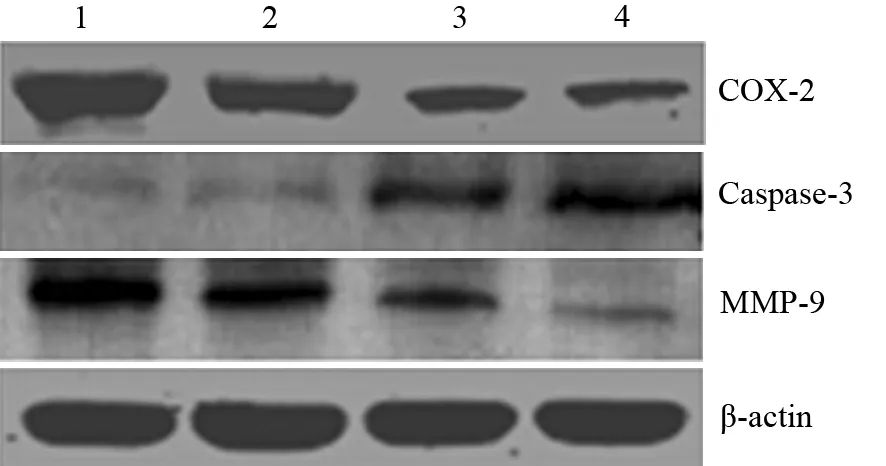
图5 对照组(1)及20、40、80 ng/ml TPL干预组(2、3、4)PANC1细胞COX-2、Caspase-3和MMP-9蛋白的表达
讨论尽管已有大量的实验证明TPL具有抗肿瘤作用,但其确切机制尚有待于进一步明确。COX-2作为一种诱导酶,生理状态下在大多数组织中不表达或微量表达,但在炎症等病理过程中表达增加。研究证实,COX-2在胰腺癌组织中高表达[7],使用选择性COX-2抑制剂或沉默COX-2基因后均能抑制胰腺癌细胞生长,并诱导细胞凋亡,提示COX-2在胰腺癌的发生、发展过程中有着重要的作用[8-9]。本研究结果显示,TPL抑制胰腺癌细胞增殖、促进胰腺癌细胞凋亡,同时明显抑制COX-2蛋白表达,表明COX-2是TPL抗胰腺癌的分子靶点之一。Johnson等[2]的研究也发现,TPL可通过抑制结肠癌COX-2的表达,进而抑制肿瘤细胞增殖、促进肿瘤细胞凋亡。
Caspase-3是Caspase家族中最重要的凋亡执行者之一,是细胞凋亡过程中的主要效应因子。研究显示,Caspase-3是COX-2重要的下游分子;特异性COX-2抑制剂NS-398或塞来昔布均可上调Caspase-3表达,促进肿瘤细胞凋亡,从而抑制肿瘤细胞生长[10-11]。本研究结果显示,TPL呈浓度依赖性抑制胰腺癌细胞增殖、诱导细胞凋亡,且呈剂量依赖性抑制COX-2、促进Caspase-3表达,提示TPL通过抑制COX-2表达,促进Caspase-3表达,从而发挥抑制胰腺癌细胞增殖、诱导细胞凋亡的作用。
侵袭、迁移是胰腺癌的主要生物学行为,也是影响治疗效果和预后的重要因素。Zhang等[12]的研究及本课题组前期研究[13]的结果表明,MMP-9在胰腺癌细胞中呈高表达,其过度表达与肿瘤对周围组织的侵袭及远处转移密切相关。近年的研究发现,COX-2可诱导MMP-9的产生,特异性COX-2抑制剂下调MMP-9蛋白表达,表明MMP-9是COX-2促进肿瘤侵袭和迁移的下游基因之一[14-15]。本研究结果显示,TPL亦下调胰腺癌细胞MMP-9表达,抑制胰腺癌细胞的迁移和侵袭。
[1] Phillips PA, Dudeja V, McCarroll JA, et al. Triptolide induces pancreatic cancer cell death via inhibition of heat shock protein 70[J]. Cancer Res, 2007, 67(19): 9407-9416.
[2] Johnson SM, Wang X, Evers BM. Triptolide inhibits proliferation and migration of colon cancer cells by inhibition of cell cycle regulators and cytokine receptors[J]. J Surg Res, 2011, 168(2): 197-205.
[3] Kang DW, Lee JY, Oh DH, et al. Triptolide-induced suppression of phospholipase D expression inhibits proliferation of MDA-MB-231 breast cancer cells[J]. Exp Mol Med, 2009, 41(9): 678-685.
[4] 谢勇,闫燕艳,尉杰忠,等.雷公藤红素诱导胃癌细胞株MGC803凋亡作用研究[J].中药药理与临床,2010,26(5):31-33.
[5] Greenhough A, Smartt HJ, Moore AE, et al. The COX-2/PGE2 pathway: key roles in the hallmarks of cancer and adaptation to the tumour microenvironment[J]. Carcinogenesis, 2009, 30(3):377-386.
[6] Lin N, Liu C, Xiao C, et al. Triptolide, a diterpenoid triepoxide, suppresses inflammation and cartilage destruction in collagen-induced arthritis mice[J].Biochem Pharmacol, 2007, 73(1): 136-146.
[7] Juuti A, Louhimo J, Nordling S, et al. Cyclooxygenase-2 expression correlates with poor prognosis in pancreatic cancer[J]. J Clin Pathol, 2006, 59(4): 382-386.
[8] Ding X, Zhu C, Qiang H, et al. Enhancing antitumor effects in pancreatic cancer cells by combined use of COX-2 and 5-LOX inhibitors[J]. Biomed Pharmacother, 2011, 65(7): 4864-4890.
[9] Zhong Y, Xia Z, Liu J, et al. The effects of cyclooxygenase-2 gene silencing by siRNA on cell proliferation, cell apoptosis, cellcycle and tumorigenicity of Capan-2 human pancreatic cancer cells[J]. Oncol Rep, 2012 , 27(4): 1003-1010.
[10] Qiu R, Chen J, Sima J, et al. NS398 induces apoptosis in non-small cell lung cancer cells[J]. J Cancer Res Clin Oncol, 2012, 138(1): 119-124.
[11] Yoshinaka R, Shibata MA, Morimoto J, et al. COX-2 inhibitor celecoxib suppresses tumor growth and lung metastasis of a murine mammary cancer[J]. Anticancer Res, 2006, 26(6B): 4245-4254.
[12] Zhang K, Chen D, Jiao X, et al. Slug enhances invasion ability of pancreatic cancer cells through upregulation of matrix metalloproteinase-9 and actin cytoskeleton remodeling [J]. Lab Invest, 2011, 91(3): 426-438.
[13] 孙运良,满晓华,王丽华,等.Toll样受体-4与胰腺癌侵袭和转移的关系[J].中国癌症杂志,2012,22(7):522-527.
[14] Kang JH, Song KH, Jeong KC, et al. Involvement of Cox-2 in the metastatic potential of chemotherapy-resistant breast cancer cells[J]. BMC Cancer, 2011, 11:334.
[15] Bu X, Zhao C, Dai X. Involvement of COX-2/PGE(2) Pathway in the Upregulation of MMP-9 Expression in Pancreatic Cancer[J]. Gastroenterol Res Pract, 2011, 2011:214269.
(本文编辑:吕芳萍)
10.3760/cma.j.issn.1674-1935.2015.03.017
江苏省卫生厅科研项目(Y201420);连云港市卫生局科研项目(1242)
222100 连云港 ,江苏省连云港市赣榆区人民医院消化内科(孙运良);上海复旦大学附属华东医院消化内科(马建霞);第二军医大学附属长海医院消化内科(吴红玉、金晶、李淑德)
李淑德,Email:lishude57@126.com
2014-01-12)
