乳酸菌对老面团发酵过程中可溶性糖和游离氨基酸含量的影响
2015-04-29宋佳锟张灏赵建新
宋佳锟 张灏 赵建新
摘要[目的]研究乳酸菌在老面发酵过程中对可溶性糖和游离氨基酸含量的影响。[方法]在5种乳酸菌与酵母菌在协同发酵老面过程中,采用高效液相色谱法测定老面中可溶性糖和游离氨基酸含量。[结果]乳酸菌在发酵初期会使得老面中的可溶性糖含量减少加快,但是发酵后期会使得其含量的增加,同时乳酸菌会增加发酵期间老面中游离氨基酸的含量;其中明登乳杆菌Z4对于可溶性糖的代谢促进最为明显,而旧金山乳杆菌S8可以促进麦芽糖的减少从而增加葡萄糖的含量,旧金山乳杆菌和短乳杆菌则对于游离氨基酸含量增加的促进较为明显。[结论]不同的乳酸菌对于老面中可溶性糖和游离氨基酸的代谢不同,最终会对馒头的品质产生影响。
关键词乳酸菌;老面;可溶性糖;游离氨基酸
中图分类号S188+.4文献标识码A文章编号0517-6611(2015)16-256-04
Effect of Soluble Sugar and Free Amino Acid Content in Old Dough Fermented by Lactic Acid Bacteria
SONG Jiakun, ZHANG Hao,ZHAO Jianxin
(Food Science School of Jiangnan University, Wuxi, Jiangsu 214000)
Abstract[Objective]The research aimed at study effect of soluble sugar and free amino acid content in old dough fermented by lactic acid bacteria and yeast. [Method]Soluble sugar and free amino acid content was determined by HPLC.[Result]At the beginning of fermentation, lactic acid makes the soluble sugar content of the old dough decreased faster, but will increase its content in the later period, and it will increase the free amino acids content during fermentation of the old dough. Wherein Lactobacillus mindensis Z4 promote soluble sugar metabolism most obvious, San Francisco lactobacillus S8 can contribute to increase the content of maltose and reduced glucose content, San Francisco lactobacillus and Lactobacillus brevis free amino acids content more obvious.[Conclusion]Impact of different lactic acid bacteria to soluble sugar and free amino acids metabolize of the old dough is different, ultimately it will have an impact on the quality of Chinese steam bread.
Key words Lactobacillus; Old dough; Soluble sugar; Free amino acid
我国传统主食馒头香甜可口,有着独特的风味,这是由于其采用的老面是一种天然发酵剂,有着多菌种混合发酵的优势[1]。老面中含有丰富的微生物,是一种复杂的生化体系,含有多种微生物的酸面团在发酵过程中相互作用,它们产生的各种代谢产物也相互作用,改变了面团的生化特性甚至是物理性质[2-5]。老面中的微生物主要为植物乳杆菌、旧金山乳杆菌、短乳杆菌、戊糖片球菌、短乳杆菌等乳酸菌和少量的酵母菌。乳酸菌在面团中利用各种糖类进行发酵,根据其发酵过程的不同可以分为同型发酵和异型发酵2种途径,同型发酵产生乳酸,而异型发酵除了乳酸外还生成乙醇、乙酸和二氧化碳等。小麦面粉中含有1.5%左右的可溶性碳水化合物,这取决于面粉和微生物的水解酶与微生物消耗之间的平衡[6]。Kim等研究发现,面团发酵过程中产生风味成分如乳酸、乙醇、有机酸、蛋白质降解产物和羰基化合物等是由于面粉中的酶类被激活[7]。此外,还生成大量的醛类、酮类等化合物,这些化合物再相互作用产生多种维生素、氨基酸使得制品的营养价值得到提升[8],另外还会产生多种新的呈味物质[9]。氨基酸和多肽可以被微生物用作重要前体物质转化为风味物质[10]。从这些研究成果中可以看出,乳酸菌对于老面中的糖代谢和氨基酸的产生有着很大的影响,但是现在还没有关于不同的乳酸菌对于老面中可溶性糖和游离氨基酸含量的影响的研究报告。所以笔者的主要研究内容为不同的乳酸菌对于老面发酵过程中可溶性糖和游离氨基酸含量变化的影响。
1 材料与方法
1.1材料
1.1.1
主要原輔料。风筝牌高筋小麦粉;乳酸菌,实验室保藏;活性干酵母,安琪酵母股份有限公司;去离子水,飘之霖实验用水;定性滤纸。
1.1.2
主要试剂。D(-)果糖,葡萄糖,蔗糖,D(+)麦芽糖,乙腈(色谱纯),三氯乙酸(分析纯)。
1.1.3
培养基。MRS液体培养基配方:鱼粉蛋白胨10.0 g、牛肉膏10.0 g、酵母膏5.0 g、葡萄糖20.0 g、无水乙酸钠5.0 g、MgSO4·7H2O 0.1 g、MnSO4·H2O 0.05 g、柠檬酸二铵2.0 g、磷酸二氢钾2.0 g、吐温80 1 ml、去离子水1 000 ml。
MRS固体培养基配方:在液体培养基的基础上添加2%的琼脂条。
孟加拉红固体培养基:蛋白胨5.0 g、葡萄糖10.0 g、磷酸二氢钾1.0 g、硫酸镁0.5 g、琼脂20.0 g、孟加拉红0.033 g、氯霉素0.1 g。
1.1.4
主要仪器。不锈钢蒸汽灭菌锅,上海三申医疗器械有限公司;超净工作台 SWCJ1FD,苏州安泰空气技术公司;隔水式恒温培养箱PYXDHS,上海一恒科技有限公司;冷冻离心机,Heal Force;超低温冰箱M DFU53V,SANYO;气相色谱-质谱联用仪Trace MS型,美国 Finnigan 公司;分析天平 AB104N,METTLR。
1.2方法
1.2.1
老面的制作方法。
取冷藏保存的乳酸菌菌液200 μl接入10 ml液体MRS培养基活化2次。量取1 ml(菌体密度108/ml)处于对数期的乳酸菌菌液,于5 000 r/min离心15 min。取菌泥和1 g酵母粉加入100 g水混匀,活化5 min后加入100 g面粉搅拌均匀。
1.2.2
老面发酵过程中乳酸菌和酵母菌活菌数的测定。取10 g老面加入90 ml无菌生理盐水,置于磁力搅拌器上搅拌20 min混匀,稀释至适当的梯度之后,涂布于固体培养基上一定时间后计数,通过形成的菌落数计算出老面中的活菌密度。乳酸菌的计数采用MRS固体培养基,接种后平板置于37 ℃恒温培养箱培养24 h。酵母菌计数采用孟加拉红固体培养基,接种后置于30 ℃倒置恒温培养48 h。
1.2.3
可溶性糖含量的测定方法。
1.2.3.1
色谱条件。 色谱柱:Prevail Carbohydrate ES Columns(250 mm×4.6 mm,5 μm);流动相:乙腈-水(体积比70∶30),使用前先经过0.45 μm滤膜过滤;流速:1.0 ml/min;柱温:25 ℃;ELSD 参数:漂移管温度 83.5 ℃,载气流速2.2 L/min;进样量:10 μl。
1.2.3.2
标准曲线的制作[11]。
准确称取(精确至 0.000 1 g)干燥至质量恒定的麦芽糖0.2 g,果糖、葡萄糖、蔗糖各0.05 g,分别用纯净水定容于50 ml容量瓶中。用自动进样器分别注入1、3、5、7、10 μl 4种糖的标准溶液,以质量浓度为横坐标,峰面积为纵坐标,分别绘制标准溶液曲线,计算线性回归方程。同时配制果糖、葡萄糖、蔗糖、麦芽糖的混合标准溶液,使各糖的质量浓度均约为1 mg/ml,进样量10 μl作为标准品色谱图。表1为标准回归方程。
表1标准回归方程
成分回归方程相关系数线性范围∥μg
麦芽糖y=513.29x-2 015.270.999 44.15~39.67
蔗糖y=369.97x-375.170.999 80.98~9.88
葡萄糖y=328.19x-322.070.999 51.01~10.07
果糖y=509.18x-481.070.999 60.99~10.04
1.2.3.3
样品测定[11]。
准确称取样品25 g(精确至0.000 1 g),置于100 ml容量瓶中,加水约50 ml,超声提取20 min,慢慢加入质量分数50%三氯乙酸溶液5 ml,用蒸馏水定容至刻度、混匀,静置30 min,用干燥滤纸过滤,弃去初滤液数毫升,滤液离心(8 000 r/min,20 min,4 ℃),经0.22 μm微孔滤膜过滤,待上机。
制备好的样液10 μl注入高效液相色谱,在“1.2.3.1”测定条件下记录果糖、葡萄糖、蔗糖、麦芽糖的峰面积,依据保留时间分别用外标法计算各组分的质量浓度,再计算样品中各组分的含量。
1.2.4
游离氨基酸含量的测定方法。采用HPLC法,取1.000 0 g老面加入15 ml锥形瓶中,加入约5 ml 5%三氯乙酸并搅拌均匀,倒入25 ml容量瓶中,用约5 ml 5%三氯乙酸冲洗15 ml锥形瓶内部后倒入25 ml容量瓶中,重复一次,再将25 ml容量瓶用5%三氯乙酸定容至25 ml。静置2 h,上清液用双层滤纸过滤,取3~5 ml滤液,10 000 r/min 5 ℃离心15 min。然后用邻苯二醛进行柱前衍生,然后使用HPLC进行游离氨基酸分析。
色谱条件:ODS Hypersil毛细管色谱柱(250 mm ×4.6 mm,5 μm),流动相为20 mmol/L乙酸钠的甲醇-乙腈溶液(体积比为1∶2),流速1.0 ml/min,柱温40 ℃,338 nm紫外检测。
2结果与分析
2.1老面发酵过程中乳酸菌和酵母菌数量的变化
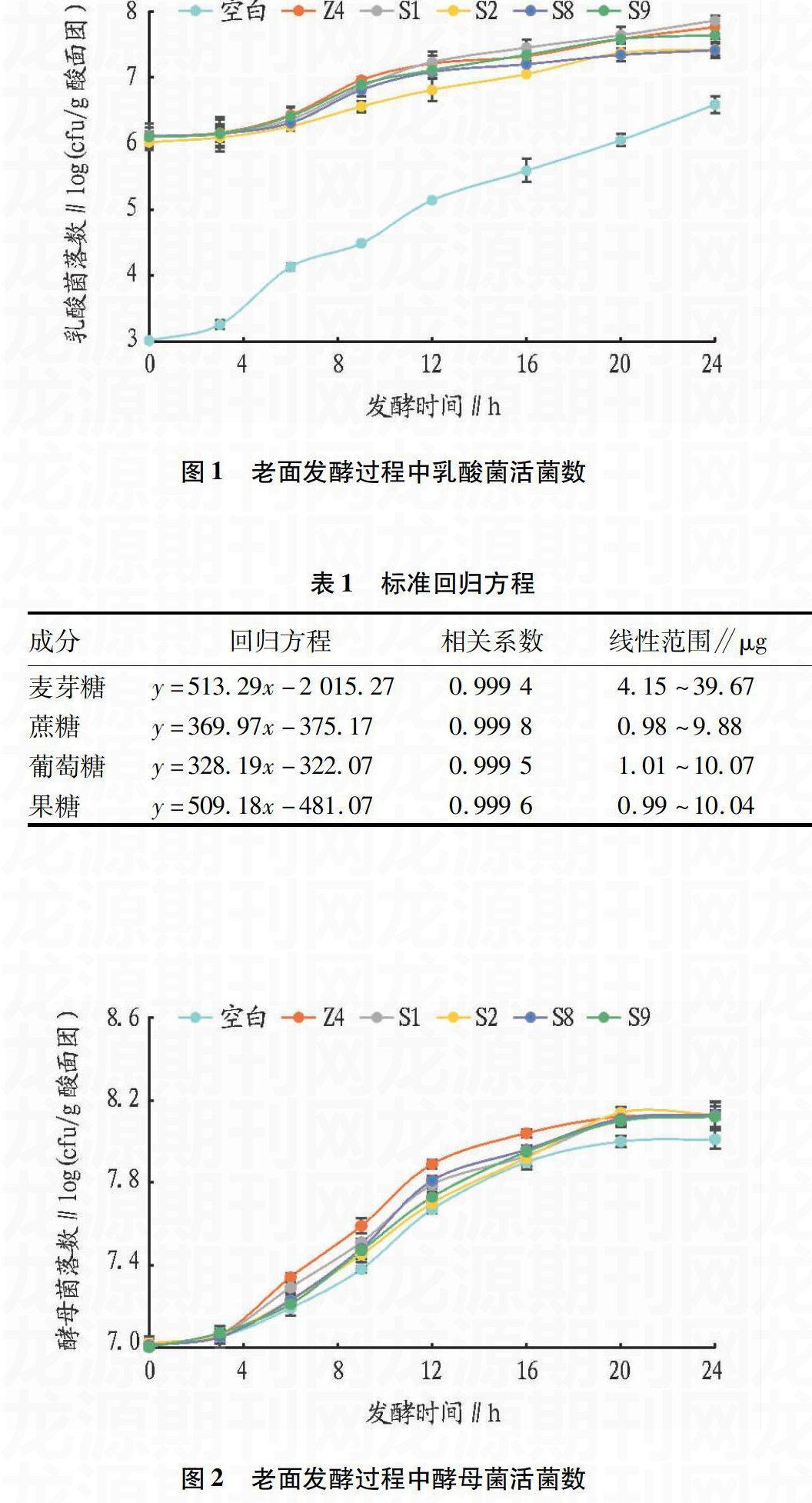
将从老面中分离出的明登乳杆菌Z4、植物乳杆菌S1、戊糖片球菌S2、旧金山乳杆菌S8和短乳杆菌S9分别按照“1.2.1”的方法制作其与酵母菌共同发酵的老面团,对照组为不添加乳酸菌而只添加酵母菌的老面。按照“1.2.2”的方法測定6种老面在发酵过程中乳酸菌和酵母菌活菌数的变化情况。由图1可知,对照组中乳酸菌起始菌落数只有不到103,其他5种添加了乳酸菌的老面起始菌落数相同,均为107,发酵前6 h乳酸菌的数量增加缓慢,随后开始迅速增加,直到16 h之后增长速率开始放缓。在整个发酵过程中,明登乳杆菌的生长速度明显快于其他乳酸菌,并且在发酵时间达到20 h之后数量还在继续增加;植物乳杆菌、旧金山乳杆菌和短乳杆菌在前16 h的生长速度无明显差异,16 h之后植物乳杆菌继续快速生长,而旧金山乳杆菌和短乳杆菌的数量增长缓慢;戊糖片球菌在整个发酵过程中的生长速度最慢,但是在20 h之后戊糖片球菌的数量已经和旧金山乳杆菌、短乳杆菌没有明显差异。
图1老面发酵过程中乳酸菌活菌数
图2所示为酵母菌在添加6种老面中生长变化情况,添加了乳酸菌能够促进老面中酵母菌的生长,发酵起始阶段0~3 h的时候几种老面中酵母菌的数量没有明显差别,3 h后酵母菌的数量变化则不相同。明登乳杆菌对于酵母菌生长的促进作用最为明显,其次为植物乳杆菌,再次为旧金山乳杆菌和短乳杆菌,最次为戊糖片球菌,酵母菌数量的增加使得面团产期增加进而导致了馒头的比容及质构的变化。但是当发酵时间达到15 h之后时,几种老面中的酵母菌数量开始趋近于一致,这是由于一方面老面中营养物质的大量消耗导致酵母菌无法继续大量增殖;另一方面,乳酸菌在后期数量的增加多于酵母菌使得更多的营养物质被乳酸菌利用。
图2老面发酵过程中酵母菌活菌数
Hansen等证实了相对于异型发酵乳酸菌,酵母菌更加适应和同型发酵乳酸菌进行共同发酵[12],明登乳杆菌为同型发酵乳酸菌,植物乳杆菌为兼性异型发酵乳酸菌,旧金山乳杆菌和短乳杆菌为异型发酵乳酸菌,这4种乳酸菌的生长速度以及其对于酵母菌生长速度的促进作用的不同再次证明了Hansen等的研究成果。例外的是戊糖片球菌虽然是同型发酵乳酸菌,但是它和酵母菌的协同发酵作用却是最弱的,这是因为戊糖片球菌的生长速率相对于乳酸杆菌较慢导致的。
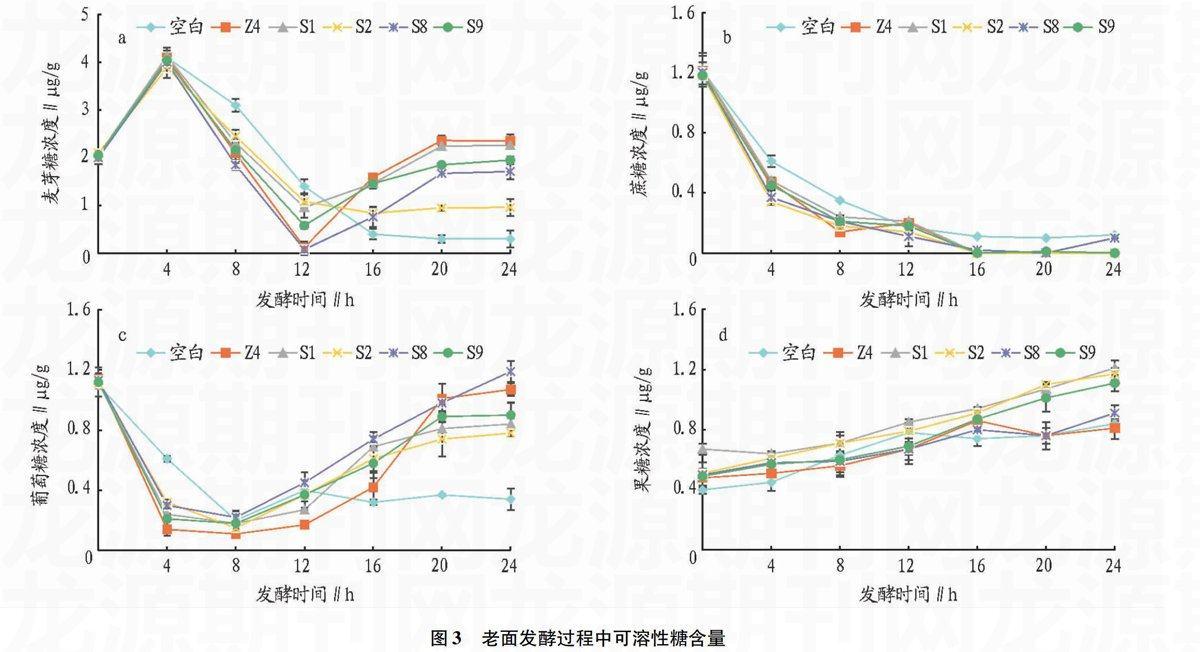
2.2不同乳酸菌发酵老面过程中可溶性糖含量的变化
将明登乳杆菌Z4、植物乳杆菌S1、戊糖片球菌S2、旧金山乳杆菌S8和短乳杆菌S9按照“1.2.1”的方法制作其与酵母菌共同发酵的老面团,对照组为不添加乳酸菌而只添加酵母菌的老面。按照“1.2.3”的方法测定6种老面在发酵过程中可溶性糖含量的变化情况。发酵过程中各糖浓度变化见图3。如图3(a)所示,前4 h主要由于酵母菌的快速生长,6种老面中麦芽糖浓度都快速消耗,随后各样品中麦芽糖的变化趋势不同。仅接种酵母菌的老面,16 h后麦芽糖的濃度维持在较低水平;对接种了乳酸菌的老面,4~8 h麦芽糖浓度快速降低,到12 h时麦芽糖浓度降低到了最低水平,这是由于酵母菌和乳酸菌的协同发酵,使得酵母菌的生长速率加快,同时乳酸菌也在消耗面团中的麦芽糖。其中添加了明登乳杆菌和旧金山乳杆菌的老面中麦芽糖的浓度降低到了接近0的水平,明登乳杆菌和酵母菌有很好的协同发酵作用,菌的快速生长对于老面中的麦芽糖消耗非常快,旧金山乳杆菌与酵母菌的协同作用虽然弱于明登乳杆菌,但是它能够产生麦芽糖磷酸
化酶促进麦芽糖分解为葡萄糖[13],使得老面中的麦芽糖含量较低。但是不同的乳酸菌对于老面中酵母菌的代谢促进作用不一样,使得它们的老面中麦芽糖的消耗速度存在差异。12 h之后,接种了乳酸菌的老面中麦芽糖的含量开始逐渐增加,这可能是因为发酵使得淀粉水解形成糊精、多肽等易溶于水的小分子量物质使得酶能够更加充分地利用原料生成麦芽糖。从图3(a)中可以看到,接种明登乳杆菌和植物乳杆菌的老面在发酵末期麦芽糖含量有所升高,这为这2种乳酸菌提供了充足的营养物质,使得它们在发酵末期还能够继续生长。
安徽农业科学2015年
如图3(b)所示,6种老面在发酵过程中蔗糖含量均逐渐减少,接种单一酵母菌的老面,蔗糖的浓度在整个发酵过程中菌高于其他老面;接种酵母菌和乳酸菌的样品蔗糖的浓度降低也较快,约9 h被消耗殆尽。由此看出,乳酸菌影响酵母菌对蔗糖的代谢。接种乳酸菌的老面蔗糖的浓度较低,总体来看呈下降趋势,可能由于多种原因所致。
由图3(c) 可知,除了添加旧金山乳杆菌的老面,其他样品的葡萄糖变化情况与麦芽糖的变化趋势基本相同。旧金山乳杆菌产生麦芽糖磷酸化酶能够将麦芽糖分解为葡萄糖,这使得老面中麦芽糖的含量降低而葡萄糖的含量增加。接种不同菌种发酵老面团过程中,葡萄糖和麦芽糖浓度变化不同,这与菌种的代谢密切相关。
果糖以果葡聚糖形式存在面粉中,在所有谷物中的含量约为1%~4%,能够水解果聚糖β果糖苷连接键的酵母酶(转化酶和菊糖酶),受pH影响,在老面团中活性可能被增强。如图3(d)所示,接种单一酵母菌的样品,前几个小时果糖的浓度有所增加,但随后浓度不再明显变化,约16 h已低于其他样品;接种植物乳杆菌Z4的样品,果糖浓度的变化波动较大,前12 h增加随后的8 h内降低;另外2种老面在发酵过程中果糖浓度都在缓慢增加。
图3老面发酵过程中可溶性糖含量
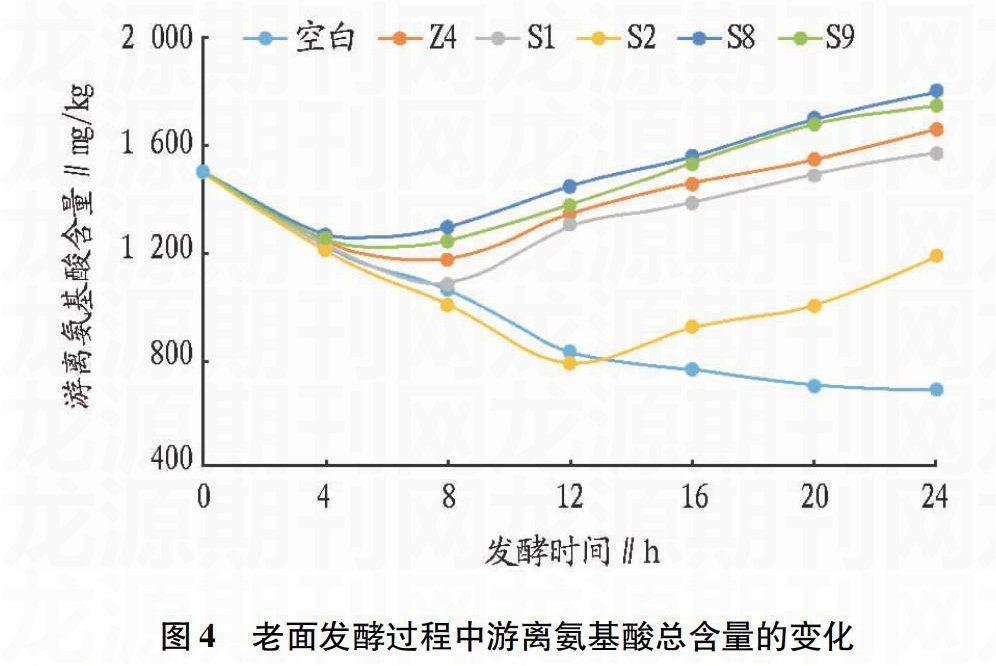
2.3不同乳酸菌发酵老面过程中游离氨基酸含量的变化
游离氨基酸是馒头风味物质的重要前提物质,将明登乳杆菌Z4、植物乳杆菌S1、戊糖片球菌S2、旧金山乳杆菌S8和短乳杆菌S9按照“1.2.1”的方法制作其与酵母菌共同发酵的老面团,对照组为不添加乳酸菌而只添加酵母菌的老面。应用“1.2.4”的方法测定老面发酵过程中FAA含量,结果如图4所示。没有添加乳酸菌的老面在发酵过程中游离氨基酸的含量持续下降,而添加了乳酸菌的老面在发酵初期FAA含量也是持续下降的,但是在8 h之后添加了明登乳杆菌、植物乳杆菌、旧金山乳杆菌和短乳杆菌的老面中FAA含量开始逐渐增加,12 h之后添加了戊糖片球菌的老面中FAA也开始迅速增加。老面发酵的酸化过程为面粉中的蛋白酶发挥最大活力提供了适宜条件,从而强化了蛋白降解。发酵初期乳酸菌的数量较少,面团的酸化程度较低,没有充分发挥面粉中蛋白酶的作用,随着发酵的进行,乳酸菌的增加使得pH下降,进而促进蛋白酶水解蛋白质使得FAA升高。戊糖片球菌产酸能力相对较弱使得老面中FAA的含量相对植物乳杆菌相对较少。添加旧金山乳杆菌和短乳杆菌的老面中FAA含量相对较高,这预示着这2种乳酸菌对于馒头的风味很可能有着更加积极的作用。另外有研究者发现,戊糖片球菌的蛋白酶活性较弱[14],这可能也是其老面中FAA含量较低的一个原因。
图4老面发酵过程中游离氨基酸总含量的变化
3 结论
不同的乳酸菌与老面中的酵母菌的协同发酵作用强弱不同,其中同型发酵的明登乳杆菌效果最好,兼性异型发酵的植物乳杆菌次之,异型发酵的旧金山乳杆菌和短乳杆菌较
弱,戊糖片球菌虽然是同型发酵,但是其生长缓慢导致协同发酵作用不明显;乳酸菌在发酵初期会使得老面中的可溶性
糖含量减少加快,发酵后期不添加乳酸菌的老面中的可溶性糖含量较低,但是乳酸菌会使得发酵后期可溶性糖含量增加,同时乳酸菌会增加发酵期间老面中游离氨基酸的含量;其中明登乳杆菌Z4对于可溶性糖的代谢促进最为明显,戊糖片球菌S2的作为最弱,旧金山乳杆菌S8可以促进麦芽糖的减少从而增加葡萄糖的含量;旧金山乳杆菌和短乳杆菌则对于游离氨基酸含量增加的促进较为明显。不同的乳酸菌对于老面中可溶性糖和游离氨基酸的代谢不同,这些变化会导致馒头的质构和风味从而影响馒头的品质。
参考文献
[1]
杨敬雨,刘长虹.中国传统酵子的工业化[J].食品研究与开发,2007,28(2):164-166.
[2] DECOCK P,CAPPELLE S.Bread technology and sourdough technology[J].Trends in Food Science & Technology,2005,16:113-120.
[3] GOBBETTI M,ANGELIS M,CORSETTI A.Biochemistry and physiology of sourdough lactic acid bacteria[J].Trends in Food Science & Technology,2005,16:57-69.
[4] LEMKI S,FERRIS D.Production of sourdough frozen pizza and fresh focaccia using MIVAC spices and Herbs[N].CATI Publication,2001-09-04.
[5] SPICHER G.Preparation of stable sourdoughs and sourdough starters by drying and freeze drying[M]//KULP K,LORENZ K,BRMMER J,et al.Frozen and refrigerated doughs and batters.St.Paul,MN:Am Assoc Cereal Chem,1995:53-61.
[6] MARTINEZANAYA M A.Enzymes and bread flavour[J].Journal of Agricultural and Food Chemistry,1996,44:2469-2480.
[7] KIM Y,HUANG W,ZHU H,et al.Spontaneous sourdough processing of Chinese northern-style steamed breads and their volatile compounds [J].Food Chemistry,2009,114(2):685-692.
[8] 杜磊,喬发东,杜杨.乳酸菌浓缩发酵剂的研究意义[J].河南畜牧兽医:综合版,2007,28(2):13-15.
[9] 郭兴华.益生乳酸细菌-分子生物学及生物技术[M].北京:科学出版社,2008:160-162.
[10] GNZLE M G,LOPONEN J,GOBBETTI M.Proteolysis in sourdough fermentations mechanisms and potential for improved bread quality[J].Trends in Food Science & Technology,2008,19(10):513-521.
[11] 刘玉峰,李黎,李东,等.高效液相色谱法测定食品中的单糖、双糖[J].食品科学,2007,28(3):293-296.
[12] HANSEN A,LUND B,LEWIS M J.Flavour of sourdough rye bread crumb[J].Lebensmittel Wissenschaft und Technologie,1989,22:141-144.
[13] EHRMANN M A,VOGEL R F.Maltose metabolism of Lactobacillus sanfranciscensis:Cloning and heterologous expression ofthe key enzymes,maltose phosphorylase and phosphoglucomutase[J].FEMS Microbiology Letters,1998,169:81-86.
[14] 马晓燕.牛肉发酵过程中优势微生物的分离鉴定及应用研究[D].保定:河北农业大学,2004.