膀胱尿路上皮癌中TGF-β1 和DPC4 的表达及临床意义
2015-04-28杨涛李燕李岩刘俊江孙福振王刚
杨涛 李燕 李岩 刘俊江 孙福振 王刚
膀胱肿瘤是在泌尿系统中最为常见的恶性肿瘤,多发生在老年人,病死率很高,其中膀胱尿路上皮癌是最为常见的病理类型,容易浸润、进展、复发,目前不可治愈,并且病因不明确。除了环境因素、化学因素外,膀胱肿瘤的发生和进展同时也涉及到了复杂的分子遗传学因素,包括染色体核型的异常、基因突变、表观遗传学的改变等。为能更早期的发现、诊断、治疗,并防止其进展,有很多问题有待解决。近来我们发现膀胱尿路上皮癌的发生、发展与某些基因的表达异常及一些信号通路异常有关系,如Wnt/β-catenin 通路、Notch通路等的异常激活。目前认为若肿瘤细胞丧失了对于TGF-β 的生长抑制的敏感性,极有可能会导致肿瘤的浸润以及转移,抵制抗肿瘤的免疫反应。它在肿瘤细胞中的浸润和转移方面可能发挥重要的作用。并且发现TGF-β 与多种信号通路异常有关。DPC4 基因主要是能够作为保守序列SMADs 蛋白家族中,并且能够直接参与转化TGF-β 在实际的细胞内部中进行信号传导的相关功能,并且在TGF-β 的超家族的信号传导过程中是出于中枢地位的,并且有研究表明DPC4 基因的失活以及缺失始于一些肿瘤的发生和发展有着较大的关系。如何更有效防止恶性肿瘤细胞浸润转移,防止肿瘤的发生、发展,并延长患者的生存期将成为焦点问题。我院使用免疫组织化学法讨论TGF-β1 以及DPC4 与膀胱移行细胞癌之间的关系,说明了膀胱尿路上皮癌发生发展相关过程分子生物学相关机制,取得了较好的效果,有助于膀胱尿路上皮癌的诊断,为膀胱癌的发生、发展提供理论依据,报道如下。
1 资料与方法
1.1 一般资料 选取我院在2013 年5 月至2014 年5月收集的膀胱尿路上皮癌存档蜡块共50 例,其中男38 例,女12 例;通过相关病理学证实,所有存档蜡块均为膀胱尿路上皮癌,年龄35 ~68 岁,平均年龄(50.13 ±1.26)岁。同时需要手机5 例膀胱尿路上皮癌的癌旁组织,所有的癌旁组织距离肿瘤边缘3 ~5 cm,并且所有标本均未经过HE 染色,通过对WHO尿路肿瘤组织学分类的相关使用,我们发现所有存档蜡块中的浸润性尿路上皮癌共31 例、非浸润性乳头状尿路上皮癌19 例,其中高级别15 例,低级别4 例。其中未经过化疗治疗的初发肿瘤29 例,经过化疗后的复发肿瘤为21 例。
1.2 治疗方法 在本次研究中,需要使用免疫组织化学S-P 法对膀胱尿路上皮癌的50 例存档蜡块以及5例癌旁组织中的TGF-β1 和DPC4 表达水平。首先需要对所有的标本进行一般方式下的取材,同时取材完成后需要进行固定脱水以及包埋和切片的相关处理,在处理完成后需要进行HE 染色和封片的处理。在本次研究中我们选择兔抗人TGF-β1 多克隆抗体以及即用型的兔抗人DPC4 多克隆抗体。同时也需要使用超敏即用型的SP 通用型的免疫组织化学试剂以及DAB显色试剂盒以及聚赖氨酸,也需要准备好在实际的免疫组织化学法中需要检测出的TGF-β1 和DPC4 相关抗原。第一步是需要将5 μm 组织切片进行常规处理即脱蜡脱水的相关处理,并且需要在0.01 mmol/L PBS 中进行3 ×3 min 进行抗原修复,并在室温情况下进行冷却后,需要在0.01 mmol/L PBS 中进行漂洗5 ×3 min,并需要进行3%的过氧化氢进行滴入,在滴入完成后,在37℃的环境下孵育10 min,甩去多余的血清,再分别滴入一抗,在4℃的环境下进行孵育过夜,在0.01 mmol/L PBS 中进行3 ×5 min 的漂洗,并且滴入二抗,在37℃的环境下进行10 min 的孵育,在0.01 mmol/L PBS 中进行3 ×3 min的漂洗,并需要滴入新鲜的DAB 显色液进行显色,使用光镜下进行反应时间的控制,并需要使用苏木素进行复染,随后使用流水冲洗,并使用0.1%的氨水进行返蓝处理,对标本进行封片以及镜检。在镜检完成后需要使用HPIAS-1000 对TGF-β1 和DPC4 的表达进行观察和定量分析,计算阳性反应面积、平均光密度以细胞总面积,最后需要对阳性面积率进行计算。
1.3 统计学分析 应用PSS 17.0 统计软件,计量资料以± s 表示,采用t 检验,P <0.05 为差异有统计学意义。
2 结果
2.1 TGF-β1 在膀胱尿路上皮癌与癌旁组织中的表达情况 通过本次研究我们使用了免疫组织化学法的方式进行了研究。在本次研究完成后我们发现,TGF-β1在膀胱尿路上皮癌组织中呈现出高表达的情况,在正常的癌旁组织中呈现出一种低表达的情况,在患者的膀胱尿路上皮癌中的平均光密度为0.2542 ±0.0068,阳性面积率为0.2678±0.0061,但在患者的癌旁组织中的平均光密度为差异为0.0358±0.0012 阳性面积率为0.0488±0.0018,差异有统计学意义(P <0.05)。
2.2 DPC4 在膀胱尿路上皮癌与癌旁组织中的表达情况 同时DPC4 在膀胱尿路上皮癌组织中呈现低表达情况,在癌旁组织中呈现高表达情况,在患者的膀胱尿路上皮癌中的平均光密度为0.0586 ±0.0052,阳性面积率为0.0625 ±0.0053。但在患者的癌旁组织中的平均光密度为0.3129 ± 0.0078,阳性面积率为0.3192 ±0.0073,差异有统计学意义(P <0.05)。见表1、2。
表1 膀胱尿路上皮癌以及癌旁组织中TGF-β1 的平均光密度以及阳性面积率 ± s

表1 膀胱尿路上皮癌以及癌旁组织中TGF-β1 的平均光密度以及阳性面积率 ± s
组别 平均光密度 阳性面积率膀胱尿路上皮癌(n =50)0.2542 ±0.0068 0.2678 ±0.0061癌旁组织(n =5) 0.0358 ±0.0012 0.0488 ±0.0018 t 值71.1248 79.324 P 值0.0000 0.0000
表2 膀胱尿路上皮癌以及癌旁组织中DPC4 的平均光密度以及阳性面积率 ± s
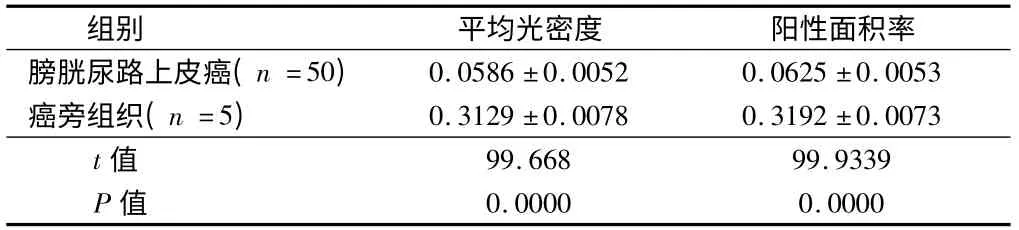
表2 膀胱尿路上皮癌以及癌旁组织中DPC4 的平均光密度以及阳性面积率 ± s
组别 平均光密度 阳性面积率膀胱尿路上皮癌(n =50)0.0586 ±0.0052 0.0625 ±0.0053癌旁组织(n =5) 0.3129 ±0.0078 0.3192 ±0.0073 t 值99.668 99.9339 P 值0.0000 0.0000
3 讨论
膀胱肿瘤是发生于膀胱黏膜上的一种恶性肿瘤,它是是泌尿系统中非常常见的一种恶性肿瘤,占到我国泌尿系统恶性肿瘤发病率的首位。研究表明,膀胱癌可以发生在任何年龄段,也可以发生在儿童。并且膀胱肿瘤的发病率是随着年龄的增长而增加,据统计膀胱肿瘤的高发年龄在50 ~70 岁,同时发现男性的膀胱肿瘤的发病率是女性膀胱肿瘤的4 倍。膀胱肿瘤中最常见的事来自于尿路上皮,它的发生发展是通过各种基因的参与,同时在多种细胞因子的调控下的复杂过程,而且肿瘤细胞的浸润及转移往往是膀胱肿瘤中最为致命的因素。因此可以看出研究膀胱肿瘤的发生及发展,浸润的分子机制有很重要的实际意义和临床价值。膀胱尿路上皮癌是泌尿系统中最为常见的一大类疾病,由于膀胱尿路上皮癌的特点,在实际的发病过程中,死亡率较高,同时目前膀胱尿路上皮癌的发病率以及死亡率也呈现出一种上升的趋势,此病的侵袭性较强,可较早发生转移,这可能与吸烟、环境污染以及职业等因素有关,但确切的病因目前仍然在进一步的探索。所以若能够发现膀胱尿路上皮癌的发病机制及分子作用机理,可能为疾病的预防及防止其进展而奠定理论基础。
在实际的对膀胱尿路上皮癌进行研究的过程中,Liu 等[4]研究显示转化生长因子β(transforming growth factor-β,TGF-β)以及这种因子的相关家族成员对患者组织内环境的中枢相关作用能够起到较大的作用,在实际的使用过程中能够将患者的细胞死亡、凋亡以及生长进行相应的调节,同时也可以将患者的细胞外基质的合成以及分化进行相应的调节,是一种在组织内部环境和发育过程中能够有着中枢作用的多功能因子,在使用的相关过程中有着调节细胞凋亡的相关功能,同时也有着细胞外合成以及细胞分化相关的不同生物学功能,同时TGF-β 的最重要的生物学功能就是对上皮细胞产生抑制,若肿瘤细胞丧失了对于TGF-β的生长抑制的敏感性,极有可能会导致肿瘤的浸润以及转移,抵制抗肿瘤的免疫反应。近年来TGF-β 的功能作用逐渐被认识,它不仅可以促进恶性肿瘤的血管增生、浸润、转移、免疫抑制等作用。TGF-β 还可以激活周细胞及血管平滑肌细胞增生和分化,对于DPC4基因而言,最为主要的功能是作为序列保守SMADs 蛋白家族中的一员,能够在转化因子TGF-β 的相关细胞内部信号的实际传导过程中起着较为重要的作用,同时在实际的TGF-β 超导体家族中的信号传导是一种中枢的相关地位,并且在以往有研究表明DPC4 基因的缺失以及失活等情况也与肿瘤的发生和发展有着较大的关系。到目前为止,在上皮细胞癌的细胞所发挥其功能作用的研究过程中,己经逐步阐明TGF-β 通路、SDF-1/CXCR4 通路、FGF 通路、Notch 通路、Wnt/β-catenin 通路等众多条分子信号通路与上皮癌细胞发生、发展之间的过程关系紧密,有部分研究表明wnt5a 与膀胱尿路上皮癌的发生、发展、转移密切相关。其中在这些通路中,以TGF-β 分子信号通路最为研究对象,研究的比较多。TGF-β 是一类二聚体多肽,主要表达于在内皮细胞、血细胞、结缔组织细胞和上皮细胞中。TGF-β 同时也是一种生长因子,具被调节细胞增殖、分化和凋亡等多种生物学功能。近年的研究表明,TGF-β 还具有刺激恶性肿瘤血管的增生、侵袭、转移,并对宿主细胞有免疫抑制作用,以及促使肿瘤细胞增殖等多种作用。TGF-β 在恶性肿瘤血管生成中的的调控作用,主要影响血管内皮细胞增生,同时TGF-β作为一种很强的的趋化因子,可以吸引巨噬细胞和成纤维细胞,并且释放bFGF、PDGF、TNFα 等多种血管活性因子。除此之外,TGF-β 还可以促使新生血管的生成,并进一步导致肿瘤发生、发展及转移。
DPC4 是一种新发现的抑癌基因,研究表明与胃肠道肿瘤的发病关系密切,但最近发现DPC4 与多种肿瘤的发生、发展及其作用密切关联。DPC4 基因是定位在人的染色体的18q21.1,由552 个氨基酸组成,其中有11 个外显子,10 个内含子。它的cDNA 全长是由1656 碱基组成。DPC4 蛋白是TGF-β 信号中细胞内传导的重要元素之一。TGF-β 可以诱导细胞的生长抑制作用,使细胞明显增殖从而形成肿瘤。另外研究发现,DPC4 基因的突变可以使Smad4 蛋白结合的活性丧失,从而使其通路中的基因转录调控失活而发生异常,造成肿瘤的形成。
在本次研究中,我们利用了免疫组织SP 法对患者的膀胱尿路上皮癌中的TGF-β1 和DPC4 的表达进行相关的检测,通过这种方式就能够了解到TGF-β1 和DPC4 在实际的膀胱尿路上皮癌发生以及发展过程中的相关关系。在本次研究中我们可以发现,TGF-β1 在膀胱尿路上皮癌组织中是一种高表达的情况,但在患者正常的癌旁组织中为低表达,并且二者有显著差异,有统计学意义,对于DPC4 而言,在癌旁组织中呈现出高表达,但在膀胱尿路上皮癌组织中呈现出低表达。二者有显著差异,并有统计学意义。通过进一步的分析我们发现,这极有可能会由于DPC4 发生基因的突变或缺失会阻断TGF-β1,从而抑制肿瘤生长的相关通路。但这种作用会发生相关的负反馈作用,因此会导致细胞分泌的TGF-β1 发生提升,而通过TGF-β1 和DPC4 共同调节的形式可能会影响到恶性肿瘤的发生发展,为今后的早期治疗干预及预防提供理论基础。
Schwarte-Waldhoff 等[7]研 究 显 示,TGF-β1 和DPC4 是TGF-β 在实际的传导过程中起着关键作用的相关因子,TGF-β1 在膀胱尿路上皮癌中表达程强阳性,在癌旁组织中表达较弱,它的平均光密度及阳性表达率与癌旁组织比较,差异有统计学意义(P <0.05)。DPC4 在膀胱尿路上皮癌中表达较弱,在癌旁组织中的表达程强阳性,它的平均光密度及阳性表达率与癌旁组织比较,差异有统计学意义(P <0.05)。通过DPC4 的低表达以及TGF-β1 的高表达,我们发现能够作为膀胱尿路上皮癌早期治疗过程中的重要因素,同时我们也能够发现,DPC4 在TGF-β1 的信号传导过程中有着极为关键的作用,DPC4 的缺失或是突变极有可能会对TGF-β1 的生长抑制发生耐受,从而导致膀胱尿路上皮癌的发展。同时通过Lin 等[10]研究显示,DPC4 在膀胱尿路上皮癌中的低表达,也能够说明TGF-β1 抑制肿瘤生长的相关传导通路被阻断,而通过阻断的相关作用,在实际的转录过程中得到较好的体现。由此可见,DPC4 的低表达以及TGF-β1 的高表达都极有可能会导致肿瘤细胞的免疫逃逸发生,但其机制需要进一步探讨。
1 陕光,唐甜.抑癌基因DPC4 和TGF-β1 在膀胱尿路上皮癌中的表达和意义.中国组织化学与细胞化学杂志,2011,20:491-495.
2 牛坚.TGF-β1、MMP-2、DPC4、CyclinE、P27 在原发性胆囊癌中的表达及临床意义.南通医学院,2003.
3 张东伟.抑癌基因DPC4 和转化生长因子β1(TGFβ1)在大肠癌组织中的表达及临床意义.哈尔滨医科大学,2005.
4 Fang L,Celio P,Massagué J.Dual role of the Smad4/DPC4 tumor suppressor in TGFβ-inducible transcriptional complexes.2004.
5 Song CZ,Siok TE,Gelehrter TD,et al.Smad4/DPC4 and Smad3 mediate transforming growth factor-beta (TGF-beta)signaling through direct binding to a novel TGF-beta-responsive element in the human plasminogen activator inhibitor-1 promoter.The Journal of Biological Chemistry,1998,273:29287-29290.
6 Long JY,Wang GN,Matsuura I,et al.Activation of Smad transcriptional activity by protein inhibitor of activated STAT3 (PIAS3).Proceedings of the National Academy of Sciences of the United States of America,2004,101:99-104.
7 Schwarte-Waldhoff I,Volpert M,Olga V.Smad4/DPC4-mediated tumor suppression through suppression of angiogenesis.2001.
8 Long JY,Matsuura I,He DM,et al.Repression of Smad transcriptional activity by PIASy,an inhibitor of activated STAT.Proceedings of the National Academy of Sciences of the United States of America,2003,100:9791-9796.
9 Nagarajan RP,Chen Y.Structural basis for the functional difference between Smad2 and Smad3 in FAST-2 (forkhead activin signal transducer-2)-mediated transcription.The Biochemical Journal,2000,350:253-259.
10 Lin X,Liang M,Liang YY,et al.Activation of transforming growth factor-beta signaling by SUMO-1 modification of tumor suppressor Smad4/DPC4.The Journal of Biological Chemistry,2003,278:18714-18719.
