黄花败酱发状根培养体系的建立及其抑菌作用研究
2015-04-25孔维军麻馨月常桂英董长颖杨世海
赵 雪 孔维军 麻馨月 常桂英 董长颖 杨世海
(1 吉林农业科技学院,吉林,132101; 2 中国医学科学院药用植物研究所,北京,100193; 3 吉林农业大学,长春,130118)
黄花败酱发状根培养体系的建立及其抑菌作用研究
赵 雪1,2,3孔维军1麻馨月1常桂英1董长颖1杨世海2
(1 吉林农业科技学院,吉林,132101; 2 中国医学科学院药用植物研究所,北京,100193; 3 吉林农业大学,长春,130118)
目的:初步建立黄花败酱发状根培养体系,并考察其抑菌效果。方法:采用发根农杆菌1601、15834、A4、1000等4种G-土壤杆菌诱导黄花败酱外植体产生发状根,考察不同外植体、菌株、侵染时间、预培养和共培养时间对黄花败酱毛状根诱导率的影响,并对发状根进行PCR检测;同时采用纸片扩散法测定其抑菌效果。结果:黄花败酱茎段作为外植体,预培养和共培养48 h,发根农杆菌A4侵染8 min,MS液体培养基pH为6时添加蔗糖浓度为40 g/L时转化率和增殖量最高,提取毛状根中总黄酮的含量为9.12%。应用PCR证实A4质粒上的rolB基因片段成功转入被感染的黄花败酱发状根中。结论:建立了黄花败酱毛状根培养体系,其发状根提取液对金黄色葡萄球菌具有较好的抑制作用。
黄花败酱;发根农杆菌;发状根;抑菌作用
黄花败酱(PatriniascabioscaefoliaFisch)别名黄花龙芽、野共花、鹤立鸡群,为败酱科(Valerianaceae)败酱属(Patrinia)植物,根或全草入药,是我国传统常用中药之一,主产于黑龙江、河北、湖南等省[1-2]。黄花败酱草的全面研究始于20世纪60、70年代,其草内含有皂苷类、黄酮类、挥发油类等多种药用成分,其中以三萜皂苷和黄酮类为主要活性成分[3],具有清热解毒、利湿排脓,祛瘀止痛的功效[4]。临床研究表明在治疗流行性鼻腔炎、腮腺炎、慢性盆腔炎及阑尾脓肿症状等方面有很好的疗效[5]。除此之外,该草药还有解毒排脓、治疗子宫炎及产后脱宫蓄脓的功效。黄花败酱种子中的Sulfapatrinosides有效成分可用于控制艾滋病(HIV),黄花败酱提取液在延长戊巴比妥钠对小鼠的睡眠时间上也有很明显的作用[6]。随着研究的不断深入,黄花败酱草的药用价值逐渐提高,临床应用和市场需求逐渐加大。利用发根农杆菌(Agrobacteriumrhizogenes)侵染植物诱导毛状根培养技术是继离体培养技术之后的新型悬浮培养技术,可用于建立产生次生代谢产物的培养系统,具有遗传稳定性、生长迅速、合成次生代谢物能力强、易于操作控制等优点,较传统的细胞培养技术具有更广阔的应用前景[7-9]。本研究利用4种发根农杆菌1601、15834、A4、1000诱导黄花败酱组织产生毛状根,初步建立黄花败酱草发状根离体扩增生长的培养体系,为下一步扩大培养黄花败酱发状根的研究提供可行性数据支撑,同时也为黄花败酱发状根培养体系的抑菌作用研究提供新途径。
1 材料与方法
1.1 无菌苗培养 黄花败酱(PatriniascabioscaefoliaFisch)种子由吉林农业大学药植园提供,经吉林农业大学中药材学院杨世海教授鉴定。利用当年成熟干燥的黄花败酱种子,加温水浸泡12 h,在超净操作台内用无菌水清洗4次,75%乙醇浸泡30~40 s,无菌水清洗3次;后用4%次氯酸浸泡8~9 min,无菌水清洗5~6次。处理完后用灭菌滤纸将种子表面的水分吸干,用镊子轻轻放置在MS固体培养基(100 mL锥形瓶)中,置于光照强度2 000 lx(光照12 h/d黑暗12 h/d交替培养)、设置温度24~25 ℃进行培养,等待萌发无菌幼苗即为侵染用的外植体。
1.2 发根农杆菌的活化 发根农杆菌Agrobacteriumrhizogenes1601、15834、1000和A4菌株由中国农业微生物研究所菌种保藏中心提供,并于-70 ℃冰箱内保存备用。实验时,在超净操作台内分别挑出A4、15834、1601和1000菌株,接种于固体YEB平皿上划线,封口膜密封后置于28 ℃恒温暗培养,1~2 d待长出单克隆菌斑后挑取单菌落,接种于加有30 mL卡那霉素(Kan+50 mg/mL)液体的YEB培养基中,28 ℃、180 r/min震荡培养24 h后观察YEB由透明的红棕色渐渐变淡且呈现出云雾状浑浊即可。取1 mL复苏成功的菌液加入装有50 mL YEB液体培养基中,于相同的条件下再次培养12 h,取对数生长期时的菌液对黄花败酱外植体进行侵染。
1.3 黄花败酱发状根的诱导 在超净操作台内,将黄花败酱无菌苗的叶片剪成0.3 cm×0.3 cm片段,茎段长度约0.3 cm左右。叶片和茎段分别置于MS固体平皿上,不添加外源激素置于24 ℃、黑暗条件下预培养48 h。在超净操作台中,将预培养的外植体(茎段、叶片)转移至锥形瓶中,加入活化后的菌液进行侵染,轻摇锥形瓶,待外植体与菌液充分接触侵染8 min后,取出外植体,用灭菌滤纸吸干表面菌液,接种到MS固体培养基上,24 ℃、黑暗条件下共培养48 h,然后转接到含头孢噻肟钠(50 mg/L)的MS固体培养基中继续暗培养,同时设立未被菌液感染的外植体作对照。每5 d转板1次,直至完全除去农杆菌。25 d后观察,统计诱导出的毛状根数,计算黄花败酱发状根诱导率。最后,将生长迅速、根系发达、分支较多、除菌完全的黄花败酱发状根转移到MS液体培养基中进行悬浮培养,建立黄花败酱毛状根离体培养体系。
发状根诱导率(%)=(长出发状根的外植体数/接种外植体的总块数)×100%
1.4 发状根的PCR检测 根据已诱导出发状根的形态及其生长无向地性等特点,可初步判定发状根。为确定发根农杆菌中T-DNA片段是否整合进入黄花败酱的核基因组中,对诱导出的毛状根进行PCR分子鉴定[10]。在PCR扩增试验中,阳性对照为菌株A4的质粒DNA扩增产物,阴性对照为未转化植株DNA扩增产物,设计并合成扩增rolB的PCR引物,正向引物:5'-CTCCTGACAT-CAAACTCGTC-3',反向引物:5'-TGCTTCGAGTTAT-GGGTA-3'。正向引物反应条件95 ℃预变性1 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸60 s,35个循环后,72 ℃总延伸7 min,于4 ℃保存。
1.5 毛状根增殖液体培养基的筛选 在无菌条件下取0.8 g分枝多且长、除菌完全的黄花败酱毛状根分别放入到MS、1/2MS、R2和B5 4种不添加激素的液体培养基进行悬浮震荡培养,26 ℃,转速为160 r/min的条件下进行暗培养,每5 d测1次鲜重,25 d后观察统计这4种培养基对黄花败酱毛状根增殖倍数的影响。
1.6 不同浓度的蔗糖对毛状根增殖的影响 无菌条件下,取0.8 g分枝多且长、除菌完全的黄花败酱毛状根,分别放入含有浓度为5、10、20、30、40和50 g/L的蔗糖MS液体培养基中,25 d后称取发状根鲜重,考察培养基中加入的不同浓度蔗糖对发状根增殖的影响。
1.7 不同pH值对毛状根增殖的影响 取0.8 g分枝多且长、除菌完全的黄花败酱毛状根分别接种于pH为2,4,6,7,8,9的MS液体培养基中进行悬浮震荡培养,摇床转速为160 r/min,26 ℃恒温培养,25 d后观察统计这4种培养基对黄花败酱毛状根增殖倍数的影响。
1.8 总黄酮的含量测定
1.8.1 黄花败酱发状根提取液的制备 精密称取烘干后的黄花败酱发状根和自然根各3 g,磨成粉末后用滤纸包好,放入加有石油醚(60~90 ℃)的索氏提取器中回流10 h脱脂。将脱脂后的粉末放置冷却,待石油醚挥干后加入50 mL 70%乙醇,超声提取3次,每次30 min,过滤后合并滤液,浓缩至干后称重,以70%乙醇定容至100 mL,即得黄花败酱发状根提取液,备用[11]。
1.8.2 芦丁标准品溶液的制备 精密吸取芦丁标准对照品5 mg,70%乙醇溶液精确定容置至50 mL。精密吸取芦丁标准品溶液0 mL,0.5 mL,1 mL,2 mL,3 mL,4 mL,分别置于10 mL的容量瓶中,加入5%NaNO2溶液0.3 mL,摇匀,静置5 min,然后加入10% Al (NO3)3溶液0.3 mL摇匀,静置5 min后加入4%NaOH溶液4 mL,纯净水稀释至刻度,摇匀静置15 min,乙醇溶剂做为空白试剂在510 nm波长处测吸光度,绘制标准曲线。
取一定体积样品以同一方法测吸光度,得回归方程计算黄酮含量。
结果如图1所示,计算得标准回归方程y=0.065 6x+0.000 6,相关系数r为0.999 6。

图1 测定黄酮含量的标准曲线
1.9 黄花败酱发状根提取液的抑菌作用研究
1.9.1 细菌菌株培养及阳性药的制备 实验菌种:金黄色葡萄球菌(Staphylococcusaureus)、沙门氏菌(Salmonellaenterica)和大肠杆菌(Escherichiacoli)由吉林大学畜牧兽医学院惠赠。细菌培养:无菌条件下,将3种供试菌株分别接种于PDA培养皿中,密封后,28 ℃恒温培养箱中培养48~96 h。在超净操作台内精确吸取硫酸庆大霉素注射液1.0 mL加入磷酸盐缓冲液中,调pH 7.8,200 mL容量瓶中溶解并定容。密封冷藏保存。氯霉素(1.0 mg/mL):在超净操作台内,精确吸取氯霉素注射液0.8 mL置于pH 6.0的磷酸盐缓冲溶液中,定容到100 mL无菌容量瓶中。密封,冷藏保存。头孢曲松钠(1.0 mg/mL):在超净操作台内,精确称取1.0 g注射用头孢曲松钠干粉,以100 mL pH 6.0的磷酸盐缓冲液溶解,密封,冷藏保存。
1.9.2 抑菌试验 采用纸片扩散法[12]考察黄花败酱发状根提取液额抑菌作用。无菌条件下,将直径5.0 mm的无菌滤纸片浸泡于供试溶液中2 h,将滤纸片均匀摆放于细菌培养基上,每个培养皿中3片,分别加入头孢曲松钠(阳性对照)、供试液和阴性对照液,重复3次。37 ℃培养箱中培养15~17 h后,采用十字交叉法测定抑菌圈的直径,按如下公式计算抑菌率。

2 结果与分析
2.1 种子灭菌方法 将采用4%次氯酸和0.1%升汞灭菌后的黄花败酱种子接种到MS固体培养基,25 d后考察不同处理方法对黄花败酱种子出苗率的影响。结果见表1。
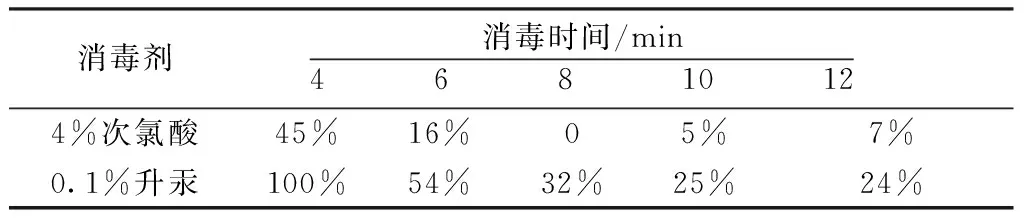
表1 不同处理方法对种子污染率的影响
从上表可以看出,2种消毒剂对黄花败酱出苗率的影响不同,其中4%次氯酸效果优于0.1%升汞,且在8 min时消毒效果最佳。
2.2 不同菌株和外植体对发状根诱导率的影响 侵染的外植体不同,发状根的诱导率也会存在差异。采用发根农杆菌1000、A4、15834、1601等4种G-土壤杆菌浸染黄花败酱叶片和茎段,25 d后观察4种菌株的诱导效果,从表2和图2可以看出,不同农杆菌和外植体对黄花败酱发状根的诱导有不同的影响,且显著性差异(P<0.05)和极显著差异(P<0.01)。A4菌株感染的外植体于18 d左右即能侵染出发状根,而其余三种菌株较A4菌株诱导出的发状根数目少很多;A4菌株对茎段的平均诱导率达到79.17%,而1000、15834和1601菌株的平均诱导率分别为30.56%、11.11%和22.22%。A4、1000、15834和1601菌株对叶片的平均诱导率分别为34.70%、18.05%、5.56%和15.28%。由此可见,发根农杆菌A4是诱导黄花败酱茎段的最佳菌种。

图2 黄花败酱发状根的诱导
注:a.A4侵染叶片;b.A4侵染茎段;c.茎段褐化
2.3 侵染时间不同对黄花败酱发状根诱导率的影响 农杆菌菌株对外植体侵染时间的长短与诱导发状根的数量密切相关,菌株与外植体接触时间长,则在外植体伤口处侵害细胞,最终导致外植体死亡;接触时间短,则菌株无法完全感染细胞。本研究采用共培养法,利用农杆菌株A4分别侵染黄花败酱的外植体0、2、4、6、8、10 min后放置,25 d后观察发状根的诱导情况,计算诱导率。由图3可以看出,黄花败酱的发状根随着侵染时间的增加诱导率也逐渐升高,最佳的诱导时间为8 min,平均诱导率达到最高77.79%。侵染10 min后诱导率逐渐下降,侵染的外植体有蔫腐变黄现象出现。所以,8~10 min为黄花败酱的最佳侵染时间。
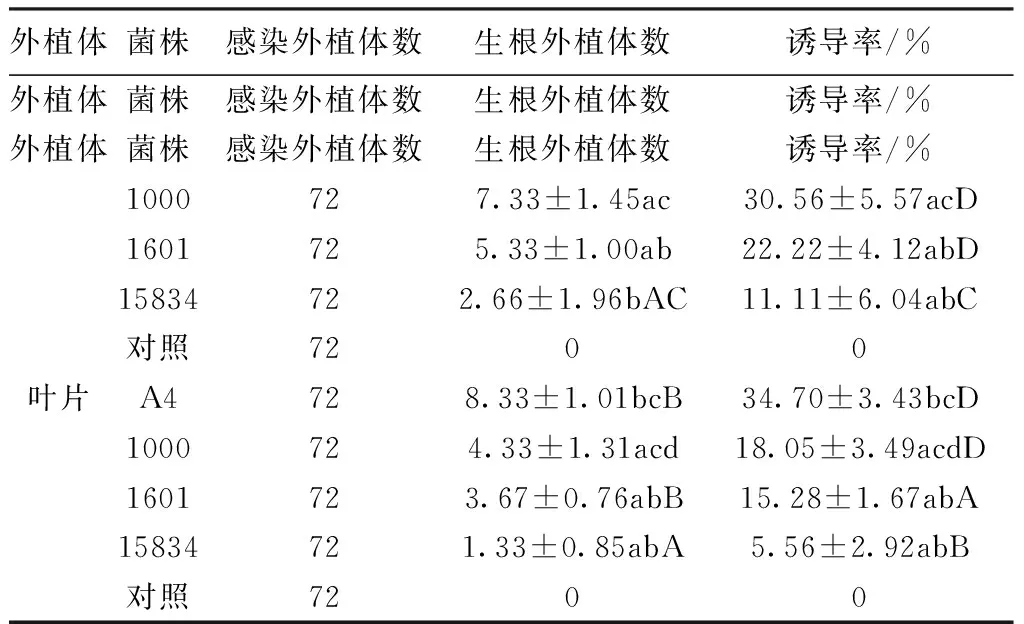
表2 不同发根农杆菌对不同外植体上黄花败酱毛状根的诱导效果

图3 不同侵染时间对黄花败酱毛状根诱导率的影响
2.4 预培养和共培养对黄花败酱发状根诱导率的影响
2.4.1 预培养对黄花败酱发状根诱导率的影响 在农杆菌侵染前对植体外植体进行预培养处理,可使植物受体形成并释放酚类信号分子,从而提高转化率,同时能较好地解决褐化问题。本研究中,对黄花败酱分别进行0、12、24、48、60 h的预培养后用农杆菌A4菌株侵染外植体,25 d后统计诱导出的发状根数,计算诱导率。从图4我们可以看出,预培养时间不同对外植体毛状根的诱导率也显著不同。本实验中预培养时间在48 h时诱导率最高为79.17%,预培养60 h后诱导率开始明显下降。
2.4.2 共培养对黄花败酱发状根诱导率的影响 共培养时间在植物毛状根的诱导过程具有重要影响。共培养时间过长,外植体的转化越难以实现;共培养时间过短,发根农杆菌中的基因片段不能及时的被整合到植物DNA上[12]。本研究中,对黄花败酱的茎段分别进行0、12、24、48、60 h共培养,然后统计诱导出的发状根总数,计算诱导率。从图4可以看出,不同的共培养时间对黄花败酱毛状根的诱导率存在显著差异。实验结果表明最佳的共培养时间为48 h,诱导率高达84.33%,而预培养60 h后其诱导率开始下降。
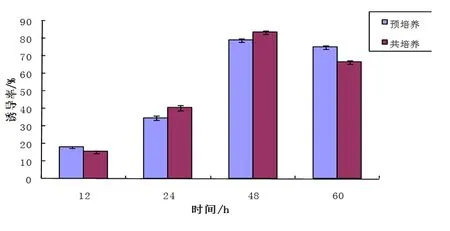
图4 预培养与共培养时间对黄花败酱发状根的影响
2.5 发状根的PCR分子检测结果 A4、15834、1601、1000发根农杆菌所诱导的黄花败酱毛状根中,A4菌株的诱导率最高,且生长期短,能进行液体扩增培养。本研究中,将根系发达、分支较多、生长状况好的发状根、植物根和A4菌株中的DNA进行PCR分子检测并拍照(125V电压,25 min)。由图5可以看出,在外植体发状根条带(485 bp)处出现了与基因引物相同的条带,自然状态生长的根(未转化)则未出现此条带,表明发根农杆菌A4菌株中质粒DNA片段已整合进入转化根的基因组中。
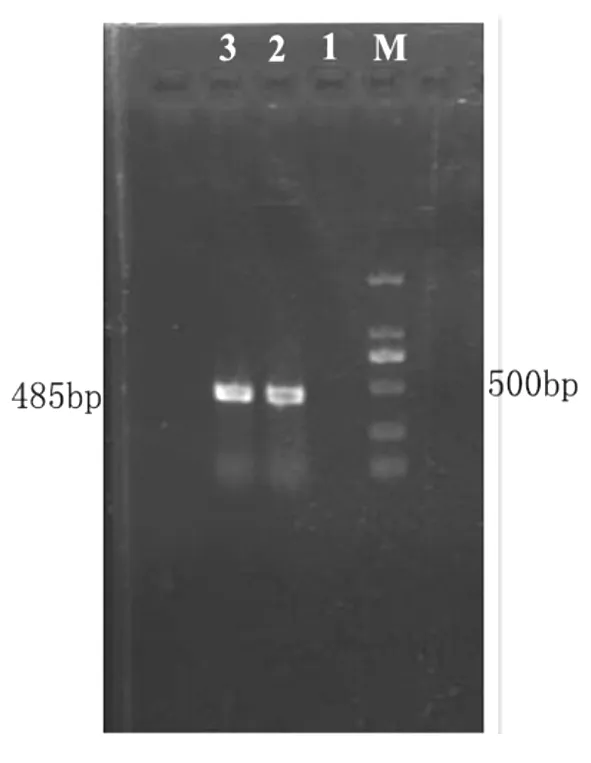
图5 黄花败酱发状根PCR检测结果
注:M.Marker 2000;1.正常根;2.质粒DNA;3.诱导根
2.6 黄花败酱液体培养基筛选 使用不同种类的液体培养基对毛状根的生长增殖状态影响也不相同。本实验经过25 d后观察统计,毛状根在MS液体培养基中生长迅速,转化根系发达并具许多细小的分枝,而且增殖倍数最高为21.8倍,其他培养基中增殖倍数依次为B5(18.7倍)、1/2MS(16.5倍)、R2(10.4倍)。由此可见MS液体培养基更适合用于黄花败酱毛状根增殖的培养。如图6所示。

表3 不同pH对黄花败酱毛状根的影响
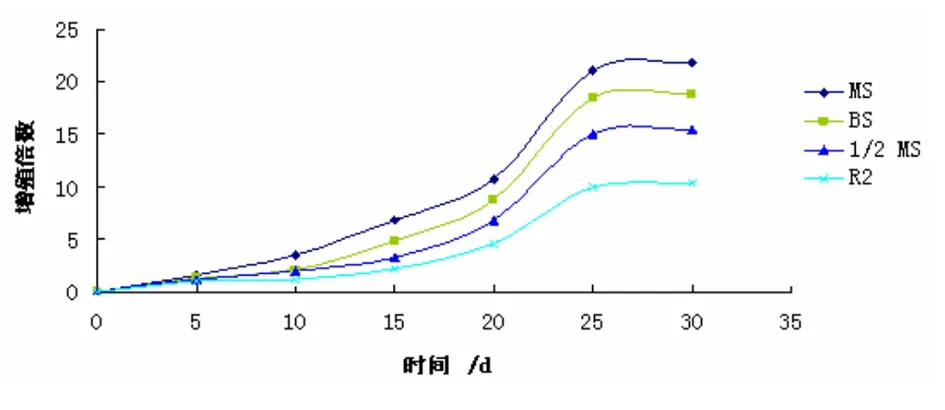
图6 培养基种类对黄花败酱毛状根生长的影响
2.7 不同pH对毛状根的影响 毛状根增殖培养的液体培养液,因培养液的pH值不同,毛状根的增殖量也不同,一般认为酸性pH值对某些农杆菌Vir区基因有激活的作用,pH值一般在5.0~6.0时,有利于农杆菌的转化,由表3可知,黄花败酱毛状根在液体培养基中,当pH为6.0时增殖量达到最大,生长较旺盛;当pH值大于6.0时,毛状根增殖量开始逐渐减少,当pH达到8时,毛状根开始出现老化,停止生长。

图7 蔗糖浓度不同对黄花败酱发状根生长增殖的影响
2.8 不同浓度的蔗糖对发状根增殖的影响 植物外植体在固体MS培养基中诱导出发状根后,为了使其能进行扩增培养,一般将其剪切放置液体培养基中进行悬浮培养,本实验选用MS液体培养基,为了研究不同浓度的碳源对发状根的增殖和和次生代谢产物的含量有什么不同的影响,试验操作过程中在MS液体培养基中分别加入浓度为5 g/L、10 g/L、20 g/L、30 g/L、40 g/L、50 g/L的蔗糖,25 d后称取发状根鲜重。实验结果如图7,图8所示,蔗糖浓度在40 g/L时,毛状根的增殖量平均最多达到20.93倍。而在50 g/L浓度时增殖倍数呈现下降趋势,其增殖倍数为15.09,由此在MS液体培养基中加入40 g/L蔗糖浓度为最佳。

图8 黄花败酱发状根的增殖
注:a.发状根;b.发状根增殖;c.干燥的发状根
2.9 黄花败酱毛状根总黄酮含量测定 根据总黄酮的标准曲线y=0.065 6x+0.000 6,相关系数r为0.999 6,按照总黄酮含量公式计算出黄花败酱毛状根、自然根中总黄酮的含量分别为9.12%、7.89%。黄花败酱毛状根中总黄酮的含量是自然根的1.16倍。
2.9.1 阳性药的筛选 经反复实验得知,抑菌圈的直径要适度,直径过小,增大实验误差;直径过大,抑菌圈会覆盖到相邻纸片处,影响测量的准确度[13]。结果见表4。由实验结果显示,抑制金黄色葡萄球菌、沙门氏菌的最佳阳性药为头孢曲松钠注射液(1.00 mg/mL)。

表4 不同阳性药的抑菌圈直径
2.9.2 黄花败酱发状根提液的抑菌作用考察 经过抑菌培养,与阳性药抑菌圈直径大小的对比结果,最终发现黄花败酱发状根总黄酮粗提取液在金黄色葡萄球菌的培养基中,其抑菌圈较圆且抑菌直径较大,有明显的抑菌作用,而在沙门氏菌的培养基中抑菌圈直径很小且抑菌圈模糊不清,说明作用一般,对大肠杆菌几乎没有抑制作用。其中总黄酮提取物对金黄色葡萄球菌的抑菌率为40.6%,对沙门氏菌抑菌率为7.2%。结果见表5,图9。对金黄色葡萄球菌的抑菌率比沙门氏菌高出5.63倍。

表5 黄花败酱发状根总黄酮粗提液对几种微生物的抑菌圈直径
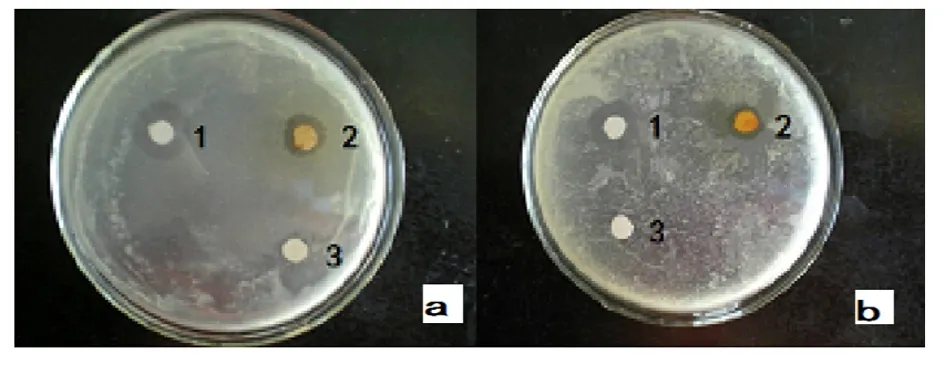
图9 总黄酮粗提液抑菌效果
注:a.对金黄色葡萄球菌的抑制;b.对沙门氏菌的抑制。1.阳性药抑菌圈;2.黄酮抑菌圈;3.对照组抑菌圈
3 讨论
本实验在选用种子消毒剂为4%次氯酸和0.1%升汞,两种消毒剂均能对其起到消毒作用,但对比来看4%次氯酸的作用效果能佳,故在之后的实验过程中,均采取此方法。发根农杆菌1601,15834,1000,A4,均能诱导黄花败酱外植体产生发状根,但是A4诱导出的发状根粗壮且长势较好,发状根诱导率最高为79.17%。在预培养和共培养均为48 h,侵染8 min,发状根诱导率为83.33%本研究通过PCR检测A4中Ri质粒T-DNA的生根基因已整合进入黄花败酱发根基因组中,在发根扩大培养中,在液体MS培养基pH值为6时中加入40 g/L蔗糖时最适合发根的扩大培养。最终测得黄花败酱毛状根中总黄酮的含量是自然根中黄酮含量的1.16倍,且总黄酮提取物对金黄色葡萄球菌的抑菌率比沙门氏菌高出5.63倍。
[1]李玉基,张淑娜,李洁,等.黄花败酱草对小鼠肝癌细胞血道转移的影响[J].食品与药品,2013,15(4):248-250.
[2]杨柳,姜海.黄花败酱草化学成分和药理作用的研究进展[J].中医药信息,2012,29(4):169-172.
[3]高亮,张琳,刘江云,等.黄花败酱的化学成分研究[J].中草药,2011,42(8):1477-1480.
[4]张舒娜,邵财,张浩,等.黄花败酱不同居群的形态多样性分析[J].吉林中医药,2014,34(7):710-712.
[5]王盈.黄花败酱的化学成分及药理作用研究进展[J].齐鲁药事,2009,28(4):222-225.
[6]谭超,孙志良,周可炎,等.黄花败酱化学成分及镇静抑菌作用研究[J].中兽医医药杂志,2003(4):3-5.
[7]HuangY,SuCY,KuoHJ,et al.A comparison of strategies for multiple-gene co-transformation via hairy root induction[J].Appl Microbiol Biotechnol,2013,97(19):8637-8647.
[8]张来,罗正伟,张显强,等.发根农杆菌Ri质粒的特征及其应用[J].安徽农业科学,2010,38(15):8183-8185.
[9]陈伟莉,牟旭鹏,刘冬影.毛状根在植物次生代谢产物生产方面应用的研究进展[J].黑河学院学报,2010,1(4):122-126.
[10]张淑丽,张天柱,杨世海.水飞蓟发状根培养体系的建立及其水飞蓟宾含量的测定[J].中国中药杂志,2014,39(11):2005-2010.
[11]唐浩国,单方方,魏晓霞,等.牡丹叶总黄酮抑菌活性研究[J].时珍国医国药,2009,20(6):1355-1357.
[12]张海弢,包京姗,杨世海,等.王不留行毛状根的诱导及培养[J].中国实验方剂学杂志,2013,19(6):141.
[13]佟春兰,包海鹰,图力古尔.蒙古口蘑子实体石油醚提取物的化学成分及抑菌活性[J].菌物学报,2010,29(4):619-624.
(2015-08-12收稿 责任编辑:王明)
热烈庆祝《世界中医药》杂志第二届编辑委员会编委黄璐琦教授被评为中国工程院院士
2015年12月7日,中国工程院公布了2015年院士增选名单,《世界中医药》杂志编委黄璐琦教授当选医药卫生学部院士,同时也是今年年龄最小的院士。黄院士是中药资源与鉴定专家,中国中医科学院常务副院长,首席研究员,中药资源中心主任,全国中药资源普查试点工作专家指导组组长,科技部重点领域中药资源创新团队负责人,部局共建道地药材国家重点实验室(培育基地)负责人,曾任国家973计划项目首席科学家。黄院士以第一作者或通讯作者发表论文371篇,包括PNAS,JACS等SCI文章86篇,获国家发明专利11项。黄院士为中医药事业的发展做出了突出贡献,影响巨大,院士称号实至名归。
喜讯传来,《世界中医药》杂志社倍感骄傲和自豪,黄院士作为杂志社的编委,必将扩大《世界中医药》杂志的影响力,提升杂志的整体形象,对杂志创品牌期刊具有十分重要的意义。
Establishment of Culturing System for Patrinia scabioscaefolia Fisch Hairy Roots and the Evaluation of Antibacterial Effect
Zhao Xue1,2,3, Kong Weijun2, Ma Xinyue1, Chang Guiying1, Dong Changying1, Yang Shihai3
(1JilinAgriculturalScienceandTechnologyCollege,Jilin132101,China; 2InstituteofMedicinalPlantDevelopment,ChineseAcademyofMedicinalSciences&PekingUnionMedicalCollege,Beijing100193,China; 3JilinAgriculturalUniversity,Changchun130118,China)
Objective:To establish the hairy roots culture system of Patrinia scabioscaefolia Fisch and analyze the flavone content in hairy roots culturing system and its antibacterial role of basic research.Methods:Hairy root of Patrinia scabioscaefolia Fisch were induced by the infection of four Agrobacterium rhizogenes strains: R15834, R1601, R1000, and A4. The infecting time, pre-culture and co-culture time on growth of hairy root were studied, and the hairy roots were detected by PCR. The purity of flavone was determined by UV, and determination of inhibition was tested by disk diffusion method.Results:The highest induction frequency was obtained from stem segment with 48 h pre-culture and co-culture which were induced by A4 for 8 min. The transformation frequency and proliferation rate could be raised by culture media with sucrose concentration of 40 g/L. The PCR examination result showed that rolB genes were successfully inserted into the hairy roots of Patrinia scabioscaefolia Fisch.Conclusion:Hairy root of flavonoids content is higher than that of the natural content and that the aqueous extrats had obvious antibacterial effect against Staphylococcus aureus.
Patrinia scabioscaefolia Fisch; Agrobacterium rhizogenes; Hairy root; Antibacterial effect
吉林省教育厅“十二五”科学技术研究规划项目(编号:吉教科合字[2015]第376号);长白山重点实验室培育项目(编号:吉农院合字[2013]第S001号)
赵雪(1982.1—),男,医学硕士,讲师,研究方向:中药学,E-mail:yingxiongxiaoxue@163.com
R285.5
A
10.3969/j.issn.1673-7202.2015.12.032
