桑白皮化学拆分工艺及互不交叉性研究
2015-04-25王小兰张艳丽张明辉匡海学冯卫生郑晓珂
王小兰 王 绅 赵 威 张艳丽 张明辉 匡海学 冯卫生 郑晓珂
(1 河南中医学院,郑州,450046;2 呼吸疾病诊疗与新药研发河南省创新中心,郑州,450046;3 黑龙江中医药大学,哈尔滨,150040)
桑白皮化学拆分工艺及互不交叉性研究
王小兰1,2王 绅1,2赵 威1,2张艳丽1,2张明辉1,2匡海学3冯卫生1,2郑晓珂1,2
(1 河南中医学院,郑州,450046;2 呼吸疾病诊疗与新药研发河南省创新中心,郑州,450046;3 黑龙江中医药大学,哈尔滨,150040)
目的:建立桑白皮全成分的拆分工艺,并对各拆分组分进行互不交叉性研究与工艺稳定性考察。方法:首先采用水煎、萃取、醇沉、大孔吸附树脂等技术建立桑白皮化学组分的拆分方法;然后运用HPLC-PDA、HPLC-ELSD色谱法与ChemPattern化学计量学软件相结合,采用主成分分析法与聚类分析法探讨各拆分组分是否有交叉。结果:桑白皮的全成分拆分为5个组分,将不同检测器的HPLC色谱数据结合化学计量学分析,结果显示各拆分组分互不交叉,该工艺所得10批次各拆分组分,通过HPLC-PDA特征图谱研究,进行相似度评价,工艺稳定。结论:本研究建立了稳定的桑白皮化学组分拆分工艺,该工艺稳定、重现性良好,各个拆分组分基本无化学成分交叉。
桑白皮化学拆分工艺;HPLC-PDA;HPLC-ELS;互不交叉性分析;化学计量学分析
中药性味理论是中药药性理论的核心,是几千年来中医临床用药的重要依据,近年来,随着中医药现代化研究发展,有关中药药性研究也日益增多,本研究首席科学家匡海学教授提出来“一药X味Y性(Y≤X)。中药性味的物质基础是可拆分性、可组合性”的中药性味理论研究新假说,遵循这一理论,本研究以桑白皮为研究对象,采用中药性味可拆分性的研究模式[1],结合现代仪器分析技术,对桑白皮化学组分拆分工艺进行研究,并且应用ChemPattern软件对各拆分组分进行化学计量学分析,探讨各拆分组分互不交叉性与工艺的稳定性,为进行桑白皮性味药理评价奠定基础。
1 材料
1.1 药材 所用桑白皮购自郑州市中药材市场,由河南中医学院陈随清教授鉴定为桑科植物桑MorusalbaL.的干燥根皮。
1.2 设备与试剂 Waters2695高效液相色谱仪,2998PDA检测器,Waters 2424ELSD检测器;BIOMATE3S型紫外分光光度计(美国热电);Empower色谱数据工作站;ChemPattern化学计量学系统解决方案软件(科迈恩科技有限公司);BT-25S型十万分之一电子天平(赛多利斯);Arium 611 VF超级组合型超纯水器(SARTORIUS),Q-250A3粉碎机;流水式抽气机(上海爱朗仪器有限公司);SK2200H型超声波清洗器(上海科导超声仪器有限公司);DZKW-4电子恒温水浴锅(北京中兴伟业仪器有限公司);SB-1000型旋转蒸发器(上海爱朗仪器有限公司);迪马PLATISIL(TM)ODS C18柱(4.6 mm×250 mm,5 μm);DiaionHP-20大孔吸附树脂(日本三菱公司),甲醇(美国天地公司,色谱醇);乙腈(美国天地公司,色谱醇);95%乙醇(北京化工厂,分析纯);水(超纯水)。
2 方法与结果
2.1 桑白皮各化学组分拆分工艺的研究 桑白皮水煎液提取方法考察:影响传统中药汤剂质量的主要因素包括加水量、煎煮次数及煎煮时间等。因此本研究采用L9(33)正交实验考察上述3因素对桑白皮水煎煮提取率的影响,确定工艺为:10倍量水煎煮3次,每次1 h。
桑白皮全成分提取工艺建立:桑白皮1000 g,10倍量水煎煮3次,每次1 h,纱布过滤,合并滤液,浓缩干燥得桑白皮水煎液,提取率为17%。
桑白皮全成分拆分工艺建立:桑白皮水煎液减压浓缩,加其2倍量的石油醚萃取,上清液浓缩回收溶剂后真空干燥6 h,得石油醚组分(该组分为脂肪油拆分组分),提取率为3.10%,其余水提液上DiaionHP-20柱,依次用水、30%乙醇、50%乙醇、80%乙醇洗脱,得到桑白皮30%、50%、80%乙醇拆分组分,提取率分别为5.8%、0.31%、0.25%,其中,水洗脱部分经过醇沉得到多糖拆分组分,提取率分别为4.4%。
2.2 供试品溶液的制备 精密称取桑白皮25 g,10倍量的水提取3次,提取时间为1 h,提取液经减压浓缩、离心、过滤,将所得滤液浓缩至干,加入流动相超声溶解,定容于50 mL容量瓶中,经0.22 μm微孔滤膜过滤,即得。
2.3 桑白皮水煎液色谱条件建立[2-5]色谱柱为迪马PLATISIL(TM)ODS C18柱(4.6 mm×250 mm,5 μm);以流动相甲醇(A)-0.1%磷酸水(B)梯度洗脱,洗脱程序见表1,流速:1.0 mL/min,检测波长:280 nm。
2.4 方法学考察 方法学考察中进行了精密度、稳定性的研究,结果表明仪器精密度符合要求,标准品在24 h内稳定,样品处理操作重现性良好,保证了实验结果的准确、可靠。

表1 桑白皮水煎液HPLC梯度洗脱条件
2.4.1 精密度试验 取同一批桑白皮药材,按“2.2”项制备供试品溶液,按上述色谱条件各拆分组分分别连续进样6次,以考察仪器重现性。色谱图导入中药色谱指纹图谱相似度评价系统,计算保留时间及峰面积的RSD值。其RSD值均小于3%,表明色谱系统精密度良好。
2.4.2 稳定性试验 取同一批桑白皮药材,按“2.2”项制备供试品溶液,分别在0 h、4 h、8 h、16 h、24 h测定HPLC色谱图,以考察24 h内的稳定性。色谱图导入中药色谱指纹图谱相似度评价系统,计算保留时间及峰面积的RSD值。RSD小于3%,表明样品在24 h内性质稳定。
2.5 桑白皮化学拆分组分互不交叉性研究 根据2.1中拆分工艺得到的5个拆分组分,在建立了桑白皮水煎液HPLC色谱条件的基础上,本实验对各拆分组分的互不交叉性进行研究,在桑白皮的5个拆分组分中脂肪油组分、挥发油组分以及醇沉组分,因沸点与分子量差异较大,不存在与其他组分交叉,故本实验采用HPLC-PDA色谱法主要对桑白皮的30%乙醇、50%乙醇以及80%乙醇洗脱组分进行了初步互不交叉研究,为下一步深入研究奠定基础。
2.5.1 桑白皮水煎液HPLC-PDA色谱条件下的结果 将“2.1”项下制备的各拆分组分样品,按确定的桑白皮水煎液HPLC色谱条件进行测定,并将各图谱进行叠加。根据出峰情况,可以看出,各拆分组分与水煎煮总提物相比基本上未出现成分缺失,基本实现了全成分拆分。从保留时间上可以观察到:30%乙醇洗脱组分集中在0—45 min,50%乙醇洗脱组分集中在35—65 min,80%乙醇洗脱组分集中在60 min以后。各拆分组分且峰值较高的成分从保留时间来看,基本上无重叠,提示个拆分组分成分基本无交叉,结果见图1。
2.5.2 采用不同流动相及检测器进一步确认各组分的互不交叉性 中药成分非常复杂,为了进一步确认结果的准确与可靠,全面检测各拆分组分化学成分之间的互不交叉性,最终验证拆分工艺的成功,本研究首先分别建立了30%乙醇、50%乙醇以及80%乙醇洗脱组分的HPLC色谱条件,进而分别采用三种不同的色谱条件,在HPLC-PDA与HPLC-ELSD的检测器下,验证各拆分组分的互不交叉性。
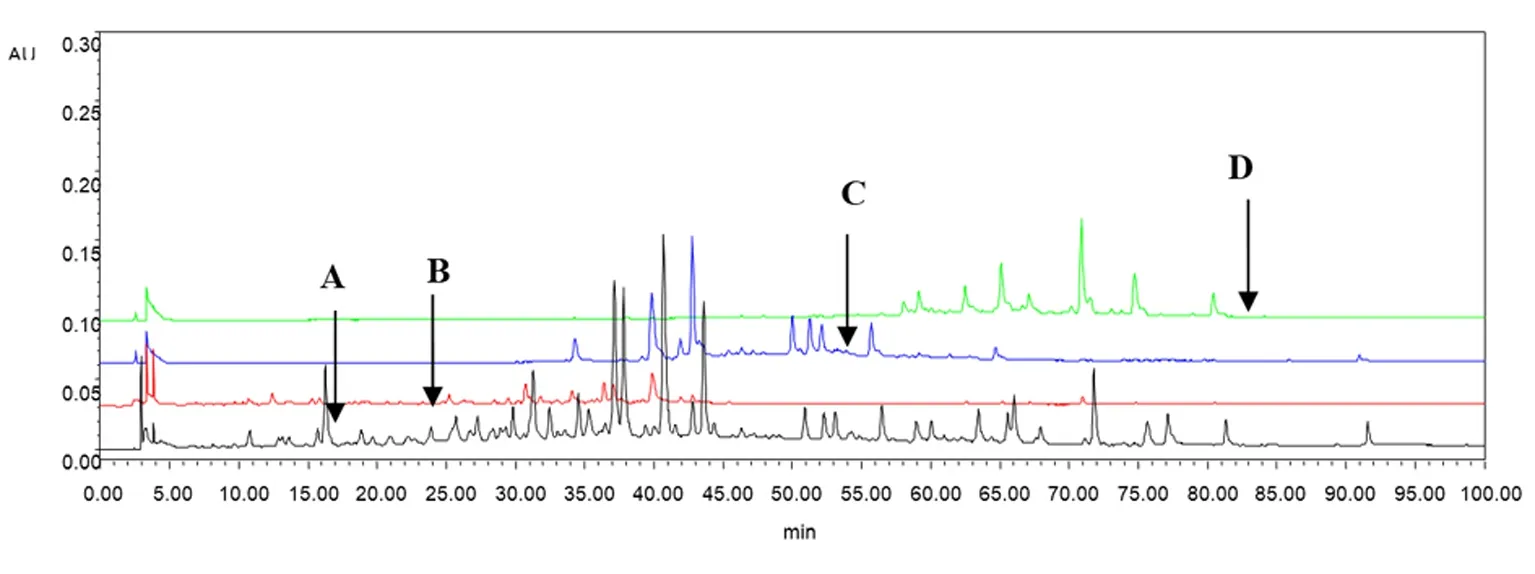
图1 HPLC叠加图
注:A.水煎总提物,B.30%乙醇洗脱组分,C.50%乙醇洗脱组分,D.80%乙醇洗脱组分
2.5.2.1 桑白皮各拆分组分HPLC色谱条件的建立 1)HPLC-PDA色谱条件:色谱柱:PLATISIL(TM)ODS C185 μm,250 mm×4.6 mm;流动相梯度洗脱条件见表2;流速:1.0 mL/min,柱温:30 ℃;检测波长:280 nm。
2)蒸发光检测器(ELSD):色谱柱:菲罗门Synergi Fusion-RP色谱柱(250 mm×4.6 mm,4 μm);流动相梯度洗脱程序见表2;流速:1 mL/min,;柱温:30 ℃;增益:10;数据率:10;漂移管温度:60 ℃;气体压力:40 psi;喷雾器模式为加热,其动力水平为36%。

表2 各拆分组分HPLC流动相梯度洗脱程序
2.5.2.2 采用HPLC-PDA色谱法对桑白皮各拆分组分互不交叉性研究 分别以30%,50%,80%乙醇洗脱组分HPLC色谱条件验证各拆分组分的互不交叉性(见表2)。采用30%乙醇洗脱条件时,50%、80%乙醇洗脱组分在0—65 min之间基本无相应的色谱峰出现;在50%乙醇洗脱条件下分析,30%、80%乙醇洗脱组分在45—75 min之间基本无相应的色谱峰出现;采用80%乙醇洗脱条件时,30%、50%乙醇洗脱组分在34—65 min之间基本无相应的色谱峰出现。结果显示,采用PDA检测器,在不同的流动相下对3种拆分组分反复比对,结果显示采用不同的流动相各拆分组分保留时间基本无交叉,见图2-图4。

图2 各拆分组分HPLC-PDA色谱图(30%乙醇洗脱组分流动相)
注:A:桑白皮30%乙醇洗脱组分;B:桑白皮50%乙醇洗脱组分;C:桑白皮80%乙醇洗脱组分

图3 各拆分组分HPLC-PDA色谱图(50%乙醇洗脱组分流动相)
注:A:桑白皮30%乙醇洗脱组分;B:桑白皮50%乙醇洗脱组分;C:桑白皮80%乙醇洗脱组分
2.5.2.3 采用HPLC-ELSD色谱法对桑白皮各拆分组分互不交叉性研究 同“2.5.2.2”项下分析方法。对紫外下没有吸收的成分,采用HPLC-ELSD色谱法进行了互不交叉研究,从HPLC-ELSD色谱图中可以看到各拆分组分化学成分无明显交叉,见图5-图7。

图4 各拆分组分HPLC-PDA色谱图(80%乙醇洗脱组分流动相)
注:A:桑白皮30%乙醇洗脱组分;B:桑白皮50%乙醇洗脱组分;C:桑白皮80%乙醇洗脱组分

图5 各拆分组分HPLC-ELSD色谱图(30%乙醇洗脱组分流动相)
注:A:桑白皮30%乙醇洗脱组分;B:桑白皮50%乙醇洗脱组分;C:桑白皮80%乙醇洗脱组分

图6 各拆分组分HPLC-ELSD色谱图(50%乙醇洗脱组分流动相)
注:A:桑白皮30%乙醇洗脱组分;B:桑白皮50%乙醇洗脱组分;C:桑白皮80%乙醇洗脱组分
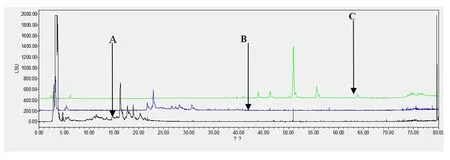
图7 各拆分组分HPLC-ELSD色谱图(80%乙醇洗脱组分流动相)
注:A:桑白皮30%乙醇洗脱组分;B:桑白皮50%乙醇洗脱组分;C:桑白皮80%乙醇洗脱组分
2.6 桑白皮化学拆分工艺稳定性研究 为了确保桑白皮拆分工艺的稳定性与重现性,本研究对桑白皮各化学拆分工艺稳定性进行了研究:取桑白皮药材约5kg,分为10批,每批500 g,按照“2.1”项下的拆分方法制备得到10批次各拆分组分,通过HPLC-PDA特征图谱研究,进行相似度评价,从而确定工艺的稳定性。
相似度评价:按照按“2.1”项下得到的10批各拆分组分的供试品溶液,根据各自色谱条件进样,所得特征谱图导入中药色谱指纹图谱相似度评价系统,相似度0.90以上,说明该拆分工艺稳定,重现性好,适用于制备各拆分组分。
2.7 化学计量学分析 将“2.6”项下制备的10批样品进行编号:30%乙醇洗脱组分1-10,50%乙醇洗脱组分11-20,80%乙醇洗脱组分21-30。按照“2.5.2.1”项下条件进行HPLC-PDA与HPLC-ELSD分析,所得数据导入ChemPattern软件进行多元统计分析
2.7.1 主成分分析 本实验获得的3个主成分。由3D散点图(见图8,图9),可直观地看出,在两种检测器下,3个主成分将原始组分分为不同的3类,聚在空间不同的位置:30%乙醇洗脱组分位于PC1零点附近,50%乙醇洗脱组分位于PC2正轴附近,80%乙醇洗脱组位于PC3正轴附近。
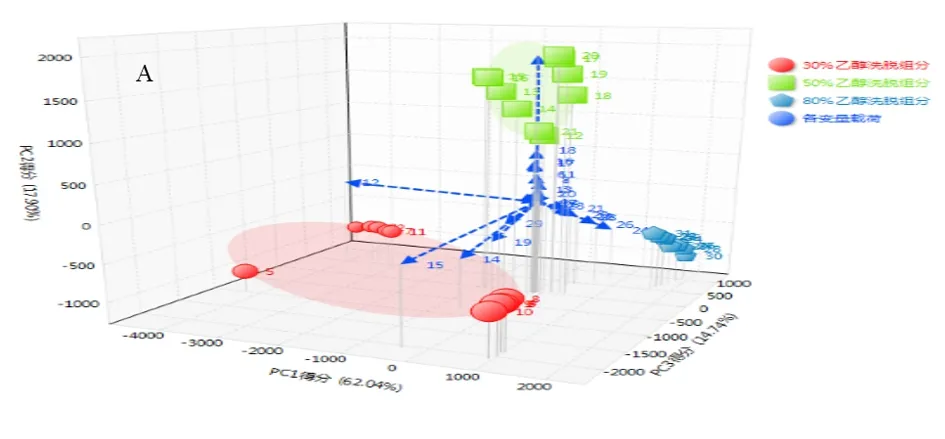
图8 桑白皮HPLC-PDA色谱数据主成分分析结果

图9 桑白皮HPLC-ELSD色谱数据主成分分析结果
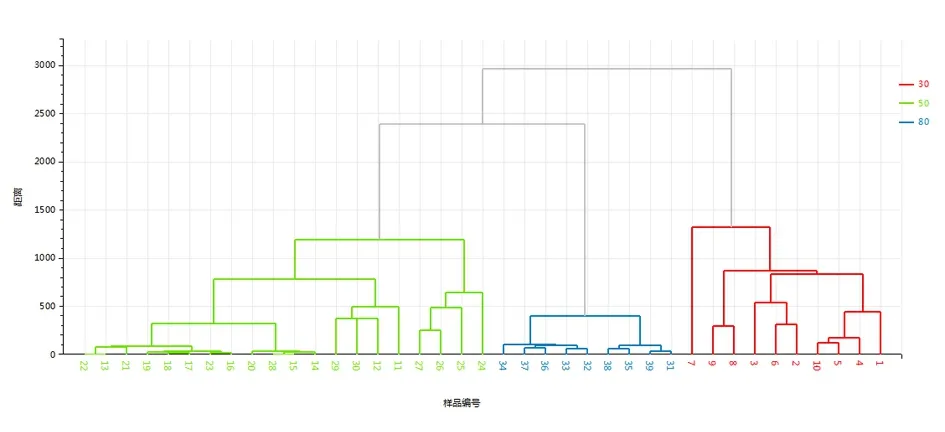
图10 桑白皮各化学拆分组分HPLC-PDA聚类分析树状图
2.7.2 聚类分析 采用欧氏距离法计算样品间相似度,选用最短距离法进行聚类。根据桑白皮3个拆分组分的拆分方法,将最佳方案的30个组分聚为3类,见图10,11,样本1~10号为一类、11~20号为一类、21~30号为一类。验证了30%、50%、80%乙醇洗脱组分各聚一类,互不交叉。

图11 桑白皮各化学拆分组分HPLC-ELSD聚类分析树状图
3 讨论
匡海学教授研究显示,中药性味的物质基础是可拆分的,而拆分组分的功效对应相应的物质基础[6],各拆分组分之间化学成分要求基本上为互不交叉,才能为后续的中药性味功效的药理实验奠定基础。中药桑白皮为桑科植物桑Morus alba L.的干燥根皮,主要功效为:泻肺平喘,利水消肿。临床应用广泛,其化学成分类型主要为黄酮、二苯乙烯、多糖等[7-9]。桑白皮化学拆分组分的工艺建立原则是对桑白皮全部化学成分进行拆分,并且尽可能的避免成分的交叉,为后续的药理实验提供基础。
本研究初次构想用聚酰胺色谱柱来富集黄酮类化合物[10-11],但黄酮类化合物与二苯乙烯类化合物结构相似很难将黄酮类化合物单独富集出来。另外,根据预实验发现桑白皮水煎液浓缩上聚酰胺树脂会有死吸附,很多物质用70%丙酮溶液也难以将其洗脱下来,这样就达不到全成分拆分的效果,此拆分方法不适合中药药性拆分研究,故采用水煎煮提取法结合萃取、醇沉、大孔吸附树脂等技术,将桑白皮水煎液拆分为成分之间互不交叉的以下5个组分:脂肪油组分、醇沉组分、30%乙醇洗脱组分、50%乙醇洗脱组分、80%乙醇洗脱组分。脂肪油组分通过GC-MS分析桑白皮脂肪油成分分离检测出38个组分,含量最为丰富的物质为角鲨烷,占50.40%,其次为α-香树脂素(10.86%)、亚油酸甲酯(9.33%)、β-香树脂素(4.84%)、棕榈酸甲酯(3.08%)、油酸甲酯(1.76%)等[12]。
本研究采用PDA与ELSD两种检测器、不同洗脱条件来验证桑白皮化学组分拆分的互不交叉性,用ChemPattern软件将所得HPLC-PDA及HPLC-ELSD数据进行处理,对10个批次的桑白皮30%乙
醇洗脱组分,50%乙醇洗脱组分、以及80%乙醇洗脱组分进行了化学计量学分析[13],通过聚类分析与主成分分析确认30%、50%、80%乙醇洗脱组分各聚一类,进一步验证了桑白皮化学拆分组分的互不交叉。
综上所述,本研究建立了桑白皮化学成分拆分工艺以及各拆分部位HPLC色谱条件,确定了桑白皮各拆分组分的互不交叉性,为后期的各拆分组分的药理学评价奠定了基础。
[1]匡海学,王艳宏,王秋红,等.基于中药性味可拆分性和可组合性的中药性味理论研究新模式[J].世界科学技术-中医药现代化,2011,13(1):25-29.
[2]刘布鸣,刘偲翔,林霄,等.十大功劳HPLC指纹图谱及聚类分析[J].中国实验方剂学杂志,2012,18(4):95-99.
[3]李小亭,李瑞盈,相海恩,等.基于HPLC指纹图谱及聚类分析对不同产地枸杞质量评价研究[J].现代食品科技,2012,28(9):1251-1252.
[4]曾广胜,盛卫国,叶剑锋,等.油菜花粉脂肪酸成分气相指纹图谱研究及聚类分析[J].医药导报,2013,32(5):677-680.
[5]Liu L,JinH,SunL,et al.Determination of Aflatoxins in Medicinal Herbs by High‐performance Liquid Chromatography-Tandem Mass Spectrometry[J].Phytochemical Analysis,2012,23(5):469-476.
[6]王艳宏,王秋红,夏永刚.麻黄化学拆分组分的性味药理学评价-化学拆分组分的制备及其解热作用的研究[J].中医药信息,2011,28(5):7-10.
[7]长安,姚淑英,薛多清,等.桑白皮中1个新的异戊二烯基取代黄酮(英文)[J].中国中药杂志,2010,35(12):1560-1565.
[8]张敉,陈曼,张涵庆,等.桑白皮的化学成分研究[J].天然产物研究与开发,2010,22(3):416-418.
[9]王瑾,张会敏,石俊英.桑白皮黄酮类化学成分研究进展[J].齐鲁药事,2012,31(7):420-422.
[10]张金杰,陈宇峰,苏明智,等.聚酰胺柱色谱分离纯化野菊花中黄酮苷研究[J].中国药师2012,15(5):616-620.
[11]陈丛瑾.柱色谱法分离纯化黄酮类化合物研究进展[J].西北药学杂志,2011,26(2):151.
[12]郑晓珂,王绅,张明辉,等.GC-MS结合保留指数分析桑白皮脂肪油成分[J].中国新药杂志,2015,24(2):228-230.
[13]李钦,候新文,田润涛,等.用于复杂体系及仪器大数据分析的化学计量学软件ChemPattern的研制与应用[J].计算机与应用化学,2014,31(3):268-274.
(2015-12-09收稿 责任编辑:洪志强)
Splitted Fractions and Unoverlapping Analysis of Chemical Constituents of Cortex Mori
Wang Xiaolan1,2,Wang Shen1,2,Zhao Wei1,2,Zhang Yanli1,2,Zhang Minghui1,2,Kuang Haixue3,Feng Weisheng1,2,Zheng Xiaoke1,2
(1HenanUniversityofTraditionalChineseMedicine,Zhengzhou450046,China; 2TheinnovationcenterofHenanprovinceforthediagnosisandtreatmentofrespiratorydiseases,Zhengzhou450046,China; 3HeilongjiangUniversityofTraditionalChineseMedicine,Haerbin150040,China)
Objective:Toestablished the split method of nature and flavor material foudition of Cortex Mori,analysis of Cortex Mori chemical characteristics of the split components by HPLC,validae the unoverlapping analysis of Chemical Constituents of Cortex Mori in chemometrics methods.Methods:Established Cortex Mori chemical composition of the split method by steam distillation,extraction,alcohol,macroporous adsorption resin technology.With the combined applications of steam distillation,water extraction and alcohol precipitation,liquid-liquid extraction and column chromatography over macroporous resin,thesplitted-fractions method of the chemical constituents of poriacocos was established; Unoverlapping Analysis of Chemical Constituents of Cortex Mori by combining the HPLC-PDA and HPLC-ELSD in ChemPatternclustering analysis and principal component analysis.Results:We splitted the material basis of decoction of Cortex Mori for 5 groups,each group compositions substantially free of chemical components intersect.The process is stable and controllable by 10 batch in similarity evaluation.Conclusion:The split technology of nature and flavor material foundation of Cortex Mori is stable and practical,Indicated that Cortex Mori resolvability constituent holo-composition which was detached uncross as each one could be well separated under no supervision mode.
Cortex Mori;Chemical split fraction;Unoverlapping Analysis
国家重点基础研究发展计划(973计划)资助项目:《宣泻利水中药的药性研究》(编号:2013CB531802)
王小兰,女,助理研究员,药物化学专业
郑晓珂,女,博士,教授,博士生导师,E-mail:zhengxk.2006@163.com,Tel:(0371)65680011
R932
A
10.3969/j.issn.1673-7202.2015.12.006
