基于肝基因表达谱分析的黄芪及其拆分组分对脾虚水湿不化大鼠脂质代谢影响的机制研究
2015-04-25赵文晓季旭明蒋海强韩冰冰王世军
崔 宁 赵文晓 季旭明 蒋海强 韩冰冰 高 洁 韩 旭 王世军
(1 山东中医药大学中医学院,济南,250355;2 山东中医药大学护理学院,济南,250355;3 山东中医药大学药学院,济南,250355)
基于肝基因表达谱分析的黄芪及其拆分组分对脾虚水湿不化大鼠脂质代谢影响的机制研究
崔 宁1赵文晓2季旭明1蒋海强3韩冰冰1高 洁1韩 旭1王世军1
(1 山东中医药大学中医学院,济南,250355;2 山东中医药大学护理学院,济南,250355;3 山东中医药大学药学院,济南,250355)
目的:探讨黄芪及其拆分组分对脾虚水湿不化大鼠肝脏脂质代谢影响的分子机制。方法:采用高脂低蛋白饮食+负重游泳复合因素诱导6周,建立脾虚水湿不化大鼠模型,造模后给予黄芪及其拆分组分(水提物、黄酮、皂苷、多糖)干预2周,检测肝脏的病理变化,并通过基因芯片检测黄芪及其拆分组分对脾虚水湿不化大鼠脂质代谢调节通路的影响。结果:与正常对照组相比,脾虚水湿不化大鼠肝脏体积变大,肝细胞肿胀呈空泡样变,PPARα信号通路基因fabp4、olr1、cpt1b下调,me1、cyp7a1和aqp7基因上调。与脾虚水湿不化大鼠相比,黄芪及其拆分组分组空泡样变肝细胞数目明显减少,细胞肿胀程度减轻。与脾虚水湿不化大鼠相比,黄芪水煎液组cyp7a1基因下降,olr1和fabp4基因升高,黄芪黄酮组fabp4基因升高,aqp7基因下降,黄芪多糖组cyp7a1基因下降,olr1和cpt1b基因升高;黄芪水煎液组亚油酸代谢通路pla2 g4a、pla2 g2d、cyp2c12、loc687842升高,黄芪皂苷组pla2 g4a、pla2 g2d和loc687842升高,黄芪多糖组cyp2c12和loc687842升高。结论:黄芪及其拆分组分(黄酮、皂苷和多糖)可以不同程度的改善脾虚水湿不化大鼠的肝脏形态和功能,其机制可能与调节肝脏脂质代谢PPARα信号通路(关键基因为me1、cyp7a1、aqp7、fabp4、olr1、cpt1b)和亚油酸代谢通路(关键基因为pla2 g4a、pla2 g2d、cyp2c12、loc687842)有关,黄芪各拆分组分中多糖组分为调节脂代谢的主要物质。
脾虚水湿不化;黄芪;基因芯片;脂质代谢
中药药性理论包括性味、归经、毒性、升降浮沉等,是中医理论的重要组成部分,其中性味理论是中药药性理论的核心。基于前期研究,本项目组提出中药性味科学内涵假说[1]:“药味主要与药物的具体功效相关。药性(气)是药物通过不同途径以主要影响机体的能量代谢及与能量代谢相关的物质代谢为特征的、与治疗作用有关或无关的、但均可影响药物治疗作用的发挥或与副作用发生有关的一类生物学效应。即促进机体能量及与能量代谢相关的物质代谢的中药具有热(或温)性,抑制机体能量及与能量代谢相关的物质代谢的中药具有寒(或凉)性。中药性味的物质基础是可拆分、可组合的。”本研究以此中药性味科学内涵假说为依据,研究黄芪健脾祛湿的物质基础和分子机制。
“脾主湿”,为水液代谢枢纽。“诸湿肿满,皆属于脾”,脾运失健,水液代谢失调,则水液停聚,会形成水湿,发为水肿。黄芪为豆科植物蒙古黄芪或膜荚黄芪的干燥根,味甘,微温,归肺、脾经,为“补益脾气之要药”。黄芪具有补气固表,利尿托毒,排脓,敛疮生肌之功,适用于肺脾气虚,输布失常,脾失运化,水湿内停之水肿[2]。目前,关于黄芪健脾祛湿的机制尚不清楚。肝脏是机体物质(糖、蛋白质、脂肪)和能量合成与代谢中心,具有调节血容量及水、电解质平衡等功能。前期研究发现,脾虚水湿不化大鼠出现肝脏功能异常和血脂的紊乱,黄芪能改善脾虚水湿不化大鼠的一般状况,纠正肝脏功能的异常,调节脂代谢,促进水液运化,这可能是其“性温味甘”的功效体现[4]。脾与脂代谢密切相关。中医认为“脂”与津液同源,脂来源于中焦,由脾运化水谷而成。《黄帝内经·灵枢集注》曰:“中焦之气,蒸津液,化其精微,溢于外则皮肉膏肥,余于内则膏肓丰满。”
因此,本研究在前期研究的基础上,采用复合因素建立脾虚水湿不化大鼠模型,利用基因芯片检测黄芪及其拆分组分(水提物、黄酮、皂苷、多糖)对脾虚水湿不化大鼠肝脏脂代谢通路相关基因的影响,以探讨黄芪健脾祛湿的分子机制。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级Wistar大鼠56只,4周龄,体重(150±20)g,雌雄各半,购自北京维通利华试验动物技术有限公司,许可证编号:SCXK(京)2012-0001,于IVC独立送回风净化笼饲养。
1.1.2 药物 黄芪生药材(批号:130107),购自山东百味堂中药饮片有限公司,产自甘肃,为蒙古黄芪,经山东中医药大学中药教研室鉴定为正品,符合《中华人民共和国药典》(2010版)规定。
1.1.2.1 黄芪水煎液制备 按传统临床用药方法对药物进行处理。称取定量黄芪,置入砂锅,放入10倍自来水,煎煮1 h,过滤,重复3次,合并3次滤液,沸水浓缩,制成水煎液浓度为0.54 g生药/mL,4 ℃储存备用。
1.1.2.2 黄芪各拆分组分制备 取黄芪饮片30 kg,分别以10倍量、6倍量、6倍量水煎煮提取3次,提取液过60目筛,合并提取液并浓缩至22 L。加入95%乙醇调浓缩液醇浓度至80%,静置1夜。上清液抽滤后减压收集,下层沉淀部分以水复溶后离心,得到上清液。上清液用95%乙醇调醇浓度至80%。下层沉淀多部位作为多糖组分。两次醇沉上清液合并减压浓缩至8 L。以乙酸乙酯按照1∶1比例萃取10次,后以正丁醇按照1∶1比例萃取10次,分别合并乙酸乙酯层和正丁醇层,并分别浓缩。乙酸乙酯部位作为黄酮组分,正丁醇部位作为皂苷组分,萃取后的残液作为水提物组分。经指纹图谱相似度评价和主成分分析验证黄芪各拆分组分的定性交叉,组分间不交叉性良好,各组分分离,组分间化学成分无交叉。经检测,黄芪多糖组分主要成分为粗多糖402 mg/g;黄芪黄酮组分主要成分为毛蕊异黄酮7.78 mg/g,毛蕊异黄酮苷4.88 mg/g,芒柄花苷4.79 mg/g,芒柄花素3.80 mg/g;黄芪皂苷组分主要成分为黄芪甲苷4.40 mg/g,黄芪皂苷I 0.28 mg/g,黄芪皂苷II1.42 mg/g,黄芪皂苷III 1.31 mg/g。以上拆分组分的制备由山东中医药大学药化教研室完成,并进行质量控制。
1.1.3 试剂和仪器 基因芯片检测中的芯片、RNA提取、纯化,cDNA的合成以及cRNA的纯化杂交等试剂盒和仪器均由上海泉脉生物科技有限公司提供。包括Agilent公司mirVanaTM RNA Isolation Kit试剂盒,Qiagen公司的RNeasy Mini kit试剂盒等。主要仪器包括Agilent公司扫描仪(型号G2505C)、振荡器(型号9600)和杂交炉(型号G2545A),ABI公司的PCR仪(型号2720),Eppendorf公司高速离心机(型号5418)和浓缩仪(型号5301),精宏公司的电热恒温培养箱(型号XMTD-8222)。
1.2 方法
1.2.1 动物模型的建立 大鼠随机分为正常对照组、模型对照组、黄芪水煎液组、黄芪水提物组、黄芪黄酮组、黄芪皂苷组和黄芪多糖组,每组8只。正常对照组给予正常饲料(AIN-76A纯化饲料),模型对照组、黄芪水煎液组、黄芪水提物组、黄芪黄酮组、黄芪皂苷组和黄芪多糖组釆用“饮食失节(高脂低蛋白饮食)+劳倦过度(负重游泳)”复合因素诱导6周,建立脾虚水湿不化大鼠模型[4]。AIN-76A纯化饲料成分:氯化胆碱0.2%,蛋氨酸0.3%,淀粉15%,蔗糖50%,纤维素5%,酪蛋白20%,玉米油5%,多矿3.5%,多维1%。高脂低蛋白饮食即饲以高脂低蛋白饲料,成分:氯化胆碱0.2%,蛋氨酸0.3%,淀粉15%,蔗糖47.5%,纤维素5%,酪蛋白7%,玉米油5%,猪油15%,胆固醇0.5%,多矿3.5%,多维1%。负重游泳:每日下午10%体重负重游泳至力竭,以鼻尖没入水中10 s为力竭。
1.2.2 分组给药 成功建立模型后,黄芪水煎液组、黄芪水提物组、黄芪黄酮组、黄芪皂苷组和黄芪多糖组分别给予黄芪水煎液和各拆分组分进行干预。黄芪水煎液以成人最高剂量2倍(60 g/70 kg)给药,根据等效剂量系数折算法,按单位体重计算大鼠等效剂量为成人6.3倍,大鼠水煎液剂量为5.40 g·kg-1·d-1,其他黄芪拆分组分按其在生药中含量同等剂量给予,分别为黄芪水提物1.32 g·kg-1·d-1、黄芪黄酮0.07 g·kg-1·d-1、黄芪皂苷0.27 g·kg-1·d-1、黄芪多糖1.41 g·kg-1·d-1,灌胃给药,给药体积为1 mL/100 g体重,连续2周,空白对照组和模型对照组给予同体积生理盐水。
1.2.3 肝脏病理学检测 给药结束后处死动物,迅速剥取大鼠肝组织,观察肝脏外观、形状、质地、色泽,取左叶肝脏相同部位相同大小肝组织放入10%甲醛中固定,常规石蜡包埋、切片,HE染色后,光学显微镜下观察、拍照。
1.2.4 肝组织总RNA提取 给药结束后处死动物,迅速剥取大鼠肝组织,放入液氮罐冻存。使用mirVanaTM RNA Isolation Kit试剂盒提取总RNA。每组随机抽取3只质量检测合格的大鼠肝组织总RNA,等比例混合,进行肝基因芯片检测。
1.2.5 基因芯片检测 采用美国Agilent公司的大鼠全基因组表达谱基因芯片Agilent Rat Gene Expression(8*60K,Design ID:028279),上海泉脉生物科技有限公司提供。根据文献[4],进行基因芯片的检测。
1.2.6 芯片数据处理和统计学方法 采用Feature Extraction 10.7.1.1软件进行原始图像的处理和原始数据的分析。Agilent GeneSpring 12.5软件进行quantile标准化和后续处理。根据差异倍数(Fold Change,FC)进行差异基因筛选,以FC>2.0为标准。采用KEGG分析差异基因以明确基因通路。
2 结果
2.1 肝脏病理学变化 正常对照组大鼠肝脏呈鲜红色,表面光滑,边缘锐利。与正常对照组相比,模型对照组大鼠肝脏体积增大,边缘变钝,颜色发黄,切面有油腻感,可见红白相间的颗粒样改变。与正常对照组相比,黄芪水提物组、黄芪黄酮组、黄芪皂苷组和黄芪多糖组大鼠肝脏体积增大,外观与模型对照组类似,也可见红白相间的颗粒样改变。而黄芪水煎液组大鼠肝脏体积正常,外观与正常对照组类似,未见红白相间的颗粒样改变。

图1 各组大鼠肝脏HE染色结果(×200)
HE染色结果如图1所示,正常对照组大鼠肝组织结构完整,肝细胞排列紧密呈条索状,无变性坏死、炎性反应及纤维组织增生;模型对照组肝索排列紊乱,大量肝细胞肿胀,呈脂肪变性,体积较正常肝组织明显增大,细胞核被脂滴挤向一侧,类似脂肪细胞;黄芪水煎液组大鼠肝小叶结构较完整,肝索排列比较清晰,空泡样变肝细胞数目明显减少,少数肝细胞内可见有小泡型脂滴;与模型对照组相比,黄芪各拆分组空泡样变肝细胞数目明显减少,细胞变性及肿胀程度减轻。
2.2 大鼠肝组织RNA提取质量检测 如图2所示,28SrRNA和18SrRNA条带清晰,无拖尾现象,RNA完整性较好,RNA完整性、总RNA浓度及纯度均符合实验要求。

图2 各组肝组织RNA琼脂糖凝胶电泳图
注:G0正常对照组、G1模型对照组、G2黄芪水提物组、G3黄芪水煎液组、G4黄芪黄酮组、G5黄芪皂苷组、G6黄芪多糖组
2.3 PPARα信号通路差异表达基因 如表1所示,与正常对照组相比,脾虚水湿不化大鼠PPARα信号通路基因表达发生明显变化,脂肪酸结合蛋白4(fabp4)基因下调,植物凝集素样氧化型低密度脂蛋白受体-1(olr1)基因下调,肉碱棕榈酰基转移酶1b(cpt1b)基因下调,苹果酸酶1(me1)基因上调,胆固醇7α-羟化酶(cyp7a1)基因上调,水通道蛋白7(aqp7)基因上调。与模型对照组相比,黄芪水煎液组PPARα信号通路基因cyp7a1显著下降,olr1和fabp4显著升高,黄芪黄酮组fabp4显著升高,aqp7显著下降,黄芪多糖组cyp7a1显著下降,olr1和cpt1b显著升高。

表1 各组PPARα信号通路差异表达基因列表
注:正常对照组(G0)、模型对照组(G1)、黄芪水煎液组(G3)、黄芪黄酮组(G4)和黄芪多糖组(G6)。
2.4 亚油酸代谢通路差异表达基因 与模型对照组相比,黄芪水煎液组亚油酸代谢基因磷脂酶A2(pla2 g4a、pla2 g2d)和细胞色素P450(cyp2c12、loc687842)显著升高,黄芪皂苷组pla2 g4a、pla2 g2d和lco687842显著升高,黄芪多糖组cyp2c12和loc687842显著升高。
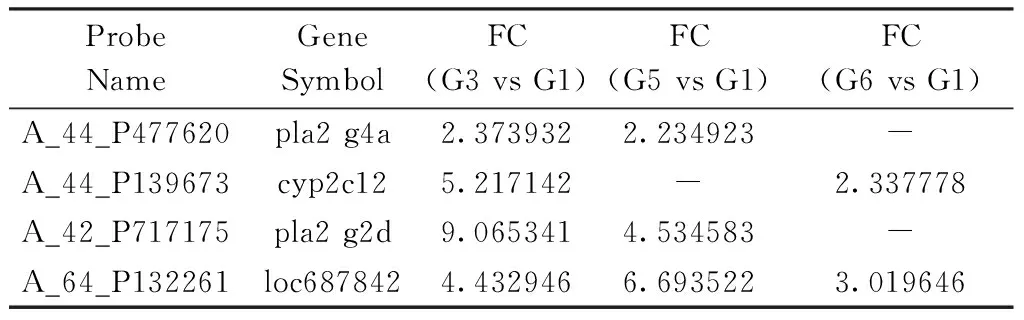
表2 各组亚油酸代谢通路差异基因列表
注:模型对照组(G1)、黄芪水煎液组(G3)、黄芪皂苷组(G5)和黄芪多糖组(G6)。
3 讨论
本研究发现,脾虚水湿不化大鼠出现明显的肝脏形态异常,表现为肝脏体积增大,肝细胞肿胀呈空泡样变,而黄芪及其各拆分组空泡样变肝细胞数目明显减少。本课题组前期研究结果表明,脾虚水湿不化大鼠出现明显的血脂紊乱和肝功异常,表现为谷丙转氨酶、谷草转氨酶、碱性磷酸酶、总胆固醇和低密度脂蛋白胆固醇水平显著升高,胆碱酯酶、甘油三酯和高密度脂蛋白胆固醇水平显著降低,黄芪及其拆分组分不但能明显改善脾虚水湿不化大鼠的一般状况,也可以不同程度的调节血脂和肝脏功能,其中黄芪多糖组调节效果最为明显[3]。李新等[6]对糖尿病模型大鼠血脂综合指标(总胆固醇、三酰甘油、低密度脂蛋白、高密度脂蛋白)分析,发现黄芪黄酮有改善脂质代谢的功能。黄芪多糖对糖尿病时肝脏脂肪变性有治疗作用,黄芪多糖治疗后血脂及肝脂质含量显著降低[7]。
目前,关于黄芪改善脾虚水湿不化大鼠肝脏形态和功能的机制尚不清楚,本研究通过基因芯片检测发现黄芪及其拆分组分可调节PPARα信号通路和亚油酸代谢通路相关基因表达。
过氧化物酶体增殖物激活受体(Peroxisome Proliferator-activated Receptors,PPARs)是一类由配体激活的核转录因子,有3个亚型:PPARα、PPARβ/δ、PPARγ[8]。其中,PPARα在肝脏细胞中高表达,主要参与肝脏脂类物质的分解代谢,具有调节胆汁酸代谢、脂肪酸摄取、活化,并影响细胞内脂肪酸结合及线粒体脂肪酸氧化的作用[9-10]。如图3所示,PPARα信号通路涉及的关键基因包括:fabp4、me1、cyp7a1、olr1、cpt1b、aqp7。fabp4(编码脂肪酸结合蛋白4,fatty acid binding protein 4,adipocyte),细胞内脂质结合蛋白,属于低分子量的细胞质蛋白,其主要功能为参与细胞内脂肪酸的转运和代谢[11]。me1(编码苹果酸酶1,malic enzyme 1,NADP+-dependent,cytosolic),肝脏脂肪酸合成酶,催化NADP+依赖的S-苹果酸转化为丙酮酸。cyp7a1(编码胆固醇7α-羟化酶,cytochrome P450,family 7,subfamily a,polypeptide 1),催化胆固醇合成胆汁酸,是胆汁酸合成代谢途径的限速酶,在维持胆固醇稳态及胆汁酸合成中发挥重要作用[12]。olr1(编码植物凝集素样氧化型低密度脂蛋白受体-1,oxidized low density lipoprotein(lectin-like)receptor 1),属于C型凝集素超家族,可结合、内化和降解氧化型低密度脂蛋白(oxidized low density lipopro tein,Ox-LDL)[13]。cpt1b(编码肉碱棕榈酰基转移酶1b,carnitine palmitoyltransferase 1b,muscle),催化长链脂酰CoA与肉碱合成脂酰肉碱,是细胞线粒体脂肪酸氧化的限速酶,其降低将影响脂肪酸转运进入线粒体的过程,使已进入细胞的脂肪酸及其活化产物脂酰辅酶A难以进行氧化,从而加剧细胞内脂质大量堆积[14]。aqp7(编码水通道蛋白7,aquaporin 7),为水-甘油通道,对水、甘油以及非极性气体CO2和NO等具有通透性[15]。

图3 PPARα信号通路
本研究发现,脾虚水湿不化大鼠肝脏形态和功能异常,血脂紊乱,可能与脂代谢途径PPARα信号通路关键基因fabp4、me1、cyp7a1、olr1、cpt1b、aqp7的异常表达有关。与正常对照组相比,脾虚水湿不化大鼠PPARα信号通路中细胞内脂肪酸转运和代谢基因fabp4下调,脂肪酸合成酶基因me1上调,结合、内化和降解氧化型低密度脂蛋白基因olr1下调,催化胆固醇合成胆汁酸基因cyp7a1上调,脂肪酸氧化限速酶基因cpt1b下调,甘油-水通道蛋白基因aqp7上调,可能引起脂肪合成增加,胆固醇代谢生成胆汁酸增多,低密度脂蛋白代谢降解减少,糖异生增强,脂肪酸氧化供能减少,从而造成能量缺乏。与模型对照组相比,黄芪水煎液组fabp4和olr1升高,cyp7a1降低,黄芪黄酮组aqp7降低,fabp4升高,黄芪多糖组cyp7a1降低,olr1和cpt1b升高,胆固醇代谢生成胆汁酸减少,低密度脂蛋白代谢降解增多,脂质氧化供能增强,从而改善脂质紊乱。
黄芪及其拆分组分也可调节亚油酸代谢通路相关基因表达。磷脂酶A2可催化水解细胞膜甘油磷脂类的sn-2位酯键从而生成脂肪酸和溶血磷脂,包括亚油酸、花生四烯酸等[16]。细胞色素P450家族参与亚油酸等物质的代谢。与模型对照组相比,黄芪水煎液组亚油酸代谢通路基因pla2g4a(编码磷脂酶A2家族IVA)、pla2g2d(编码磷脂酶A2家族IID)、cyp2c12(编码细胞色素P450)和loc687842(编码细胞色素P450)基因升高,黄芪皂苷组pla2g4a、pla2g2d和loc687842升高,黄芪多糖组cyp2c12和loc687842升高,提示黄芪水煎液、黄芪皂苷和黄芪多糖可促进亚油酸代谢。
综上所述,根据中药性味科学内涵假说即“促进机体能量及与能量代谢相关的物质代谢的中药具有热(或温)性”,本研究发现黄芪“性温”可以调节PPARα信号通路和亚油酸代谢通路,从而影响与机体能量代谢相关的脂代谢,各拆分组分中黄芪多糖组分为主要调节物质。
[1]匡海学,程伟.中药性味的可拆分性、可组合性研究——中药性味理论新假说与研究方法的探索[J].世界科学技术-中医药现代化,2009,11(6):768-771.
[2]段凤丽,钱旭武,孔菲.黄芪治疗水肿的应用[J].中医药信息,2011,28(3):51-52.
[3]赵文晓,崔宁,韩冰冰,等.黄芪及拆分组分对脾虚水湿不化模型大鼠的影响[J].山东中医药大学学报,2015,39(3):268-270.
[4]高洁,韩冰冰,韩旭,等.复合造模因素诱导脾虚水湿不化模型大鼠胃肠功能的改变[J].辽宁中医杂志,2014,41(9):1999-2000.
[5]Zhang XG,Zhang H,Tan R,et al.Mechanism of earthquake simulation as a prenatal stressor retarding rat offspring development and chinese medicine correcting the retardation:hormones and gene-expression alteration[J].Evid Based Complement Alternat Med,2012:670362.
[6]李新,范颖.基于多指标正交设计考察黄芪有效部位干预糖尿病模型大鼠的药效机制及其交互关系[J].北京中医药大学学报,2013,36(7):457-461.
[7]毛先晴,欧阳静萍,吴柯,等.黄芪多糖对糖尿病KKAy小鼠肝脏脂肪变性的影响[J].中国糖尿病杂志,2008,16(4):233-236.
[8]Usuda D,Kanda T.Peroxisome proliferator-activated receptors for hypertension[J].World J Cardiol,2014,26(8):744-754.
[9]Burri L,Thoresen GH,Berge RK.The role of PPARα acitivation in liver and muscle[J].PPAR Res,2010:1-11.
[10]Kersten S.Integrated physiology and systems biology of PPARα[J].Mol Metab,2014,3(4):354-371.
[11]胡卫红,乔杰,李蓉,等.多囊卵巢综合征患者血清脂肪型脂肪酸结合蛋白水平与性激素及血脂的相关性研究[J].中华医学杂志,2006,86(45):3186-3189.
[12]邢万佳,高聆,赵家军.胆固醇7-羟化酶CYP7A1表达及调控相关研究进展[J].世界华人消化杂志,2012,20(16):1439-1446.
[13]Li F,Patterson A D,Krausz K W,et al.Metabolomics reveals an essential role for peroxisome proliferator-activated receptor alpha in bile acid homeostasis[J].J Lipid Res,2012,53(8):1625-1635.
[14]Hammond L E,Gallagher P A,Wang S,et al.Mitochondrial glycerol-3-phosphate acyltransferase-deficient mice have reduced weight and liver triacylglycerol content and altered glycerolipid fatty acid composition[J].Mol Cell Biol,2002,22(23):8204-8214.
[15]Wu B,Beitz E.Aquaporins with selectivity for unconventional permeants[J].Cell Mol Life Sci,2007,64(18):2413-2421.
[16]杨钦钦,陈民利.磷脂酶A2在心血管疾病动物实验中的研究进展[J].中国比较医学杂志,2014,24(12):55-61.
(2015-12-09收稿 责任编辑:洪志强)
Mechanism of the effect of Radix Astragali and its separated components on the lipid metabolism of rats with syndrome of dampness retention due to spleen deficiency based on whole liver genome expression
Cui Ning1,Zhao Wenxiao2,Ji Xuming1,Jiang Haiqiang3,Han Bingbing1,Gao Jie1,Han Xu1,Wang Shijun1
(1CollegeofBasicMedicalSciences,ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China; 2CollegeofNursing,ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China; 3CollegeofPharmacy,ShandongUniversityofTraditionalChineseMedicine,Jinan250355,China)
Objective:To explore the molecular mechanism of the effect of Radix Astragali and its separated components on the lipid metabolism of rats with syndrome of dampness retention due to spleen deficiency.Methods:Rats with syndrome of dampness retention due to spleen deficiency were induced by complex factors of high fat and low protein diet,loading swimming for six weeks.And then,Radix Astragali and its separated components were administered to corresponding groups for two weeks,both pathological changes of the liverand gene expression changes related to lipid metabolism regulation were tested by using gene chip.Results:Morphological changes of the larger liver and bubble-like swelling of liver cells were detected in rats with syndrome of dampness retention due to spleen deficiency.Compared with the normal control group,genes of the PPARα pathway including fabp4,olr1 and cpt1b were down-regulated; me1,cyp7a1 and aqp7 were up-regulated in rats with syndrome of dampness retention due to spleen deficiency.Compared with the model control group,the number and degree of bubble-like swelling of liver cells in Radix Astragali and its separated components groups were decreased.Compared with the model control group,cyp7a1 was down-regulated,olr1and fabp4were up-regulated in rats of the decoction liquid of Radix Astragali group;aqp7 was down-regulated and fabp4was up-regulated in rats of Astragali flavone group; cyp7a1 was down-regulated,olr1and cpt1bwere up-regulated in rats of Astragalus polysaccharide group.Compared with the model control group,genes of the Linoleic acid metabolic pathway including pla2 g4a,pla2 g2d,cyp2c12 and loc687842wereup-regulated in rats of the decoction liquid of Radix Astragali group,pla2 g4a,pla2 g2d,cyp2c12 and loc687842 were up-regulated in rats of Astragali saponin group,cyp2c12 and loc687842were also up-regulated in rats of Astragalus polysaccharide group.Conclusion:Radix Astragali and its separated components(including Astragali flavones,Astragali saponin and Astragalus polysaccharide)obviously improved the abnormal morphology of the livers of rats with syndrome of dampness retention due to spleen deficiency,the mechanism of which may be the regulation of key genes of PPARα and Linoleic acid metabolic pathway.The key genes of PPARα pathway were me1,cyp7a1,aqp7,fabp4,olr1 and cpt1b,and the key genes of Linoleic acid metabolic pathway were pla2 g4a,pla2 g2d,cyp2c12 and loc687842.The Astragalus polysaccharide was proved to be the main substance in the regulation of lipid metabolism.
Syndrome of dampness retention due to spleen deficiency; Radix Astragali;Gene chip; Lipid metabolism
国家重点基础研究发展计划(973计划)资助项目(编号:2013CB531803);山东省中医药发展计划项目(编号:2015-006)
崔宁(1978—),河北唐山人,副教授,从事中药药性的基础性研究
王世军,教授,博士研究生导师,研究方向:从事中药药性的基础性研究,电话:(0531)89628077,地址:山东省济南市长清区大学科技园大学路4655号,E-mail:pathology@163.com
R285.5
A
10.3969/j.issn.1673-7202.2015.12.002
