术前皮下埋植式化疗泵动脉介入化疗四肢软组织肉瘤与癌性溃疡的疗效观察
2015-04-25刘铖李鼎锋崔秋郭钧
刘铖 李鼎锋 崔秋 郭钧
皮肤鳞癌和肢体骨与软组织肉瘤,由于疾病进展,肿瘤可直接侵犯至皮肤,在其表面形成溃疡,并常常合并坏死感染引发恶臭,引起患者疼痛和出血,特别是前期已经行手术或者放化疗后复发的患者,这给临床治疗带来较大难度。如何行下一步治疗?笔者尝试用动脉导向化疗的方法,对病灶的营养血管进行灌注化疗,利用药物进入体内的首过效应,造成肿瘤区域持续高浓度,对于控制出血感染及疼痛均有较好的效果,2003 年 7 月至 2011 年 11 月,我科以术前皮下埋植式化疗泵动脉介入化疗治疗四肢软组织肉瘤与癌性溃疡 31 例,现报告如下。
资料与方法
一、一般资料
本组 31 例中男 15 例,女 16 例,年龄 14~83 ( 平均 49 ) 岁。病理类型:皮肤鳞状细胞癌9 例,滑膜肉瘤 6 例,恶性纤维组织细胞瘤 5 例,脂肪肉瘤 3 例,骨肉瘤 3 例,恶性黑色素瘤 2 例,表皮样肉瘤 2 例,皮肤隆突性纤维肉瘤 1 例。发病部位于上肢 10 例,其中手部 3 例、前臂 2 例、腋窝2 例、肩胛部 2 例、锁骨下 1 例;下肢 21 例,其中大腿 7 例、小腿 5 例、足部 4 例、腹股沟 3 例、臀部 2 例。11 例合并淋巴结转移,均未见肺等脏器转移。外院手术放、化疗及其它治疗后复发 22 例,在皮肤鳞状细胞癌的 9 例中有 7 例为放疗后复发。
溃疡灶面积最大者约 30 cm×16 cm×12 cm,最小者约为 1.5 cm×1.5 cm×1.3 cm。破溃疼痛症状中重度疼痛 13 例,中度疼痛 18 例,其中破溃面厌氧菌感染明显且散发腥臭味者 12 例,以破溃出血为主要症状 6 例。
二、化疗方法
经临床及影像学诊断后,埋置动脉灌注化疗装置 ( 化疗泵 ),上肢溃疡行选择性患肢肱动脉逆行插管到锁骨下动脉置管,下肢溃疡行股动脉逆行插管到髂外动脉置管,导管与化疗泵相连,将化疗泵埋入皮下组织。术中经化疗泵常规给予盐酸表柔比星20 mg,埋泵后化疗盐酸表柔比星 90 mg / m2、顺铂120 mg / m2,以上两种药物分 3 天泵入,每次每药持续时间约 3 h,鳞癌加用博莱霉素 15 mg 1 次完成,恶性黑色瘤加用氮烯咪胺 600 mg / m2分 4 天给药。每 1 个周期化疗持续 3~4 天,同时给予水化、保肝、止吐等治疗药物。第 1 个周期完成后 2~3 周重复下 1 个周期化疗,通常 3 个周期后观察疗效。化疗同时在溃疡面用碘伏纱布伤口换药。9 例经过2 个周期化疗,3 个周期化疗以上的 22 例。
三、化疗后治疗
化疗的目的是为下一步治疗打下基础。化疗后观察肿瘤区域在皮肤温度、肿瘤与正常组织在活动度,结合 B 超和 CT 等影像资料,根据肿瘤边界和血液供应情况,决定是否手术或保守治疗:如果局部软组织条件较好,可以切除或转移皮瓣的方法进行保肢,否则行截肢术;不具备手术条件如髋部周围或患者不同意截肢采用保守治疗,主要包括局部放疗和中药外敷。
四、随访方法
化疗期间,每次化疗前通过患者主诉疼痛程度及影像学检查进行评估;术后患者每隔 3 个月至半年进行 1 次复查,包括局部 B 超、淋巴结超声、胸片等。
五、观察指标及评价
疼痛程度观察指标及评价:0 级,无痛;I 级( 轻度 ),轻微疼痛,可以忍受;II 级 ( 中度 ),明显疼痛,影响生活与睡眠,须用镇痛药;III 级 ( 重度 ),剧烈疼痛,难以忍受,严重干扰生活与睡眠,可伴有植物神经功能紊乱表现和 ( 或 ) 被动体位,须用强效镇痛药[1]。止痛疗效评价:完全缓解 ( complete remission,CR ):治疗后完全无痛;部分缓解 ( partial remission,PR ):疼痛较给药前明显减轻,睡眠基本上不受干扰,能正常生活;轻度缓解 ( mild remission,MR ):疼痛较给药前减轻,但仍感明显疼痛,睡眠受干扰;无效 ( no curative effect,NC ):疼痛与治疗前比较无变化或加重。总有效率 ( total remission rate,RR )=( CR+PR )×100 / 总例数 。
参照 WHO 抗肿瘤药物客观疗效判定标准对实体肿瘤行评价疗效[2]:CR 为溃疡面完全愈合,并超过 1 个月,局部溃疡未再次破溃;PR 为:溃疡面缩小至少 50%,超过 1 个月未再次发生破溃;稳定 ( stable disease,SD ) 为局部溃疡缩小不及 50% 或增大未超过 25%;进展 ( progress disease,PD ) 为1 个或多个病灶超过至少 25% 或出现新的病灶。其RR=( CR+PR )×100 / 总例数。
结 果
本组病例随访 10 个月至 9 年 2 个月,平均67 个月。本组疼痛患者治疗前,中度疼痛 18 例,重度疼痛 13 例。本组患者 1 个周期化疗后均可达到疼痛缓解,不用服止痛药,夜间可入睡,疼痛均有缓解,其中 CR 19 例,PR 8 例,MR 4 例,疼痛缓解RR 为 87%。随着化疗次数的增加,止痛效果更明显,3 个周期化疗后仅有 4 例仍有轻度疼痛。
癌性溃疡因为实体瘤已经突破皮肤这次保护屏障,肿瘤局部通常合并感染且伴有恶臭,且因感染及大量渗出液的存在而导致患者抵抗力明显下降。通过介入化疗,肿瘤溃疡经化疗 CR 7 例,PR 15 例,NC 9 例,溃疡愈合 RR 为 71%,典型病例见图 1。肿瘤病理类型中鳞癌及上皮样肉瘤的愈合疗效相对较好 (图 2)。肿瘤溃疡明显散发腥臭味者12 例,治疗后都有渗出减少、腥臭味减低,其中7 例不大的破溃病灶自行愈合。以破溃出血为主要症状 6 例患者,经化疗后出血减少,3~4 次化疗后达到完全止血。合并淋巴结转移的 11 例,化疗后淋巴结转移灶消失 8 例,明显缩小 3 例。
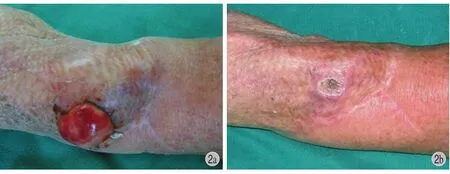
图1 左大腿恶性纤维组织细胞瘤合并溃疡 a:治疗前,溃疡突出体表;b:2 次化疗后,溃疡边界逐渐清晰;c:4 次化疗即术前,肿物边界清晰;d:肿物完整切除,临近肌皮瓣覆盖图2 左前臂上皮样肉瘤 a:介入化疗前;b:介入化疗后Fig.1 Malignant fibrous histiocytoma with ulcer in his left thigh a: before the treatment, ulcer extruded over the surface; b: After two times of chemotherapy,the ulcer boundary was becoming gradually clear; c:after four times of chemotherapy preoperatively, the mass boundary was clear; d: the mass was complete resected, near myocutaneous flap coverage Fig.2 Left forearm epithelioid sarcoma a: before interventional chemotherapy; b: After interventional chemotherapy
化疗泵化疗的副反应除患肢皮肤营养较健侧稍差外,未见其它不良反应;且消化道反应和骨髓抑制及脏器损害等全身毒副反应较传统化疗毒副反应轻。
本组中化疗后肿瘤缩小后,19 例手术 ( 保肢16 例、截肢 3 例 ),其余 12 例溃疡症状缓解后采用保守治疗。保肢的 16 例中 3 例术后局部复发,局部复发率 19%。19 例中术后出现病理轻度化疗反应者 5 例,中度化疗反应者 10 例,重度化疗反应者4 例,肿瘤组织显示不同程度的变性、坏死、纤维化、玻璃样变,有些病例能达到难以见到典型的肿瘤细胞,坏死明显。
讨 论
在骨和软肿瘤治疗中肉瘤及癌性溃疡相对少见,本组 517 例骨和软组织恶性肿瘤中仅 31 例出现溃疡 ( 约 6% )。癌性溃疡的特点为:( 1 ) 溃疡发生在肿块向体表隆起的中心部位,血供丰富癌组织脆,侵及感觉神经导致患者明显疼痛;( 2 ) 癌肿进行性增大时溃疡面增大,肿瘤血管缺乏收缩功能,极易导致血管破裂引起大出血;( 3 ) 癌肿组织溃疡面往往存在厌氧菌的感染,散发出腥臭味;( 4 ) 大部分患者已做过手术及放疗,全身化疗效果不理想而易于产生抗药性。临床上,对于这些患者的治疗非常棘手。
以往对于癌性溃疡治疗的方法有:( 1 ) 利用可外用的化疗药物、抗生素等对肿瘤细胞进行杀伤作用;( 2 ) 能增强 NK 细胞的细胞毒性和直接抗病毒作用的干扰素局部喷洒;( 3 ) 具有解毒散结及消肿止痛作用的中药外用;( 4 ) CO2激光外照射治疗;( 5 ) 通过外科手术进行局部治疗。以上治疗方法都有一定的疗效,但对于癌肿较大,特别是合并有淋巴结转移的病例,采用上述方法单纯局部处理治疗难以奏效,传统化疗疗效不甚理想,且毒副作用较大[3-4]。
近年来,化疗在软组织肉瘤的治疗中发挥了很大作用,术前采用化疗可以缩小外科切除的范围。笔者采用术前皮下埋入式动脉化疗泵灌注化疗,选择患侧肢体的动脉置管,通过化疗泵给药,起到了药物进入体内先到达肿瘤侧肢体的首过效应,药物浓度较健侧肢体高达 4~6 倍,已知化疗药物浓度每提高 1 倍疗效可增加 10 倍,从而有效提高了药物从组织间液到肿瘤细胞内的物理扩散能力,进而提高了对肿瘤组织的杀细胞毒性;由于给药途径的改变,避免了传统化疗的部分药物被肝脏降解去活性化,毒副作用低于同等剂量静脉给药;且由于毒副作用的减低,可以缩短疗程间隔时间;一次埋置化疗泵手术前后可反复多次持续给药,使肿瘤区域的化疗药浓度有一个持续高浓度的平台期,进一步增加了化疗疗效[5-7]。皮下埋入式动脉化疗治疗肉瘤及癌性溃疡时,化疗药物首先流经肿瘤肢体血管,高浓度药物使血管受到刺激收缩,血管内皮肿胀管腔变窄,使得对肿瘤区域的供血减少;而肿瘤灶本身的血管缺乏肌层不能正常收缩,造成化疗药物在肿瘤区域更多的“盗流”,肿瘤组织血管中获得较正常组织更高的药物,对肿瘤组织的有效杀伤,临床上有效解除癌性患者的疼痛,癌肿血供减少肿瘤的出血和感染症状也得到缓解。
本组 31 例中 16 例行保留肢体手术,经至少3 次化疗后手术,术后复发 3 例 ( 19% )。笔者认为复发主要和肿瘤大小和病理类型及肿瘤对化疗的反应如何有关,疗效排序从优到差,依次为鳞癌、上皮样肉瘤、脂肪肉瘤、恶性纤维组织细胞瘤、骨肉瘤和滑膜肉瘤[8]。为提高保肢率减少复发率,还是要从化疗上着手,不拘泥化疗次数的多少,应观察化疗后肿瘤区域的皮肤温度、肿瘤与正常组织的活动度,彩超和 CT 等医学影像资料。笔者认为肿瘤的边界是否清晰及血供是否减少,这是决定手术,还是进一步化疗的关键。
本组将皮下埋植式动脉灌注大剂量顺铂和表阿霉素,并根据肿瘤的病理学特征结合其它药物应用于肉瘤及癌性溃疡的术前辅助治疗,能够有效缓解疼痛和控制肿瘤破溃造成的感染及出血。通过化疗策略术前控制软组织肉瘤为众多学者、特别是欧洲广泛采取的一种治疗策略,待肿瘤缩小浸润边界清晰后手术,降低了再次手术的局部复发率[9-10]。该方法是一种有效地治疗肉瘤及癌性溃疡的方法。目前本组病例数尚少,还需要大宗的临床患者治疗观察随访。
[1] 汪楣, 谷铣之. WHO癌治疗结果报告的标准. 中华肿瘤杂志,1982, 4(4):300.
[2] 孙燕, 周际昌. 临床肿瘤内科手册. 北京: 人民卫生出版社.2003: 106.
[3] 付思祺, 宋建星. 游离皮片移植治疗乳癌慢性巨大溃疡一例.中国美容美学, 2010, 19(7):978-979.
[4] 曾毅, 何汉. 5-氟尿嘧啶联合胰岛素、庆大霉素、r hEGF 换药治疗转移癌性皮肤溃疡效果观察. 临床血液学杂志, 2009,22(12):671-672.
[5] Guo J, Cui Q, Liu C, et al. Clinical report on transarterial neoadjuvant chemotherapy of malignant fibrous histiocytoma in soft tissue. Clin Transl Oncol, 2013, 15(5):370-375.
[6] Liu C, Cui Q, Shu C, et al. Comprehensive treatment based on intra-arterial chemotherapy for distal femur neoplasms. Pathol Oncol Res, 2013, 19(3):489-493.
[7] Cui Q, Li DF, Liu C, et al. Two case-reports of the limb salvage treatment of osteosarcoma consolidated with obvious pathological fractures. Pathol Oncol Res, 2011, 17(4):973-979.
[8] Li D, Cui Q, Liu Y, et al. Chemotherapy response analysis for osteosarcom with intra-arterial chemotherapy by subcutaneous implantable delivery system. Pathol Oncol Res, 2011, 17(4):947-953.
[9] Bhangu A, Broom L, Nepogodiev D, et al. Outcomes of isolated limb perfusion in the treatment of extremity soft tissue sarcoma: a systematic review. Eur J Surg Oncol, 2013, 39(4):311-319.
[10] Kasper B, Ouali M, van Glabbeke M, et al. Prognostic factors in adolescents and young adults (AYA) with high risk soft tissue sarcoma (STS) treated by adjuvant chemotherapy: a study based on pooled European Organisation for Research and Treatment of Cancer (EORTC) clinical trials 62771 and 62931.Eur J Cancer, 2013, 49(2):449-456.
