少花龙葵与芦荟间种对镉胁迫的效应
2015-04-24何彩甄王建煌陈颖芝李文浩付善明
何彩甄,王建煌,裴 婕,陈颖芝,李文浩,付善明
(广州大学环境科学与工程学院,广东广州 510006)
植物间种对自然资源如光能、热量、水分等利用更充分,多种植物组合修复污染土壤是一条行之有效的新途径,是污染土壤利用的新思路[1]。龙葵生物量较大、生态适应性较广,为我国传统的中草药,是广东民间常用的地产药材,其抗肿瘤作用近年来引起国内外学者广泛关注。有研究表明在镉污染浓度较低的(<50 mgCdCl2/kg)沙土,少花龙葵仍较旺盛地生长,对轻度的镉污染有一定的耐性,为新的重金属超富集植物[2-5]。郭智等研究表明镉胁迫下,龙葵幼苗生长受到一定程度的抑制,且具有浓度效应和时间效应[6]。芦荟的应用溯源已久,现被广泛应用于各类饮食、保健、医疗、化妆、环境等领域。据调查,种植芦荟经济效益好。芦荟被认为是新兴的经济作物[7-9]。笔者采用土壤培养方法研究一定浓度镉的土壤中少花龙葵与芦荟间种模式下镉的分布,考察间种模式下对少花龙葵镉的积累影响,研究其中机理,以中草药绿色行标对2种植物在低浓度下的镉土壤的种植进行风险评价,并为南方低浓度镉土壤的利用提供建议。
1 材料与方法
1.1 试验材料 少花龙葵(S.photeinocarpum Nakamura),又名苦凉菜、苦纤纤等。库拉索芦荟(Aloe vera L.)购自芦荟培养基地,每株长约10 cm,5~6片叶。试验土壤为砂质土壤,试验区域为长50 cm、宽40 cm、厚20 cm的土壤层。试验用水为去离子水。
1.2 试验材料的培养 试验所用材料采用腐熟土壤分块法于温度、湿度、阳光可控的温房内培养。试验原土采自广州大学附近的耕地,将原土过80 mm筛后,按比例加入营养土、鸡粪、有机机质、水等腐熟,再用不同浓度的CdNO3浇灌至土壤镉浓度稳定而成,平均划分数个区域。将处理好的少花龙葵子播种在湿润的基质土中,待幼苗长到适当高度(10~15 cm),按预设计方案移栽至制备好的土壤上继续培养。单种少花龙葵18株,单种芦荟18株,芦荟/印度芥菜组的芦荟与印度芥菜各9株,相间而种,以3行、每行6株种植,株距约为7 cm。保持土壤湿度约为40% ~50%,在室内20~30℃温度下生长,记录植物生长情况。植物生长约100 d后收获。
1.3 样品处理与分析 应用常规法对试验材料长势观察。称量叶片鲜重后,在70~80℃条件下烘干至恒重,干燥冷却后称量干重。将根部泥土消除干净,并用去离子水清洗叶片、茎和根,晾干。植物叶子样品置于105℃的烘箱中烘15 min以终止样品中酶的活动,再降低烘箱的温度,维持在70~80℃,直到烘至恒重。用研钵磨碎,称取样品1.0 g,用盐酸、氢氟酸、硝酸混合液进行消解5~6 h,保持温度,至白烟冒尽,溶液澄清透明,用去离子水定容至25 ml比色管。以1∶9的比例用稀硝酸稀释,待测。同时作试剂空白。测定仪器为ICP-MS质谱仪,对待测样品进行镉元素含量的测定。土壤基本理化性质的测定方法按土壤农化常规分析法测定[10],采用Microsoft Excel 2007统计分析软件对试验数据进行统计处理和分析。
1.4 试验设计 该试验设有3个试验组,在此把间种的少花龙葵和芦荟表示为LK(间)和LH(间),把单种的少花龙葵和芦荟表示为LK(单)和LH(单)。土壤镉含量的预估值与实际值如表1所示。

表1 土壤镉含量
2 结果与分析
2.1 植物性状 该试验中,在加入镉2 d后,少花龙葵叶片出现失绿症状,B、C试验组逐渐出现新叶黄化、黄斑、蜷曲甚至枯落;生长5 d后,新枝开始蔫化,生长缓慢。Cd对少花龙葵生长的抑制较明显,其原因可能是镉是以溶液形式加入的,上层土壤镉的含量比实际加入量高。生长期的少花龙葵对镉的抵抗能力不强,因此抑制了少花龙葵的生长。加入镉13 d后失绿症状有所减缓,新的叶子开始长出来,之前出现黄斑的叶子开始复绿;30 d后,各组少花龙葵生长正常,差异逐渐明显,对Cd的抵抗开始有所表现。芦荟对镉的加入,生长形状基本没变化。
由表2和图1可见,少花龙葵的平均株高在70~80 cm。镉胁迫对其株高影响不大,但对鲜重有影响。该试验中随着镉处理浓度增加,少花龙葵的株高总体呈上升趋势,镉处理浓度为7.05 mg/kg时,平均株高最大;镉处理浓度0.08~0.60 mg/kg时,间种模式少花龙葵的平均株高大于单种模式约7 cm。这可能温房方位及朝向影响里面的阳光分布,植物因获得有区别的光照,也可能因为两植物间种具有一定种间影响而呈现株高的差异。单种时少花龙葵的平均鲜重随着镉处理浓度的增加而增加,间种时则相反。在C试验组,单种高于间种17.18 g。芦荟总体的株高与平均鲜重变化不大,平均株高均在20~25 cm。在镉处理浓度0.08~0.60 mg/kg时,芦荟的平均鲜重单种比间种高,间种时随着镉处理浓度的增加而增加。
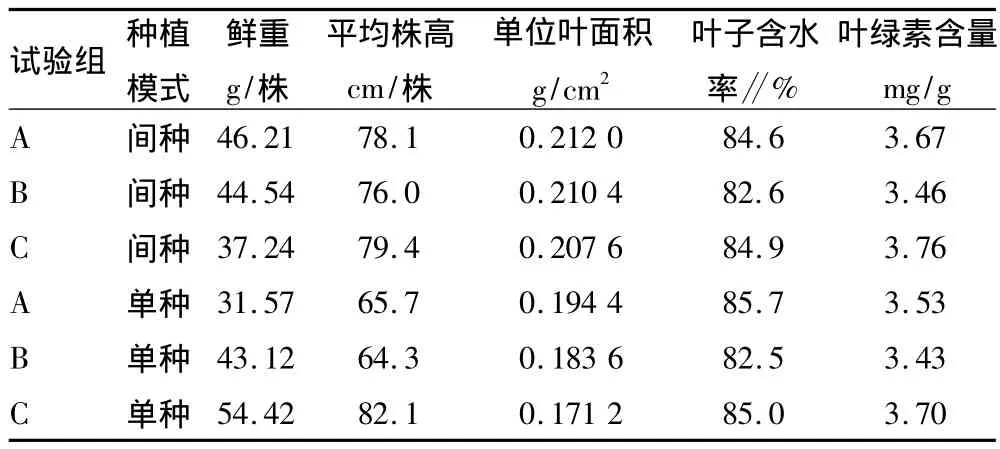
表2 少花龙葵的生长性状
少花龙葵的单位叶面积随着镉处理浓度的增加有所降低,且单种高于间种,在B试验组,间种和单种的平均叶子鲜重均达最大值;2种种植方式下,少花龙葵的叶绿素a、叶绿素b与叶绿素总量在不同镉处理浓度的试验组中差异并不明显,仅间种的叶绿素总量略高于单种。
2.2 土壤理化性质 土壤的有机质百分含量在6.40%~8.00%(图2)。C试验组相对其他两组较高。焦文涛等研究表明土壤有机质含量与Cd2+的吸附量大小有关系[11]。各组植物根际土的pH总体分布在5.60~6.02。有关土壤对镉的吸附解吸行为及其影响因素的研究报告,认为pH和有机质是主要的影响因素。pH主要通过影响土壤表面电荷性质和镉离子的存在形态而影响镉离子的吸附;有机质则主要是通过改变土壤表面负电荷数量以及与镉离子发生不同的化学反应而起作用[12-18]。土壤体系的pH升高,其中的粘土矿物、水合氧化物和有机质表面的负电荷增加,对镉离子的吸附力增强,同时Cd2+在氧化物表面的专性吸附、土壤有机质-金属络合物的稳定性随pH升高而增强。有研究表明,土壤的镉质量分数很大时,土壤pH对水溶态镉影响极小,水溶态镉土壤受总镉量控制,对此有文献[17,19]称之为容量控制相。高pH和高含量的土壤有机质可以有效抑制Cd2+的解吸[11],即更有利于Cd2+被土壤吸附,不容易转移至植物体内。该试验结果与以上提及有关结论[11-19]相符合。该试验中,植物叶子镉浓度高的土壤pH集中在5.75~5.90,土壤有机质百分比含量较高,大于7.31%。该试验植物的根际土理化性质差异并不是特别明显,对植物吸收镉有一定影响。
2.3 植物鲜叶镉浓度 由表3和图3可知,在A组,2种种植模式下的植物叶子镉浓度均低。少花龙葵的叶子隔浓度均呈上升趋势,在C组时均达到最高浓度且间种高于单种,间种1.70 mg/kg、单种1.28 mg/kg,但在B组中单种是间种的1.8倍。
B组中少花龙葵的根际土镉浓度间种比单种高1倍,但叶子镉浓度低于单种45%,此时芦荟的叶子镉浓度间种是单种2.21倍。由此可知间种促使芦荟吸收了一定量镉,而少花龙葵减少了对镉的吸收。C组中少花龙葵的根际土镉浓度间种比单种低55.2%,叶子镉浓度高于单种32.3%。这可能与土壤中活化的镉有关。有研究指出,植物吸收土壤中重金属受重金属的溶剂度、迁移能力以及重金属从植物根系向地上部转运的效率控制,活化的重金属更容易被吸收[20]。镉处理浓度较高时,可能是少花龙葵受胁迫而通过吸收镉至体内来降低根附近的镉浓度。
与前人研究结果一致,芦荟中重金属的积累随土壤中重金属含量增加而增加,主要在叶部积累[21]。以A组至C组来看,间种的芦荟从0.19 mg/kg缓慢增加至0.31 mg/kg;B组间种的芦荟比单种高,而B组至C组,叶子镉浓度从0.12 mg/kg增至0.74 mg/kg,增加幅度相对间种较大(表3)。
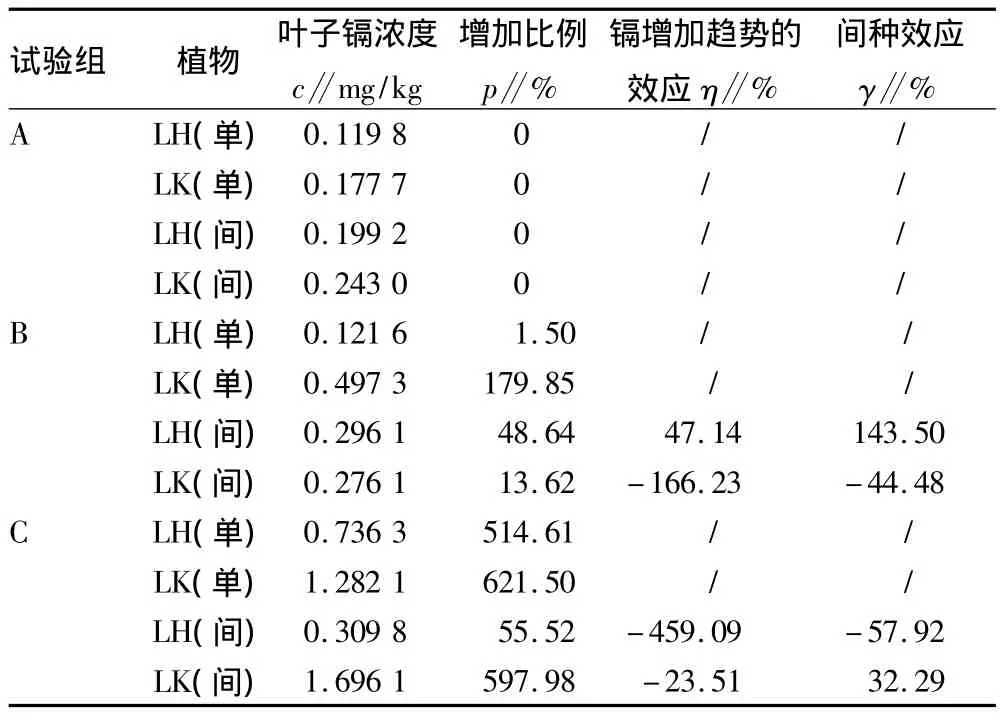
表3 叶子的镉
以A组至B组来看,镉处理浓度增加约60%,少花龙葵的镉增加趋势效应间种比单种弱166.23%,芦荟则增强47.14%;以B组至C组来看,处理浓度增加约11倍,少花龙葵的镉增加趋势效应间种比单种弱23.51%,同时芦荟减弱459.09%(表3)。间种使两植物的镉增加趋势效应减弱,相比单种,一定程度抑制对镉的吸收。
2.4 鲜叶镉浓度与根际土镉浓度的相关性 由图4可知,单种的植物鲜叶镉浓度与根际土镉浓度相关性较高,随镉处理浓度增加,叶子镉浓度明显递增,说明土壤镉含量是影响植株叶片镉含量的重要因素,土壤镉含量高则增加了镉向植株叶片的运输;间种则没有。说明2种植物间种,互相影响各植物对镉的吸收。蒋成爱等研究指出很可能与植物根系分泌物对土壤中重金属植物有效态浓度的影响有关[22]。
2.5 少花龙葵的吸收系数 考虑到芦荟与少花龙葵的叶子药用价值广泛,这里主要关注2种植物的叶子。叶子吸收系数表示对镉的吸收,叶子吸收系数=叶子镉浓度/根际土镉浓度。由图5可见,A组中,少花龙葵叶子的镉浓度低,因其与镉处理浓度相当,两者在0.02~0.24 mg/kg,所得的叶子吸收系数较高(间种是3.59、单种是5.18);B组,单种的少花龙葵叶子镉浓度和叶子吸收系数比间种高,间种的少花龙葵叶子镉浓度低且叶子吸收系数低。这很大可能与芦荟间种影响两植物根系分泌物有关[22]。在C组中,土壤镉处理浓度高于植物叶子镉浓度甚多,所得的叶子吸收系数较低(间种是0.82、单种是0.40)。
2.6 植物单项污染指数评价 该研究参照《HJ/T 166-2004.土壤环境监测技术规范》[23],以单项污染指数为评价模式,分别应用《中国土壤元素背景值》[24]、《GB 15618 -1995,土壤环境质量标准》[25]中标准值对该试验的土壤重金属镉进行评价。结果表明,A试验组的土壤镉元素浓度均达到一级标准,B试验组的土壤镉元素浓度达三级标准,C试验组的土壤镉元素浓度属于重度污染(根据内梅罗综合污染指数的分级标准)。
少花龙葵药用价值高,其叶子主要是药用保健。对植物叶子重金属质量状况,采用单项污染指数法,以《药用植物及制剂进出口绿色行业标准(WM2-2001)》[26](简称“绿色行标”)中的标准值为评价标准进行评价。单项污染指数法计算公式为Pi=ci/Si,式中,Pi为中草药中某污染物污染指数;ci为中草药中该污染物含量测定值;Si为限量标准值,其中查得Cd标准值为0.30 mg/kg。
由表4可见,在A、B试验组,只有单种的少花龙葵镉元素超标,其余均达标,表明少花龙葵与芦荟间种一定程度上降低少花龙葵最具药用价值的叶子的镉浓度;C试验组,无论间种或单种,植物均超标。从该试验得出,选取少花龙葵与芦荟间种于镉土壤,土壤镉处理浓度<0.60 mg/kg时叶子符合绿色行标,虽然芦荟吸收镉的量增大,但在标准范围内。土壤镉处理浓度更高,少花龙葵风险相对于芦荟更高,芦荟处于更有利的位置。在实际应用中,较低浓度的镉污染土壤,可以将重金属低累积中草药与超富集植物、富集植物种植在一起,达到修复土壤的同时收获符合一定卫生标准的中草药的目的,但选择植物时应慎重,也有互相促进吸收镉的情况,植物间的交互作用机理还不清楚,这方面需要进一步研究。
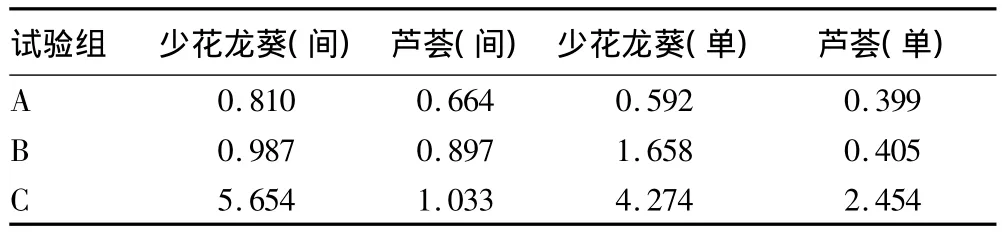
表4 Cd单项污染指数
植物根系和地上部形态结构的互补作用能提高植物对土壤养分、水和光等资源的有效利用[27-29]。植物间种对自然资源如光能、热量、水分等利用更充分,多种植物组合修复污染土壤是一条行之有效的新途径,是污染土壤利用的新思路[1]。Wu等利用重金属超富集植物与低累积作物玉米套种,发现超富集植物提取重金属的效率比单种超富集植物明显提高,同时玉米能够生产出符合卫生标准的食品或动物饲料或生物能源[30]。该试验选取少花龙葵与芦荟间种,考虑到2种植物的特点(少华龙葵根深、芦荟根浅),配合一起种植,结果表明,少花龙葵在镉浓度较低时主要表现一定的耐性,镉浓度高时则趋向富集镉,镉处理浓度为0.60 mg/kg的单种少花龙葵超出我国中草药行业标准;间种具有可观的效果,一定程度减低2种植物对镉胁迫效应,增强其耐性,随镉处理浓度增加少花龙葵叶子的镉浓度增长速度减慢。
3 结论
(1)少花龙葵在生长期对镉胁迫有明显的敏感反应,主要表现在叶子衰弱,但对其株高、叶绿素含量影响不大。在高镉含量的C试验组,平均鲜重单种高于间种。
(2)土壤镉浓度为0.60 mg/kg时少花龙葵与芦荟间种有一定效果,少花龙葵叶子镉浓度明显比单种低,虽间种的芦荟比单种高,但两者叶子符合绿色行标。此间种模式运用于低浓度镉土壤,既能收获两者药用价值,也能发挥芦荟的经济效益。
(3)土壤镉浓度>0.60 mg/kg时,两者间种使植物镉增加趋势减弱,少花龙葵趋向富集镉,风险相对于芦荟更高,芦荟处于更有利的位置。
(4)选取合适的植物间种是一条不需要间断土地使用、较经济合理的处理方法。高pH和高有机质含量使Cd2+不容易转移至植物。
[1]卫泽斌,郭晓方,丘锦荣,等.间套作体系在污染土壤修复中的应用研究进展[J].农业环境科学学报,2010,29(S1):267 -272.
[2]张春燕,曹彦雄,李亮春,等.龙葵生长对镉污染的响应[J].河西学院学报,2007,23(5):45 -47.
[3]魏树和,周启星,王新,等.一种新发现的镉超积累植物龙葵[J].科学通报,2006,27(4):765 -769.
[4]周飞.少花龙葵竟是吸镉大户[J].广东科技报,2011(6):1.
[5]施和平,曾宝强,王云灵,等.镉及其与钙组合对褐脉少花龙葵毛状根生长、抗氧化酶活性和吸收镉的影响[J].生物工程报,2010,26(2):147-158.
[6]郭智,王涛,奥岩松.镉对龙葵幼苗生长和生理指标的影响[J].农业环境科学学报,2009,28(4):755 -760.
[7]谢绍明.绿药用植物之宝 芦荟开发前景广阔[J].中药研究与信息,1999,1(2):6 -9.
[8]杨喜贵.依托资源优势做大做强元谋芦荟产业[J].云南农业,2013(11):49-50.
[9]谢绍明.推广芦荟 造福民生[J].科技日报,2012-01-02(001).
[10]陈苏,孙丽娜,晁雷,等.不同含量组合的镉、铅在不同污染负荷土壤中的吸附-解吸动力学行为[J].应用基础与工程科学学报,2007,15(1):32-44.
[11]焦文涛,蒋新,余贵芬,等.土壤有机质对镉在土壤中吸-解吸行为的影响[J].环境化学,2005,24(5):545 -549.
[12]陈怀满.土壤-植物系统中的重金属污染[M].北京:科学出版社,1996.
[13]宗良纲,徐晓炎.土壤中镉的吸附解吸研究进展[J].生态环境,2003,12(3):331-335.
[14]徐明岗,李菊梅,张青.pH对黄棕壤重金属解吸特征的影响[J].生态环境,2004,13(3):312 -315.
[15]费宇红,曹树堂,张光辉,等.镉在土壤中吸附与沉淀的特征与界限[J].地球学报,1998,19(4):409 -414.
[16]倪吾钟,龙新宪,杨肖娥.菜园土壤镉吸附2解吸特性的研究[J].广东微量元素科学,2000,7(10):11 -14.
[17]GRAY C W,MCLAREN R G,ROBERTS A H C,et al.Solubility,Sorption and Desorption of Native and Added Cadmium in Relation to Properties of Soils in New Zealand[J].European Journal of Soil Science,1999,50:127-137.
[18]NAIDU R,KOOKANA R S,SUMNER M E,et al.Cadmium Sorption and Transport in Variable Charge Soil:A Review[J].J.Environ Qual,1997,26:602-617.
[19]王海燕,吴晓芙,胡曰利.土壤镉活度模型与控制相研究[J].中南林学院学报,2000,20(6):1 -6.
[20]AN Y J.Assessment of comparative toxicities of lead and copper using plant assay[J].Chemosphere,2006,62(8):1359 -1365.
[21]王畅,张涛,仇荣亮,等.芦荟对土壤中重金属的吸收及EDTA影响[J].环境科学与技术,2012,35(3):94 -97.
[22]蒋成爱,吴启堂,吴顺辉,等.东南景天与不同植物混作对土壤重金属吸收的影响[J].中国环境科学,2009,29(9):985 -990.
[23]国家环境保护总局.HJ/T 166-2004.土壤环境监测技术规范[S/OL].(2004-12-09)http://www.doc88.com/p-787448980370.html.
[24]中国环境监测总站.中国土壤元素背景值[M].北京:中国环境科学出版社,1990.
[25]国家环境保护局南京环境科学研究所.GB 15618-1995,土壤环境质量标准[S].北京:中国标准出版社,2006.
[26]关立忠,陈建民,张宝旭,等.WM2-2001.药用植物及制剂进出口绿色行业标准[S].2001.
[27]廖红,严小龙.高级植物营养学[M].北京:科学出版社,2003:24-26.
[28]AGEGNEHU G,GHIZAW A,SINEBO W.Yield performance and land -use efficiency of barley and fababean mixed cropping in Ethiopian highlands[J].Europ.J.Agronomy,2006,25:202 -207.
[29]DAELLENBACH G C,KERRIDGE P C,WOLFE M S,et al.Plant productivity in cassava-based mixed cropping systems in Colombian hillside farms[J].Agriculture,Ecosystems and Environment,2005,105:595 -614.
[30]WU Q T,SAMAKE M,MO C H,et al.Simultaneous sludge stabilization and metal removal by metal hyper - accumulator plants[C]//Transactions of 17th World Congress of Soil Science.Bangkok,2002:355-1-9.
