儿茶酚异喹啉类物质Salsolinol(Sal)对α-Syn纤维化程度的影响
2015-04-23段晋燕刘可夫庆宏邓玉林
段晋燕,刘可夫,庆宏,邓玉林
(1. 中国人民解放军总医院临床检验科,北京 100853;2. 北京理工大学生命学院,北京 100081)
帕金森病(Parkinson Disease,PD)重要的两个病理特征是多巴胺能神经元的特异性损伤以及路易小体的形成[1,2]。α突触核蛋白(α-syulcein,α-Syn)是路易小体的重要组成成分,在正常状态下不具备高级结构,即以无规则状态存在[3],但在路易小体中,该蛋白以纤维化形式存在[4~6]。体外研究显示,α-Syn 纤维化聚集过程分为三步:寡聚体、原纤维以及成熟纤维。分别收集这三种状态的α-Syn 进行毒性研究,发现寡聚体和原纤维状态的毒性远大于成熟纤维[7,8]。研究发现多巴胺(Dopamine,DA)能与α-Syn 形成共价或非共价的复合物,抑制延长纤维化形成的时间,即稳定蛋白在寡聚体或者原纤维状态[9]。儿茶酚异喹啉类物质Salsolinol(Sal)是DA 与乙醛缩合产物,是PD 致病因子外源性神经毒素MPTP 的结构类似物[10~13]。本研究通过建立α-Syn体外聚集的模型,并利用ThT 荧光检测、荧光共聚焦显微镜和透射电镜等方法对Sal对α-Syn 纤维化的影响程度进行探讨,探索α-Syn 蛋白和Sal之间的关系以及两者的PD致病机理。
1 材料和方法
1.1 材料与试剂
本研究所用α-synuclein(α-syn)为本实验纯化所得。Salsolinol(Sal)、Dopamine(DA)和硫磺素(Thioflavin T,Th T)购自Sigma公司。
1.2 主要设备
恒温振荡培养箱为智诚ZHWY-2102恒温振荡仪;激光共聚焦显微镜为Leica TCS-SPS;扫描电镜为FEI Quanta 200。
1.3 实验方法
1.3.1α-Syn分别与Sal、DA共孵育
将14μM的α-Syn分别与14μM Sal、14μM DA、200μM Sal和200μM DA混合后,置于恒温振荡培养箱中,转速200rpm,于37℃下孵育6天。将14μM的α-Syn分别与14μM、100μM和1000μM的Sal混合后,利用相同方法,孵育6天。
1.3.2ThT检测α-Syn的纤维化程度
每24小时收集α-Syn蛋白与Sal共孵育的样品100μL,加入终浓度为100 μM 的Th T 染液,混匀后,加入至石英比色皿中,使用荧光分光光度计检测蛋白吸光度,激发波长为450nm,发射波长为482nm。对照组为相同条件下单独孵育的α-Syn样品。
1.3.3激光共聚焦显微镜观察α-Syn纤维化程度
取孵育6天的α-Syn蛋白与Sal共孵育样品3μL 置于载玻片上,室温风干后,利用5μL 1%Th T 染液浸染样本5 min ,之后使用75%的乙醇洗去剩余染料,再次室温风干后,使用激光共聚焦显微镜观察样本形态,激发光波长为488nm。对照组为单独孵育6天的α-Syn蛋白样品。
1.3.4扫描电镜观察α-Syn纤维化
取孵育6天的α-Syn蛋白与Sal共孵育样品3μL滴于铜网上,静置1min,用滤纸吸取剩余蛋白样品。取3μL 醋酸铀负染样本30s后,迅速用滤纸吸干剩余溶液。置于TEM 镜下观察,加速电压120kV。对照组为单独孵育6天的α-Syn蛋白样品。
1.3.5统计学方法
数据采用SPSS19.0进行处理。各组间比较采用方差分析,P < 0.05表示为有统计学差异。
2 结果
2.1 α-Syn与Sal共孵育后,ThT荧光强度降低
当Sal的浓度为14μM时,对α-Syn蛋白的纤维化程度具有一定的影响;当浓度上升至200 μM后,Sal与DA对α-Syn纤维化程度的影响具有相同的趋势,即对α-Syn纤维化进程起到了显著地抑制作用(P<0.01)(见图1)。

图1Sal和DA对α-Syn纤维化程度影响的对比Figure.1ThT analysis for the aggregation of α-Syn in DA and Sal
由图2可见,随着Sal 溶液浓度不断增加,对α-Syn纤维化程度的抑制作用逐渐增强,当Sal溶液的浓度约为蛋白浓度100倍时,α-Syn形成成熟纤维的能力基本消失(P<0.01)。

图 2ThT法检测不同浓度Sal对α-Syn维化进程的影响Figure.2ThT analysis for the aggregation of α-Syn in Sal
2.2 与Sal共孵育,α-Syn 蛋白淀粉样物质产生减少
经过6 天孵育对照组蛋白形成了大量的淀粉样物质(见图3A);与Sal共孵育组,α-Syn 蛋白淀粉样物质有所减少(见图3B)。这一结果与荧光分光光度计的检测结果相一致。

图 3激光共聚焦显微镜观察α-Syn成纤维化情况A:单独孵育6天的α-Syn蛋白;B:与1000μM Sal共同孵育6 天的α-Syn蛋白样品Figure.3Laser Scanning Confocal Microscope images of α-Syn fi bril morphology
2.3 与Sal共孵育,α-Syn 蛋白纤维化程度降低
扫描电镜结果显示(见图4)Sal抑制了 α-Syn的纤维化程度。α-Syn蛋白单独孵育时,出现了大量典型的相互缠绕的纤维状物质。当与Sal共孵育后纤维长度变短、数量变少,且出现了大量的圆环状或管状的寡聚蛋白和原纤维。
3 结论
DA通过与α-Syn的C末端125YEMPS129区形成共价或非共价复合物,使蛋白更容易向寡聚体或者原纤维状态发展,从而抑制蛋白纤维化[14,15]。本文利用Sal与α-Syn共孵育的方法,研究了Sal在α-Syn纤维化进程中所起作用。Sal是DA与乙醛的缩合产物,通过对比Sal和DA对α-Syn纤维化程度的抑制作用可以看出,Sal对α-Syn纤维化程度的抑制趋势与DA相同。
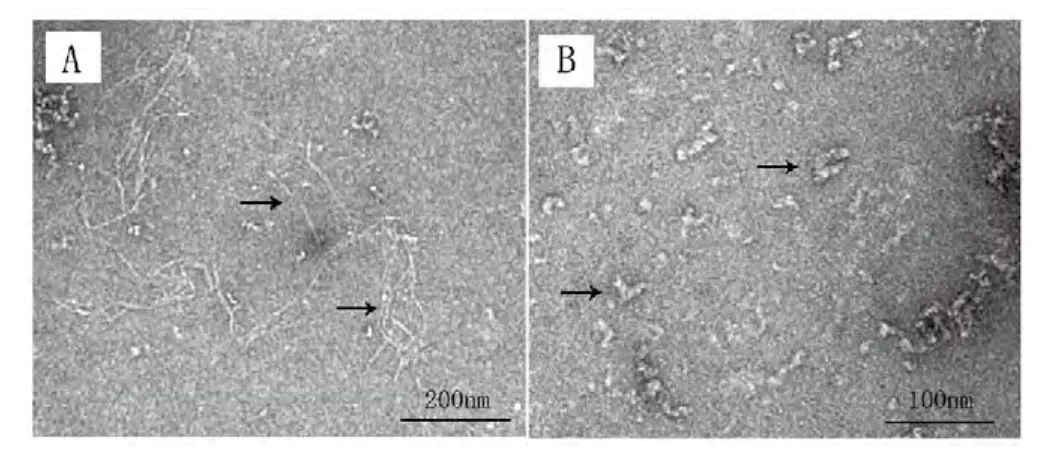
图 4扫描电镜观察α-Syn成纤维化情况A:单独孵育6天的α-Syn蛋白;B:与1000μM Sal共同孵育6 天的α-Syn蛋白样品Figure.4Scanning Electron Microscope images of α-Syn fi bril morphology
ThT是一种能特异性与蛋白β-片层结构组成的纤维结合,而不与简单的β-片层结构结合的荧光染料,常用于检测AD病人斑块中形成的β淀粉样物质及其相应纤维化产物。本实验将α-syn 蛋白与不同浓度的Sal 孵育并用ThT荧光染色发现,Sal具有抑制Syn纤维化的作用。同时,为考察Sal浓度与其抑制α-Syn蛋白纤维化程度作用的关系,实验中使用了不同浓度的Sal溶液分别于α-Syn蛋白共孵育。结果显示随着Sal浓度升高,与其共孵育蛋白的荧光强度增长越缓慢,甚至出现零增长情况,说明Sal抑制α-Syn纤维化的作用是具有浓度依赖性。
研究显示,α-Syn蛋白在寡聚体或者原纤维状态时,细胞毒性最大。本实验对高浓度Sal与α-Syn蛋白孵育产物形态进行了分析。通过激光共聚焦显微镜观察蛋白形态,可以看出与Sal共同孵育后,α-Syn聚集程度与单独孵育的蛋白相比显著减低,且淀粉样化不明显。进一步利用透射电镜观察对比两种聚集体的结构发现,单独孵育的蛋白成长纤维状,而且相互缠绕。与Sal共同孵育后,纤维程度大幅度下降,甚至形成圆轮状寡聚蛋白。由此证明Sal能够抑制α-Syn蛋白形成成熟纤维化的进程,使其长时间停留在寡聚体状态或者原纤维状态,从而使α-Syn保持高神经毒性状态的时间延长。
作为人体代谢最活跃的器官,大脑的氧代谢量高,由此产生大量的自由基。代谢产物超过自身氧自由基系统清除能力,即会引起脂质过氧化等一系列氧化应激反应,生成活性醛。当脑中多巴胺能神经元受到氧化损伤时,产生的活性醛即与DA反应生成以Sal为代表的生成儿茶酚异喹啉类物质。本研究结果为Sal和α-Syn的PD致病性提供了实验基础,也为解释PD病人多巴胺能神经元的特异性损伤以及路易小体的形成提供了一定的实验依据。
[1] Lotharius J, Brundin P. Pathogenesis of Parkinson's disease:dopamine, vesicles and alpha-synuclein [J]. Nature reviews Neuroscience, 2002, 3(12): 932-942.
[2] Goldberg M S, Lansbury P T. Is there a cause-and-effect relationship between alpha-synuclein fi brillization and Parkinson's disease? [J].Nature cell biology, 2000, 2(7): E115-119.
[3] Uversky V N. A protein-chameleon: conformational plasticity of alpha-synuclein, a disordered protein involved in neurodegenerative disorders [J]. Journal of biomolecular structure & dynamics, 2003,21(2): 211-234.
[4] Volles M J, Lansbury P T. Relationships between the sequence of alpha-synuclein and its membrane af fi nity, fi brillization propensity,and yeast toxicity [J]. Journal of molecular biology, 2007, 366(5):1510-1522.
[5] Ulusoy Y A, Di M D A. alpha-Synuclein Elevation in Human Neurodegenerative Diseases: Experimental, Pathogenetic, and Therapeutic Implications [J]. Molecular neurobiology, 2013, 47(2):484-494.
[6] Sivanesam K, Andersen N. Modulating the Amyloidogenesis of alpha-Synuclein [J]. Current neuropharmacology, 2015 [Epub ahead of print].
[7] Uversky V N, Fink A L. Conformational constraints for amyloid fibrillation: the importance of being unfolded[J]. Biochimica et biophysica acta, 2004, 1698(2): 131-153.
[8] Xin W, Emadi S, Williams S,et al.Toxic Oligomeric Alpha-Synuclein Variants Present in Human Parkinson's Disease Brains Are Differentially Generated in Mammalian Cell Models [J].Biomolecules, 2015, 5(3): 1634-1651.
[9] Conway K A, Rochet J C, Bieganski R M,et al.Kinetic stabilization of the alpha-synuclein protofibril by a dopamine-alpha-synuclein adduct [J]. Science, 2001, 294(5545): 1346-1349.
[10] Naoi M, Matsuura S, Parvez H,et al.Oxidation of N-methyl-1,2,3,4-tetrahydroisoquinoline into the N-methyl-isoquinolinium ion by monoamine oxidase [J]. Journal of neurochemistry, 1989, 52(2):653-655.
[11] Shukla A, Mohapatra T M, Agrawal A K,et al.Salsolinol induced apoptotic changes in neural stem cells: Amelioration by neurotrophin support [J]. Neurotoxicology, 2013, 35, 50-61.
[12] Kang J H. Salsolinol, a catechol neurotoxin, induces oxidative modi fi cation of cytochrome c [J]. BMB reports, 2013, 46(2): 119-123.
[13] Wang F, Ni J, Wang X,et al.Salsolinol Damaged Neuroblastoma SH-SY5Y Cells Induce Proliferation of Human Monocyte THP-1 Cells Through the mTOR Pathway in a Co-culture System [J].Neurochemical research, 2015, 40(5): 932-941.
[14] Mazzulli J R, Mishizen A J, Giasson B I,et al.Cytosolic catechols inhibit alpha-synuclein aggregation and facilitate the formation of intracellular soluble oligomeric intermediates [J]. The Journal of neuroscience : the of fi cial journal of the Society for Neuroscience,2006, 26(39): 10068-10078.
[15] Reeg S, Grune T. Protein Oxidation in Aging: Does It Play a Role in Aging Progression? [J]. Antioxidants & redox signaling, 2015,23(3): 239-255.
