miR-137抑制人类黑色素瘤细胞体外增殖的机制研究
2015-04-23郝帅秦玉吕娜尹胜何大澄王成涛
郝帅,秦玉,吕娜,尹胜,何大澄,王成涛
(1. 北京工商大学食品学院,北京 100048;2. 北京师范大学生命科学学院,北京 100875)
目前,肿瘤仍然是严重威胁人类健康的一类疾病,皮肤黑色素瘤则是其中之一。恶性黑色素瘤是由皮肤或其他器官黑色素细胞产生的肿瘤[1]。它虽然发病率低,但其恶性度高,转移发生早,对放疗化疗均不敏感,死亡率极高,因此对黑色素瘤早期诊断和治疗很重要[2]。近年来人们对黑色素瘤的发病原因有了一定的了解,最广为人知的发病诱因是紫外线照射,但是其诱发机制还研究的不彻底,而且在人体的手掌,脚掌等不会经常受到太阳光照射的部位也有患黑色素瘤的风险,因此对黑色素瘤的发病机理还有待进一步探究[3]。有统计数据表明,白种人患黑色素瘤的风险要大大高于黄种人,而黑人几乎天然地抵抗了黑色素瘤的发生。近年来,恶性黑色素瘤在全球的发病率都呈现上升趋势,从1973到2001年美国白种人黑色素瘤的发病死亡率占到了皮肤癌的75%[4],由于上述提到的人种不同的原因,我国黑色素瘤发病率相对较低。即便如此,有效地预防和治疗黑色素瘤仍然是人类面临的严峻问题之一。
microRNAs(miRNAs)是一类大约由22个碱基组成的高保守调控型的内源性RNA,在动植物中参与基因转录后的表达调控,通过靶向结合到生物体mRNA的3’非翻译区(3’-UTR)上引起mRNA降解或是抑制蛋白质的翻译[5]。目前,研究者们已经发现在包括黑色素瘤在内的大部分肿瘤中都存在着miRNA的异常表达,并且对肿瘤细胞起到不同程度的调控作用[6]。Gaur等人通过高通量技术从一系列人源肿瘤细胞中筛选得到了15种不同于其他实体肿瘤的黑色素瘤miRNA[7];Mueller等通过miRNA芯片筛选出了49个在黑色素瘤中上调,14个下调的miRNAs[8]。有研究表明E2F1和E2F5是黑色素瘤中miR-205的直接靶体,过表达miR-205能够削弱细胞中AKT的磷酸化效应,从而抑制黑色素瘤细胞的体内外增殖[9];miR-18b能够抑制原癌基因mdm2的表达,活化p53从而引发黑色素瘤细胞的凋亡,发挥其抑癌作用[10];miR34a能够通过抑制CDK6而抑制黑色素瘤的体外生长和体内成瘤能力[11]。
miR-137也是一种重要的肿瘤抑制因子,已经有文献报道发现c-Met,YB1,MITF等均为miR-137的直接靶基因,并且miR-137能够通过抑制这些蛋白的表达而降低黑色素瘤细胞的体外增殖与迁移能力[12]。在前期的研究中我们发现,PAK2(p21-activated kinase 2)也是miR-137在黑色素瘤细胞中一个靶体,它能够参与调控miR-137介导的抑制黑色素瘤细胞Ma-Mel-86b的体外增殖过程[13],但其中的调控机制还并不明确。本研究则针对miR-137调控PAK2而抑制黑色素瘤细胞的体外增殖机制做了进一步的探索,研究发现Erk1/2信号通路可能在这个过程中起到了重要的调控作用。
1 材料与方法
1.1 材料
人类黑色素瘤细胞Ma-Mel-86b(德国癌症研究中心Prof. Stefan Eichmüller教授惠赠),抗p-Erk信号通路抗体与抗PAK2抗体(Cell signaling Technology),抗β-actin抗体(北京中杉金桥生物技术有限公司),miR-137 mimics与Neg. mimics(Dharmacon),U0126(Cell signaling Technology),pcDNA3.1与pcDNA3.1-PAK2(本室保存),DMSO(北京精细化工厂),PAK2 siRNA与Neg. siRNA(上海吉玛制药技术有限公司),无血清1640(Gibco),DharmaFECT转染试剂(Dharmacon),RNase-free PBS(Sigma),lipofectamine 2000转染试剂(invitrogen)。
1.2 miRNA,siRNA的转染与U0126抑制剂的添加
将细胞前一天传代后均匀接种至60 mm皿中,37℃,5% CO2培养,接种的细胞密度尽量使第二天能够到达70%左右。转染前按照说明书要求将所有转染物溶解成20 μM的储存液。使用终浓度25 nM进行miR-137与Neg. mimic的转染,使用终浓度100 nM进行PAK2 siRNA与Neg. siRNA的转染,转染过程按照Dharmacon试剂说明书进行。转染适当时间后收取细胞进行后续实验。U0126按照说明书要求稀释至工作液浓度,避光-20℃保存。在细胞转染前2 hr直接滴加入培养的细胞表面。
1.3 蛋白质组学检测与分析
将miR-137与Neg. mimic分别转染Ma-Mel-86b细胞,正常培养48hr后提取细胞全蛋白,进行双向电泳。一向等点聚焦条件:30 V 1 hr,100 V 1 hr,200 V 1 hr,500 V 1 hr,1000 V 1 hr,8000 V梯度聚焦30min,8000 V到55000 Vhr;二向通过12%的SDS-PAGE进行分离。利用ImageMaster软件分析电泳结果,并将差异倍数超过2倍的定义为差异蛋白点,随后将筛选得到的差异蛋白点进行胶内酶解和质谱鉴定,最后利用IPA(Ingenuity Pathway Analysis)通路分析软件对受到miR-137调控的差异蛋白进行生物信息学网络分析。
1.4 pcDNA3.1与pcDNA3.1-PAK2的转染
将细胞前一天接种至50%左右的密度,转染前按照说明书将pcDNA3.1或pcDNA3.1-PAK2质粒与lipofectamine 2000按照一定浓度混合,静置20 min后,均匀滴加至细胞表面,轻柔晃动后再正常培养。
1.5 MTT法测定细胞生长曲线
提前一天将细胞在35 mm直径皿中进行转染处理,37℃,5% CO2过夜培养;24hr后胰酶消化细胞,利用血球计数板计数以每孔5000个/100 μl的细胞量种入96孔板中正常培养,4-6 hr后在第一组细胞加入10 μl MTT,4 hr后每孔加入100 μl SDS-HCl裂解液,第二天测量OD570(630nm参考波长)作为第0天测量值。然后剩下细胞每孔补加100 μl新鲜培养基;以后每天按同一标准加入10 μl MTT,4 hr后加100 μl SDS裂解液,12-16 hr后测量OD值,连续测定5-6天,记录实验数据;统计细胞生长情况,以横坐标为时间,纵坐标为OD值,绘制细胞生长曲线。
1.6 蛋白免疫印迹
在SDS-PAGE胶上上入等量蛋白与预染的marker,电泳条件:80 V恒压,待蛋白进入分离胶后换120 V恒压,直至溴酚蓝跑至胶底部约1 cm处停止电泳,将蛋白转至PVDF膜上,条件为:350 mA恒电流转膜1.5-2 hr, 4℃条件下进行。转膜结束后放入用TBS配置的5%的脱脂奶粉中室温封闭1-2 hr;一抗孵育,4℃过夜,第二天孵育二抗,37℃ 50 min,利用化学发光法暗室曝光,获得蛋白表达信号。
2 结果
2.1 生物信息学分析miR-137在黑色素瘤细胞中调控PAK2可能参与的信号通路
在前期的研究中,我们对miR-137转染Ma-Mel-86b黑色素瘤细胞进行了蛋白质组学分析,筛选并鉴定到了一系列受到miR-137调控的变动蛋白,同时确定了PAK2为miR-137的一个直接调控靶体[13]。我们随后对这些蛋白进行了IPA分析,结果显示,将PAK2作为分析节点,miR-137能够通过调控PAK2而直接或间接地参与多条信号通路:TNF肿瘤坏死因子信号通路,IL-6介导的炎症因子信号通路,p38 MAPK以及ERK介导的有丝分裂原活化的蛋白激酶信号通路等等(图1)。
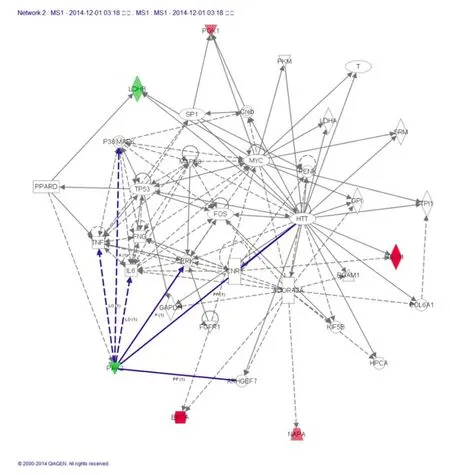
图1IPA分析miR-137在黑色素瘤细胞中调控PAK2可能参与的信号通路。
2.2 miR-137通过降低PAK2的表达抑制Ma-Mel-86b细胞中Erk1/2信号通路的活性
有丝分裂原激活的蛋白激酶信号通路(MAPK-Erk1/2)是参与调控肿瘤细胞生理活动的重要途径,在促进肿瘤生长,迁移,浸润等过程中都起到了重要的作用(图2A)。我们随后在Ma-Mel-86b细胞对Erk1/2通路的活性进行了检测(图2B)。结果显示,过表达miR-137与沉默PAK2后显著抑制了Erk1/2以及其上下游各关键蛋白的磷酸化水平,表明Erk1/2通路的活性被抑制。除此之外,在野生型Ma-Mel-86b细胞中过表达PAK2后,c-Raf,MEK1/2,Erk1/2,p90RSK以及MSK1的磷酸化水平有一定程度的上调,表明PAK2能够增加Erk1/2通路的活性,其中p-Erk1/2上调水平微弱,可能的原因是野生型细胞中活化的Erk1/2表达量相对较高,过表达PAK2使得其表达量饱和而没有出现明显增高。另外,我们在过表达miR-137后回补表达PAK2蛋白,发现Erk1/2通路蛋白的磷酸化水平出现显著回调,说明被miR-137抑制的Erk1/2通路活性能够被PAK2明显逆转,此结果进一步说明了PAK2蛋白确实参与并激活了MAPK-Erk1/2信号通路。miR-137能够通过靶向抑制PAK2的表达而降低黑色素瘤细胞MAPK-Erk1/2通路的活性,这可能是使细胞增殖程度发生改变的一个重要调控机制。
2.3 miR-137通过调控PAK2降低Erk1/2信号通路的活性而抑
制Ma-Mel-86b细胞的体外增殖能力
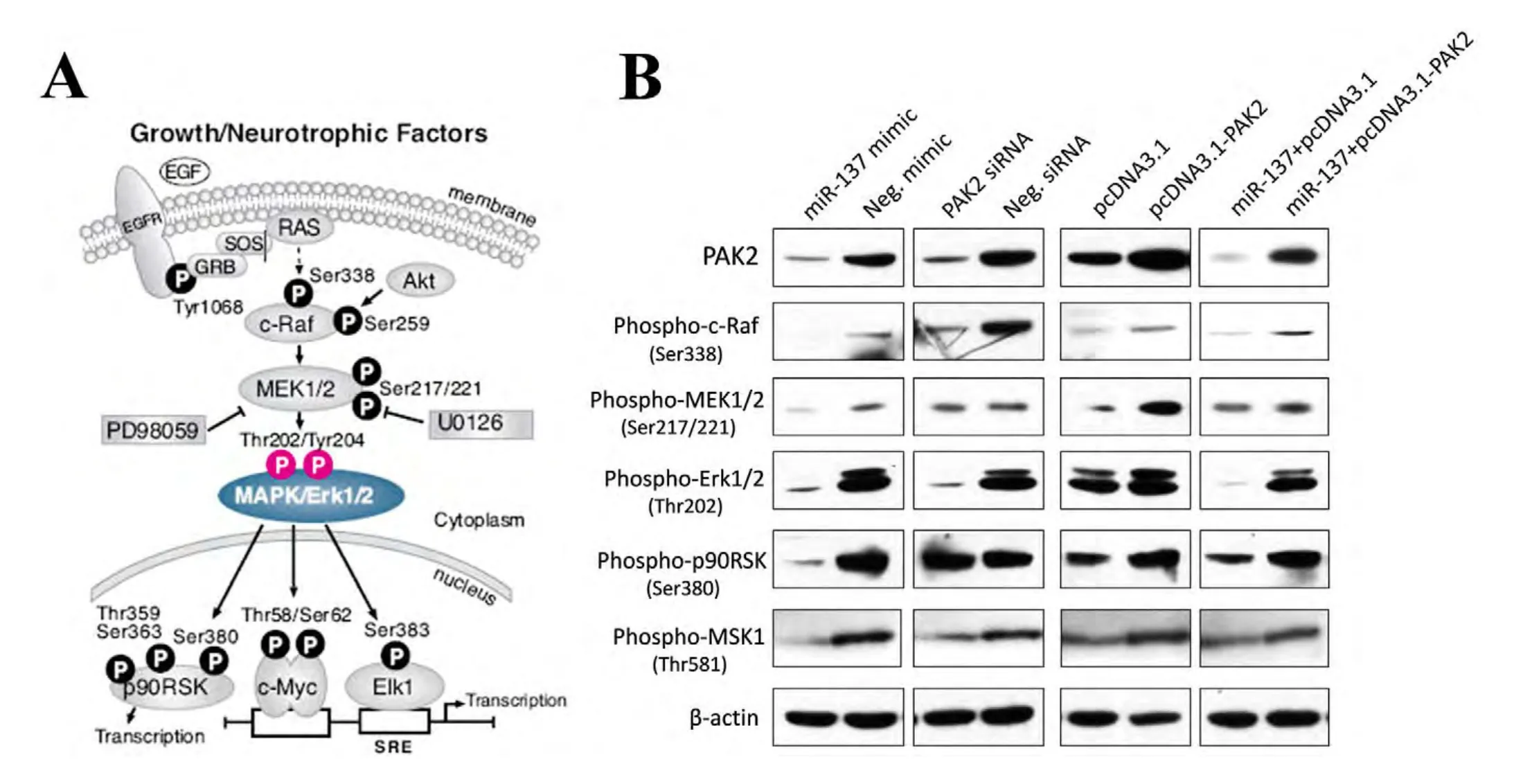
图2miR-137通过降低PAK2的表达抑制Ma-Mel-86b细胞中Erk1/2信号通路的活性。(A)Erk1/2信号通路示意图;(B)miR-137过表达,沉默PAK2,pcDNA3.1-PAK2过表达以及在miR-137转染后回补PAK2蛋白后检测Ma-Mel-86b细胞中MAPK-Erk1/2信号通路的活性。
为了进一步研究Erk1/2信号通路活性的改变是否参与调控了miR-137介导的抑制黑色素瘤细胞Ma-Mel-86b的体外增殖过程,我们首先利用Erk1/2信号通路特异性抑制剂U0126处理Ma-Mel-86b细胞,对通路的活性进行了检测(图3A)。结果显示,与对照组(DMSO处理)相比,U0126显著抑制了MEK1/2,Erk1/2,以及下游蛋白p90RSK与MSK1的磷酸化水平,但PAK2蛋白表达水平没有发生明显改变,这表明PAK2位于Erk1/2信号通路的上游。我们随之对U0126处理后的细胞进行了增殖能力检测(图3B),结果显示,U0126同样显著降低了Ma-Mel-86b的体外增殖能力,表明Erk1/2信号通路活性的改变对黑色素瘤细胞的体外增殖能力确实有影响。我们随后在U0126处理后的Ma-Mel-86b细胞中回补表达PAK2蛋白(图3C)。结果显示,回补PAK2后,Erk1/2及通路各蛋白的磷酸化水平均出现了显著回调,表明PAK2能够逆转U0126对Erk1/2通路的抑制作用。回补PAK2后的细胞增殖能力结果表明(图3D),较抑制剂组相比,回补PAK2后Ma-Mel-86b细胞的体外增殖能力发生了显著回调。
综合以上结果,我们发现PAK2蛋白位于Erk1/2信号通路的上游,并且miR-137能够靶向调控PAK2而抑制黑色素瘤细胞Erk1/2信号通路的活性,进而抑制细胞的体外增殖能力,本研究为临床治疗黑色素瘤提供了潜在的信息与新思路。
3 讨论
近年来发现miRNA对细胞的生理代谢过程起到了至关重要的调控作用。蛋白质是生命活动最终的体现者,一切生命活动是靠蛋白质来表现出来的;同时,蛋白质的正确表现反应了正常生命活动的体现,这表明对蛋白质合成的调控过程也尤为重要。除了已经被我们熟知的生长因子,转录因子等等以外,miRNA对细胞活动的调控研究越来越被人们重视。与mRNA不同,miRNA并不在细胞内进行编码蛋白质的合成,而使起到了对mRNA翻译蛋白过程的调控作用。miRNA在细胞内一般的调控方式是结合特异性靶向mRNA的3’UTR,通过降低其稳定性或直接抑制其翻译而达到降低蛋白的表达,属于一种转录后调控作用方式。细胞内成千上万种miRNA能够共同形成复杂的调控网络而引发信号通路的激活或抑制。
在前期的研究中我们已经发现PAK2是miR-137在黑色素瘤细胞中的一个直接调控靶体[13]。目前关于PAK2在黑色素瘤中的功能研究主要是针对细胞浸润与转化作用两个方面。有研究表明PAK2在能有作为CDC42的效应分子,在调控黑色素瘤细胞的浸润过程中起重要作用[14]。同时, PAK2能够将c-Jun第5位的苏氨酸磷酸化而促进细胞的转化[15]。PAK2的沉默可以抑制表皮生长因子EGF介导的细胞转化作用,降低细胞的增值能力和克隆形成率。在本研究中,我们发现PAK2对黑色素瘤细胞的体外增殖能力上也起到了重要的调控作用,而这个过程是可以通过miR-137来介导的。由于PAK2本身可以作为一种“癌蛋白”分子而存在,因此本研究能够为设计靶向治疗黑色素瘤的临床方法提供有力的信息。

图3miR-137通过调控PAK2降低Erk1/2信号通路的活性而抑制Ma-Mel-86b细胞的体外增殖能力。A,U0126处理后对Erk1/2信号通路的活性检测;B,U0126处理后检测细胞的体外增殖能力;C,U0126处理后回补PAK2蛋白对Erk1/2信号通路活性的检测;D,U0126处理后回补PAK2蛋白检测细胞的体外增殖能力,**, p<0.01。
包括黑色素瘤在内的人类多种肿瘤细胞中均存在MAPK信号通路的异常调节,超过90%的黑色素瘤细胞中均发现有Erk的持续性激活现象。有文献报道MAPK信号通路的激活能够上调cyclinD1的表达,同时降低细胞周期抑制蛋白p27的表达,从而刺激黑色素瘤细胞的增殖和生长;同时也能够通过调控一系列凋亡相关蛋白诸如BIM,BAD,BCL-2,caspase-9和MCL-1来调控黑色素瘤的存活于凋亡[16,17];除此之外,MAPK与Rho/Rock/LIMK/Cofilin通路相互通讯还能够间接调控黑色素瘤细胞的迁移和浸润[18,19]。已有多个研究表明MAPK信号通路的激活是黑色素瘤细胞进入新的血管系统、渗透内皮血管进入组织、在新的组织环境中进行生长和增殖的必要条件[20,21]。因此,MAPK信号通路的激活对于黑色素瘤的生长,增殖,转移具有很重要的正调控作用。有趣的是,本研究发现PAK2蛋白可能作为一种重要的上游调控因子调控MAPKErk1/2通路的活性,进而调控黑色素瘤细胞Ma-Mel-86b的生长,这为人们研究黑色素瘤的调控机制提供了新的信息。同时,PAK2又能够作为miR-137的直接调控靶体,因而能够为临床开发治疗黑色素瘤的联合药物提供了新的思路。
本研究通过生物信息学搜寻,初步确定PAK2蛋白在黑色素瘤细胞中的调控位置,并且进一步以体外增殖为模型,发现miR-137能够通过降低PAK2的表达而抑制黑色素瘤细胞中Erk1/2信号通路的活性,进而抑制肿瘤的体外生长,为临床治疗黑色素瘤提供了有力的资料。
[1] Flaherty K T. Targeting metastatic melanoma. Annu Rev Med, 2012,63: 171-183.
[2] Davar D, Kirkwood J M. New therapies in the treatment of melanoma. Expert OpinInvestig Drugs, 2012, 21: 1643-1659.
[3] Curtin J A, Fridlyand J, Kageshita T,et al.Distinct sets of genetic alterations in melanoma. N Engl J Med, 2005, 353: 2135-2147.
[4] Tsai T, Vu C, Henson D E. Cutaneous, ocular and visceral melanoma in African Americans and Caucasians. Melanoma Res, 2005, 15:213-217.
[5] Bartel D P. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell, 2005, 116: 281-297.
[6] Stahlhut E C E, Slack F J. The role of microRNAs in cancer. Yale J Biol Med, 2006, 79: 131-140.
[7] Gaur A, Jewell D A, Liang Y,et al.Characterization of microRNA expression levels and their biological correlates in human cancer cell lines. Cancer Res, 2007, 67: 2456-2468.
[8] Mueller D W, Rehli M, Bosserhoff A K. miRNA expression pro fi ling in melanocytes and melanoma cell lines reveals miRNAs associated with formation and progression of malignant melanoma. J Invest Dermatol, 2009, 129: 1740-1751.
[9] Dar A A, Majid S, De S D,et al.miRNA-205 suppresses melanoma cell proliferation and induces senescence via regulation of E2F1 protein. J BiolChem,2011, 286: 16606-16614.
[10] Dar A A, Majid S, Rittsteuer C,et al.The role of miR-18b in MDM2-p53 pathway signaling and melanoma progression. J Natl Cancer Inst, 2013, 105: 433-442.
[11] Greenberg E, Hershkovitz L, Itzhaki O,et al.Regulation of cancer aggressive features in melanoma cells by microRNAs. PLoS, 2011,6: e18936.
[12] Luo C, Tetteh P W, Merz P R,et al.miR-137 inhibits the invasion of melanoma cells through downregulation of multiple oncogenic target genes. J Invest Dermatol, 2013, 133: 768-775.
[13] Hao S, Luo C, Abukiwan A,et al.miR-137 inhibits proliferation of melanoma cells by targeting PAK2.ExpDermatol, 2015 (published online).
[14] Gadea G, SanzM V, Self A,et al.DOCK10-mediated Cdc42 activation is necessary for amoeboid invasion of melanoma cells.CurrBiol, 2008, 18: 1456-1465.
[15] Li T, Zhang J, Zhu F,et al.P21-activated protein kinase (PAK2)-mediated c-Jun phosphorylation at 5 threonine sites promotes cell transformation. Carcinogenesis, 2011, 32: 659-666.
[16] Gollob J A, Wilhelm S, Carter C,et al.Role of Raf kinase in cancer: therapeutic potential of targeting the Raf/MEK/ERK signal transduction pathway. SeminOncol, 2006, 33: 392-406.
[17] Russo A E, Torrisi E, Bevelacqua Y,et al.Melanoma: molecular pathogenesis and emerging target therapies (Review). Int J Oncol,2009, 34: 1481-1489.
[18] Klein R M, Aplin A E. Rnd3 regulation of the actin cytoskeleton promotes melanoma migration and invasive outgrowth in three dimensions. Cancer Res, 2009, 69: 2224-2233.
[19] Klein R M, Spofford L S, Abel E V,et al.B-RAF regulation of Rnd3 participates in actin cytoskeletal and focal adhesion organization.MolBiol Cell, 2008, 19: 498-508.
[20] Shevde L A, Welch D R. Metastasis suppressor pathways--an evolving paradigm. Cancer Lett, 2003, 198: 1-20.
[21] Smalley K S. A pivotal role for ERK in the oncogenic behaviour of malignant melanoma? Int J Cancer, 2003, 104: 527-532.
