手性高效液相色谱法测定左卡尼汀片中右旋卡尼汀的含量
2015-04-23谷春秀程梦威刘露于亚萌张童鲍尹聪
谷春秀,程梦威,刘露,于亚萌,张童,鲍尹聪
(北京联合大学生物化学工程学院,北京100023)
引言
左卡尼汀作为一种有效的活性氧物质清除剂,可加快缺血缺氧组织堆积的脂酰辅酶A进入线粒体内,在缓解氧化应激、减少脂质过氧化、释放腺嘌呤核苷酸转位酶、促进脂类代谢、抗细胞凋亡等过程中作用明显[1~5]。左卡尼汀(L-carnitine, LCA),又称左旋肉碱。肉碱分子中含有1个手性碳原子(见图1),形成左旋(L-)、右旋(D-)肉碱对映异构体。右旋肉碱对肉碱乙酰转移酶(CAT)和肉碱脂肪酰转移酶(PTC)有竞争性抑制作用,在生化过程中产生毒副作用[6,7]。左卡尼汀片中杂质右旋卡尼汀的存在明显影响药品质量的安全有效。药品中右旋卡尼汀含量超标容易产生胃肠道反应,造成患者恶心和呕吐、甚至过敏反应,大剂量的情况下对人和动物有害[6]。美国FDA于1993年就禁止出售D-型和DL-型肉碱[7]。国内外目前对左卡尼汀片中右旋卡尼汀测定的研究报导较少。分离卡尼汀对映体时须用手性拆分技术,酶解[8]、手性衍生化[9~11]、手性固定相[11]法常被用于左右旋肉碱拆分。国外尚未有左旋肉碱对映体拆分后含量检测的研究报道。美国药典25版及药典论坛和其他文献资料对左卡尼汀中手性杂质控制方法有少量的报道[12],也曾提供过方法和检测限度,都是衍生后用HPLC分析,但是过程复杂,重复性较差,根据《手性药物质量控制研究指导原则》、美国药典25版及其论坛(pharmacopeial forum)左卡尼汀专论部分规定控制了左卡尼汀原料右旋体的限度,限度为1.0%。国内在此方面的研究仍是空白。左卡尼汀片杂质右旋卡尼汀含量的测定方法研究,为市售左卡尼汀中杂质限量、质量控制提供技术支持,促进此类制药生产的良性运作。
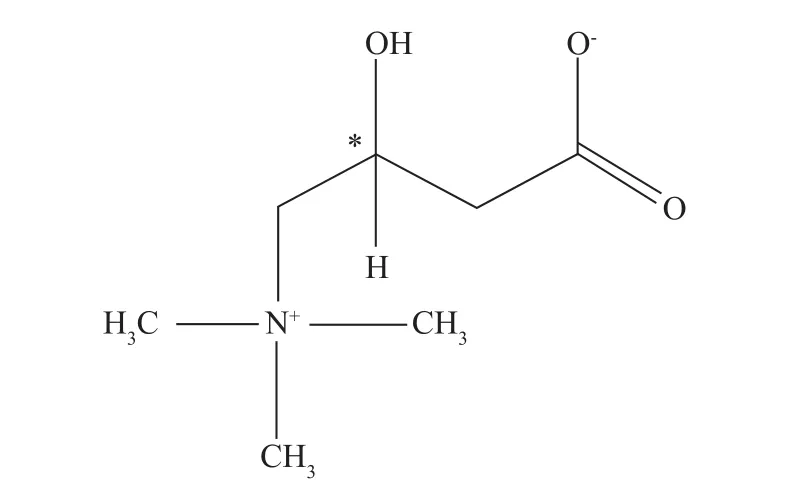
图1肉碱的结构式
1 实验部分
1.1 实验仪器
岛津2010HT高效液相色谱仪(日本岛津公司); 2140型电子分析天平(上海奥豪斯公司)Mettler AB135 -S十万分之一电子天平(瑞士Mettler公司)。
1.2 实验材料
左卡尼汀片(批号:120901, 120902, 120903)北京嘉事大恒制药有限公司;对照品DL-肉碱(批号:20111201纯度为98.69%)武汉福鑫化工有限公司;乙腈为色谱纯(J.T.Baker公司);高氯酸钠为分析纯(天津科密欧化学试剂有限公司);高氯酸为分析纯(天津政成化学制品有限公司);α-溴代苯乙酮(MW=199.04)为化学纯(批号:T20110602)(国药集团化学试剂有限公司);无水乙醇、乙酸乙酯为分析纯(国药集团化学试剂有限公司);氢氧化钾、无水冰醋酸为分析纯(北京化工厂);醋酐为分析纯(天津多利精细化工有限公司);水为纯化水。
1.3 溶液制备
1.3.1样品衍生化制备供试液
取一定浓度的左卡尼汀33%的乙醇溶液10mL置100ml圆底烧瓶中,摇匀后,向其中滴加一滴酚酞指示液,加入一滴1mol/L的KOH溶液,使之紫红色不退,加入а-溴代苯乙酮(MW=199.04)26.0mg,摇匀后,加热回流,使圆底烧瓶中液体保持微沸,从冷凝管流出液体开始计时,加热回流30min,回流过程中不时振摇溶液,冷却至室温后,向圆底烧瓶中加入50ml乙酸乙酯,混合摇匀,转入分液漏斗中,摇匀静置后,取下层水相作为备用溶液,精密移取此备用液1.0ml,置5ml容量瓶中,加入水稀释至刻度,即得供试液。
1.3.2空白衍生溶液
精密移取33%的乙醇溶液10ml置100ml圆底烧瓶中,按样品衍生化过程衍生后,得下层水相备用液,精密移取此备用液1.0 ml,置5ml量瓶中,加入水稀释至刻度,即得供试液衍生溶液。
1.3.3空白辅料衍生溶液
精密称取处方量的辅料约2.2g,置100ml量瓶中,加33%的乙醇溶液稀释至刻度,摇匀,精密移取离心后的上述溶液的上清液2.0mL置25ml量瓶中,加33%的乙醇溶液稀释至刻度,摇匀,按样品衍生化过程衍生后,得到下层水相备用液,精密移取此备用液1.0ml,置5ml量瓶中,加入水稀释至刻度,即得空白辅料衍生溶液。
1.3.4左卡尼汀片(L-carnitine tablets)供试溶液
取左卡尼汀片20片(批号:120901)精密称定,研细,精密称取药物粉末适量(约相当于左卡尼汀2.5g),置100ml量瓶中,加33%的乙醇溶液稀释至刻度后按1.3.2方法处理后加入水稀释至刻度,即得左卡尼汀片供试衍生溶液。
1.3.5右卡尼汀(D-carnitine)对照衍生溶液
精密称定DL-肉碱标准品约100mg(相当于D-carnitine对照品50mg),置25ml量瓶中,加33%的乙醇溶液稀释至刻度,摇匀,精密移取上述溶液5.0ml,置100ml量瓶中,加33%的乙醇溶液稀释至刻度,摇匀,精密移取上述溶液5.0mL置25ml量瓶中,加33%的乙醇溶液稀释至刻度,摇匀,即得对照品溶液。按样品衍生化过程衍生后,得到下层水相备用溶液,精密移取此备用溶液1.0ml,置5ml量瓶中,加入水稀释至刻度,即得右卡尼汀(D-carnitine)对照衍生溶液。
1.4 色谱条件
色谱柱为phenomenex LUX Cellulose-1(250×4.6mm,5μm);流动相A为乙腈;流动相B为0.5mol/L高氯酸钠溶液(0.1M高氯酸溶液调节PH值3.8);梯度洗脱见表1;柱温为28℃;检测波长235 nm;流速为0.4mL·min-1,进样量为10μl。

表1梯度洗脱程序
1.5 测定方法
1.5.1专属性实验
精密移取离心后的左卡尼汀片(L-carnitinetablets)供试溶液上清液2.0ml和右卡尼汀(D-carnitine)对照溶液5.0ml,各置25ml量瓶中,加33%的乙醇溶液稀释至刻度,得到左卡尼汀(L-carnitine)供试液和D-carnitine对照供试液。进行衍生过程试验,即得左卡尼汀供试衍生溶液和D-carnitine对照衍生溶液,同法制备空白溶剂衍生溶液和空白辅料衍生溶液。按色谱条件进行分析。记录色谱图。
1.5.2系统适用性
精密移取右旋卡尼汀(D-carnitine)对照溶液衍生后的溶液,分别进样6次,记录色谱图,以6次的峰面积计算RSD%值。
1.5.3样品测定右卡尼汀参照高效液相色谱法(附录V D)测定(1)色谱条件与系统适用性试验
用纤维素-三(3,5-二甲基苯基氨基甲酸酯)硅胶键合相手性色谱柱(Phenomene Lux 5u Cellulose-1色谱柱),以0.5mol/l高氯酸钠溶液(用高氯酸调节PH3.8)为流动相A,乙腈为流动相B,按表1进行梯度洗脱,流速为0.4ml·min-1,检测波长为235nm,柱温28℃。精密量取供试衍生溶液和对照衍生溶液各10.0μL注入液相色谱仪中,记录色谱图,若供试衍生溶液中有右旋卡尼汀衍生物峰,按外标法以峰面积计算。
(2)测定方法
左卡尼汀供试品溶液见1.3.4,D-carnitine对照品溶液见1.3.5。精密移取供试品溶液和对照品溶液分别10ml,各置100ml圆底烧瓶中,摇匀后,各滴加一滴酚酞指示液按1.3.2得对照品、供试品衍生溶液。照上述条件同法测定,按外标法以峰面积计算。
1.6 方法学考察
1.6.1线性与范围
分别精密移取专属性实验项下的D-carnitine 对照品衍生备用溶液0.10ml、0.20ml、0.40ml、0.80ml、1.00ml、1.20ml各置5ml量瓶中,加水稀释至刻度,摇匀,即得线性测定1~6号溶液,各精密移取上述线性测定1~6号溶液各10.0μl,按色谱条件进样,记录色谱图。
1.6.2重复性
右卡尼汀对照品衍生溶液同1.3.5,供试品衍生溶液同1.3.4,平行制备6份供试样品衍生溶液。分别取上述对照品衍生溶液和供试品衍生溶液各10μl注入液相色谱仪,记录色谱图。
1.6.3溶液稳定性
在室温条件下将供试品衍生溶液同1.3.4放置于0、2、6、10、12小时分别进样10μl,记录色谱图。
1.6.4回收率
各平行制备三份低、中、高浓度加标供试样品衍生溶液(n=9)。取右卡尼汀(D-carnitine)对照品衍生溶液及低、中、高浓度加标供试样品衍生溶液各10μl注入液相色谱仪,记录色谱图。
1.6.5耐用性
按照个人所得税法有关规定,农民进城务工劳务所得、经营所得、工资所得等,收入达到个税起征要求也需要缴纳个人所得税,如月工资、薪金超过5000元需缴纳个税,劳务报酬每次超过800元需缴纳个税等。但是进城务工人员工作相对不易,与城镇居民纳税人又承担相等的纳税义务,税负较重,进城后生活状况改善有限,整体公平性并未实现。
精密移取对照品衍生溶液见1.3.5、供试品衍生溶液见1.3.4各10μl注入色谱仪中,记录色谱图。
2 结果与与讨论
2.1 专属性实验
专属性实验结果见表2汇总表。记录色谱图见图2。
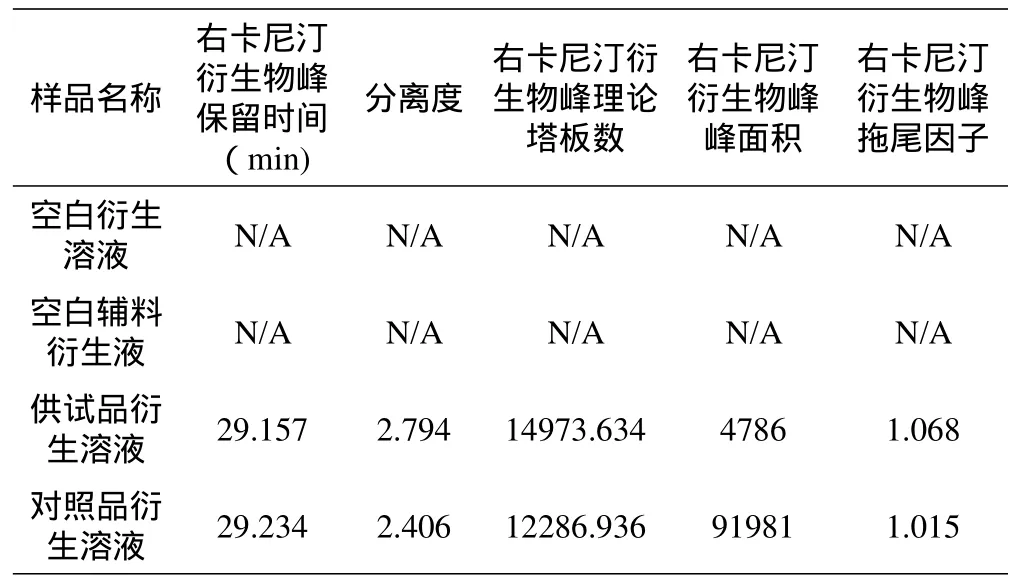
表2专属性实验结果汇总表
*N/A表示不适用,图谱中未出现该右卡尼汀衍生物色谱峰
专属性试验图谱如下:

图2专属性试验谱图图中阿拉伯数字1表示为空白衍生溶液色谱图2表示为空白辅料衍生溶液色谱图3表示为供试品衍生溶液色谱图4表示为对照品衍生溶液色谱图
空白辅料、空白溶剂不干扰供试品中右卡尼汀衍生物峰的测定,对照品及供试品中右卡尼汀衍生物峰峰形良好,理论塔板数大于5000,右卡尼汀衍生物峰与左卡尼汀衍生物峰分离度大于1.5,因此表明本方法专属性好。
2.2 系统适用性
以6次的峰面积计算RSD%,结果见表3。
右卡尼汀衍生物峰与左卡尼汀衍生物峰峰形良好,两峰分离度大于1.5,右卡尼汀衍生物峰理论塔板数大于5000,峰面积及峰保留时间RSD%(n=6)均小于2.0%,表明本方法系统适用性较好。
2.3 方法学考察
2.3.1线性与范围

表3系统适用性实验结果汇总

表4线性与范围试验结果汇总表

图3线性范围关系图
由以上试验可知,右卡尼汀在浓度1.978μg/ml~23.741μg/ml范围内线性关系良好,回归方程为A=4652C+282.70,相关系数r=1,完全满足左卡尼汀片中右卡尼汀手性杂质的检查要求。
2.3.2定量限、检测限
根据系统适用性试验项下对照品衍生溶液色谱图信噪比(S/N)为1109.36,将线性1号溶液稀释10倍,即可得到定量限,这时稀释样品图谱的信噪比为9.68,可以作为定量限样品溶液。将线性1号溶液稀释50倍,即可得到检测限,这时稀释样品图谱的信噪比为2.22,可以作为检测限样品溶液。因此方法检测的定量限为1.98ng,相当于定量检测左卡尼汀片中手性杂质右卡尼汀的限度为0.01%,检测限为0.4ng,相当于最低检测左卡尼汀片中手性杂质右卡尼汀的限度为0.002%,远低于规定左卡尼汀片中手性杂质右卡尼汀的限度1.0%的要求,说明本检测方法灵敏度高,符合样品检测右卡尼汀手性杂质的要求。

图4线性测定色谱图
2.3.3重复性
分别取1.6.2对照品衍生溶液和供试品衍生溶液各10μl注入液相色谱仪,记录色谱图。按外标法以峰面积计算含量,结果见表5。

表5 样品重复性试验结果汇总表
以上试验结果表明,本方法的重复性良好。
2.3.4溶液稳定性
考察供试品衍生溶液稳定性,计算右卡尼汀衍生物色谱峰面积,结果见表6。

表6溶液稳定性考察结果汇总表
试验结果表明,供试品衍生测定溶液放置12小时后,峰面积RSD=0.74%,同时色谱峰能完全分离,说明供试品衍生测定溶液在室温条件下至少12小时内是稳定的。
2.3.5回收率
取右卡尼汀(D-carnitine)对照品衍生溶液及低、中、高浓度加标供试样品衍生溶液(n=9同1.6.4)各10μl注入液相色谱仪,记录色谱图。按外标法以峰面积计算回收率,结果见表7。
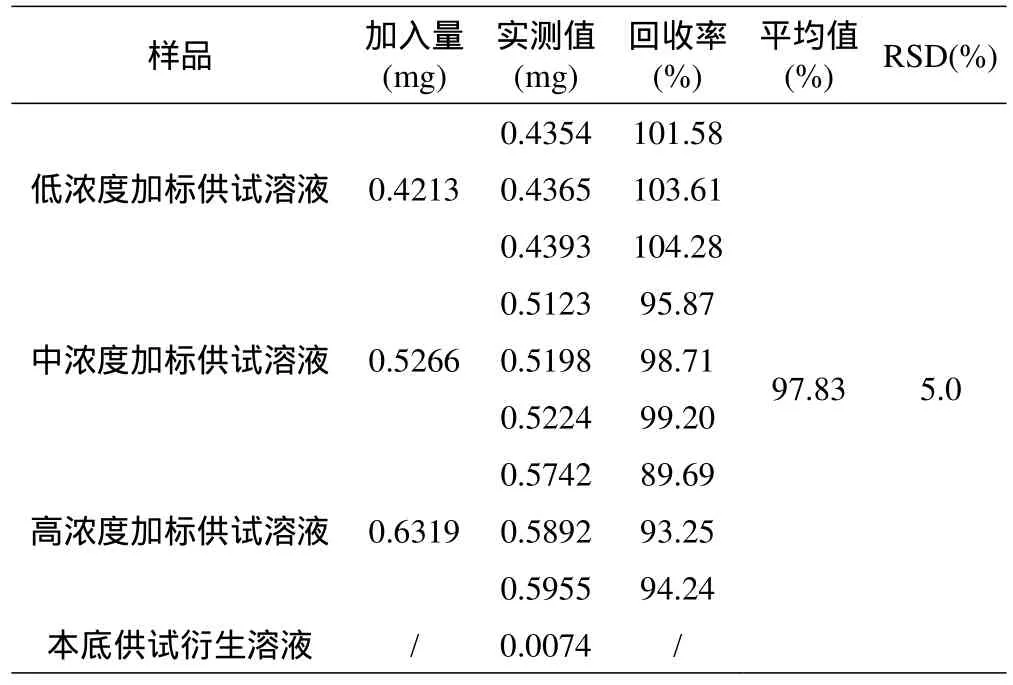
表7不同浓度回收率结果
以上结果表明,高、中、低三个浓度9个加标供试测定溶液的加样回收率均在80%~120%之间,回收率平均值为97.83%,RSD值为5.0%,说明回收率良好。
2.3.6耐用性
取对照品衍生液、供试品衍生液各10μl进样,记录色谱图,按外标法以峰面积计算含量,耐用性试验结果如表8。

表8耐用性试验结果
改变流速、柱温、流动相比例、PH值,供试品溶液中右卡尼汀测定结果为0.07±0.02%,说明本法耐用性较好。
在耐用性实验前为考察色谱条件的微小变化对本品中右卡尼汀手性杂质检查结果的影响,分别考察了流速、柱温、流动相比例、流动相PH值的变动对测定结果的影响:
①改变流速±10%(1、0.3ml/min;2、0.4ml/min)
②改变柱温±5℃(1、23℃;2、33℃)
③改变初始流动相有机相比例±5%(1、高氯酸钠溶液:乙腈=73:27;2、高氯酸钠溶液:乙腈=83: 17)
④改变PH±0.2(1、pH 3.6;2、pH 4.0)
实验中采用梯度洗脱,随着乙腈比例的增加,保留时间缩短较快。高效液相色谱法在对映异构体的分析中较为常用,但可用于L-肉碱与D-肉碱分析的方法却较少[7,13~17]。主要由于肉碱极性很大,在色谱柱上保留不好,同时在紫外可见光区吸收极弱,灵敏度不够。
2.4 样品测定
色谱条件与系统适用性试验 精密量取对照品衍生溶液10μL注入液相色谱仪中,记录色谱图,右卡尼汀衍生物峰理论塔板数计算不低于5000,左卡尼汀衍生物峰与右卡尼汀衍生物峰分离度应不小于1.5,调节右卡尼汀衍生物峰高为满量程10%~20%。精密量取供试衍生溶液和对照衍生溶液各10.0μL注入液相色谱仪中,记录色谱图,若供试衍生溶液中有右旋卡尼汀衍生物峰,按外标法以峰面积计算,即得则不得过1.0%。
测定法 三批样品照高效液相色谱法(中国药典2010年版附录VD测定,结果见表9。

表9样品杂质测定结果
3 结论
本法适用于左卡尼汀片中右卡尼汀手性杂质检查,三批样品中杂质含量均在0.1%以下,远低于限度1.0%。通过方法学验证:专属性及系统适用性、重复性、线性关系与范围、回收率、检测限及定量限及耐用性等试验考察,该方法可行。首次对左卡尼汀片中的杂质右旋卡尼汀含量测定进行了方法确立与可行性研究。
采用柱前衍生法在phenomenex LUX Cellulose-1手性色谱柱上进行分析,建立测定L-肉碱中D-肉碱含量的测定方法。该手性高效液相色谱法分离与分析对映异构体具有快速、简单、高灵敏度等特点,对L-肉碱、D-肉碱具有良好的分离与分析效果,可用于L-肉碱类原料药、保健品等样品中D-肉碱的含量检测。
本研究在参考国内外文献的基础上[18],改进了检测方法,肉碱对映体化学反应主要发生在酯键或羟基,手性试剂常与肉碱结构中的羟基反应。采用衍生化方法用手性色谱柱分离左卡尼汀手性杂质。该技术与衍生后用HPLC分析相比较,克服了实验过程复杂、重复性差的缺点。
[1] 向忠权, 浦国荣, 韦志明, 等. 左旋肉碱的合成与应用[J]. 化工技术与开发, 2013, 42(2):15-21.
[2] Morettis S, Famularo G, Marcellini S,et al.L-carnitine reduces lymphocyte apoptosis and oxidant stress in HIV-1- infected subjects treated with zidovudine and didanosine [J]. Antioxid Redox Signal,2002, 4(3): 391-403.
[3] Knüttel G S, Harmeyer J. The determination of L-carnitine in several food samples[J]. Food Chem, 2007, 105( 2): 793-804.
[4] 郭文怡, 杨勇, 贾国良, 等. 左旋卡尼汀对缺氧/复氧诱导的心肌细胞氧化、凋亡影响的体外研究[J]. 中国病理生理杂志, 2005,21(1): 72-76.
[5] 王丽霞, 刘安军, 朱晓萍, 等.羊肉中L-肉碱抗疲劳作用的研究[J].现代食品科技,2008,24(6):509-512.
[6] Vogtc C, Kiessig S. Separation of D /L-carnitine enantiomers by capillary electrophoresis [J]. Journal of Chromatogr A, 1996, 745:53- 60.
[7] 祝伟霞, 冀州, 刘亚风, 等. 保健品中左旋肉碱的反相高效液相色谱法测定[J]. 分析测试学报, 2008, 27 (10):1124-1127.
[8] Alhpmida A S, Duhaimanas A J A,et al.Determination of L-carnitine, acylcarnitine and total carnitine levels in plasma and tissues of camel[J]. Comparative Biochemistry and Physiology,1995, 111(3) : 441- 445.
[9] Freimller S, Altorfer H. A chiralHPLC m ethod for the de term ination of low am ounts ofD-carn itine in L- carnitine after derivatization w ith ( + ) - FLEC[J]. J PharmBiomed Anal. 2002, 30:209- 218.
[10] Kagawa M, Mach I Y, Nish I H. Enantiomeric purity determination of acety-L-carnitine by reversed-phase high-performance liquid chromatography using chiralderivatization[J]. Journal Chromatography: A, 1999, 857: 127-135.
[11] Vogt C, Georgi A, Wener G.Enantiomeric separation of D/L-carnitine using HPLC and CZE after derivatization[J]. Chromatographia,1995, 40( 5 /6): 287- 295.
[12] 徐娟娟, 李杰梅, 梁淑明, 等.手性高效液相色谱法测定左旋肉碱中光学异构体的含量[J].现代食品科技,2010,26(3):311-313.
[13] Misako T,Kiyoshi T,Motohiro N,et al.Separation of carnitine enantiomers as the 9-anthroylnitrile derivatives and highperformance liquid chromatographic analysis on an ovomucoidconjugated column[J]. Journal of Pharmaceutical and Biomedical Analysis, 1996, 14: 1579- 1584.
[14] 赵亚明, 李任, 王得新, 等.高效液相色谱法检测血浆左旋肉碱方法的建立[J]. 中国临床神经科学, 2006, 14 (5) :528-532.
[15] 甘宾宾, 黎少豪. HPLC法测定保健品中左旋肉碱含量的研究[J].中国卫生检验杂志, 2010, 20(7):1688-1689.
[16] 赵榕, 孙开奇, 罗仁才. 离子对反相高效液相色谱测定保健品中的肉碱[J]. 实验技术与方法, 2002, 14(4): 25-26.
[17] 胡晓娟, 张锦, 赵阗. 反向高效液相色谱法测定保健品中左旋肉碱的含量[J]. 光谱实验室,2011,28(2):743-745.
[18] Acquarica I D, Gasparrini F, Giannoli B,et al.Enantio- and chemselective HPLC separations by chiral- achiral tandem columns approach:the combination of Chirobiotic TAG and SCX columns for the analysis of propiony carnitine and related impurities[J]. Journal of Chromatography A, 2004, (1061): 167-173.
