短期模拟微重力对SD乳鼠皮层和小脑原代细胞的影响研究1
2015-04-23曾凡邓玉林庆宏
曾凡,邓玉林,庆宏
(北京理工大学生命学院,北京 100081)
随着我国神州系列载人飞船的成功发射,我国的航天医学也日渐繁荣。空间环境中包含多种对人体不利的因素,其中微重力(或称失重)是目前为止的研究热点。宇航员在空间环境中虽然有宇航服等保护措施,但这些措施仍然无法消除微重力。而微重力给宇航员带来的生理改变也渐渐水落石出,不可忽视。主要有微重力可导致心血管功能失调,进而导致运动能力下降和立位耐力不良等[1];微重力还可导致骨质丢失骨骼肌萎缩等严重影响航天员健康的问题[2];并且微
重力对免疫系统也有不良影响[3]。国内外也越来越聚焦于微重力对中枢神经系统的影响,并有相关报道[4~6]。尽管微重力相关报道如雨后春笋,但目前仍无关于微重力对不同脑区一氧化氮合酶活性及细胞凋亡率的影响的报道,所以本实验试图比较皮层和小脑经模拟微重力刺激之后一氧化氮合酶活性的变化。本实验旨在补充模拟失重对中枢神经系统影响方面的数据,为深入研究做铺垫。
1 材料与方法
1.1 主要设备和试剂
SM-31双轴驱动框架式回转器(中国科学院空间科学与应用研究中心研制),解剖显微镜(OPTEC显微镜,重庆),玻璃珠灭菌仪(Keller公司,瑞士),全自动流式细胞分析仪(BACKMAN COULTER公司,美国),DMEM/F12基础培养基(GIBCO公司,美国),胎牛血清(GIBCO公司,美国),Annexin V-FITC凋亡试剂盒(Miltenyi Biotec,德国),一氧化氮合成酶检测试剂盒(碧云天公司,中国)。
1.2 微重力效应体系的构建
将新生SD乳鼠经过碘酒和75%酒精擦拭全身之后,断头取脑,将鼠脑浸泡在D-hanks缓冲液中,并轻微冲洗以去除部分血管。在解剖显微镜下分离出皮层和小脑两个脑区并将血管、脑膜剔除干净。将得到的两个脑区分别用组织剪剪碎及移液枪的轻柔吹打后,再用200目筛网过滤,得到细胞悬液。将细胞悬液在1200rpm/min的转速下离心5min,弃上清,用新鲜的含10%血清的DMEM/F12培养液重悬,调整细胞浓度后分别接种于L-多聚赖氨酸包被的12.5cm2培养瓶中,并于培养箱内培养7天左右,隔天半量换液。当细胞贴壁、状态良好时,将两种原代细胞分别随机分为模拟微重力组(Simulated Microgravity group,SMg)和地面对照组(Control group,Ctr)。将所有培养瓶灌满 DMEM/F12培养基,再将模拟微重力组安装在SM-31双轴驱动式回转器上,设置转速为随机模式,将地面对照组平放在同一培养箱内。回转一天后,取下模拟微重力组以及地面对照组,并进行一氧化氮合成酶(NOS)活性和细胞凋亡的检测。
1.3 流式细胞仪检测一氧化氮合成酶活性
将地面对照组和模拟微重力组的皮层、小脑的原代细胞按照一氧化氮合成酶检测试剂盒的说明进行操作。随后使用流式细胞仪进行检测。
1.4 流式细胞仪检测原代细胞凋亡
将地面对照组和模拟微重力组的皮层、小脑的原代细胞按照Annexin V-FITC凋亡试剂盒的说明进行操作。随后使用流式细胞仪进行检测。
2 结果
2.1 流式细胞仪检测的两个脑区的一氧化氮合成酶活性
皮层和小脑的原代细胞经过一天的模拟微重力刺激以后,与地面对照组一起按照一氧化氮合成酶检测试剂盒的说明进行操作,并使用流式细胞仪对其荧光值进行检测。按照试剂盒说明书的要求,设置一个空白对照及实验中的模拟微重力组和地面对照组。将测得的模拟微重力组和地面对照组的荧光强度的数据分别减去空白对照的荧光强度,即为各组样品的真实的荧光强度。再将地面对照组的一氧化氮合成酶活力设为1,将模拟微重力组的光强与之相比,得到的数值即为相对酶活力。如图1所示,皮层原代细胞经过模拟微重力刺激以后,酶活无显著性差异,小脑原代细胞亦是如此。且小脑与皮层相比,两个脑区的酶活数值几乎相等,无显著差异。

图1模拟微重力对皮层、小脑两个脑区的一氧化氮合成酶相对活性的影响(实验结果的分析采用t检验,p<0.05时被认为两组间具有显著差异)
2.2 流式细胞仪检测的两个脑区的细胞凋亡情况
皮层和小脑两个脑区的原代细胞经过模拟微重力处理后,与地面对照组一起按照凋亡试剂盒的说明进行操作,并使用流式细胞仪对其荧光值进行检测。如图2所示,将B2和B4象限的百分比加和,得到的数值即为凋亡细胞占总细胞数的百分比,即图3中纵坐标Apoptosis%代表的数值。如将图2中A图所示,将B2象限的3.9%和B4象限的1.0%加和,得到4.9%,即为皮层地面对照组的凋亡细胞占总细胞的百分比。由图3可见,皮层的地面对照组和模拟微重力组两组之间的细胞凋亡率无显著差异,小脑也是如此。皮层模拟微重力组的凋亡率会略高于地面对照组,小脑的两组间差异很小。
3 讨论
机体内NO的形成需要一氧化氮合成酶(NOS)的参与,NOS催化L-Arg和氨作用产生NO和L-胍氨酸。根据NOS的组织分布等的差别,NOS可分为三种同工酶,分别是神经元型NOS(nNOS)、诱导型NOS(iNOS)和内皮型NOS(eNOS)[7]。一氧化氮作为一种非典型的神经递质,近年来逐渐成为研究热点。NO有多种生物学作用,主要参与信息传递、与GC结合等过程,在脑损伤、脑循环等过程中有重要的调节作用[8]。通过检测细胞内NOS的酶活性,可反应细胞内NO的水平。NO是否会受模拟微重力影响,皮层和小脑的NOS活性变化幅度是否相似成为本实验的研究目的。本实验中使用的一氧化氮合酶检测试剂盒可以检测总一氧化氮合酶相对活性,但无法分别检测三种同工酶的酶活,但总酶活的变化仍可代表脑区内NO的产量变化。通过本实验我们发现,一天的模拟微重力刺激并未显著改变皮层和小脑的一氧化氮合成酶活性,且两个脑区之间也无显著差异,说明一天的模拟微重力没有对这两个脑区的NOS酶活造成影响,并且皮层和小脑在NOS活性这一方面对模拟微重力的响应是一致的。

图2流式细胞仪检测的皮层、小脑原代细胞的细胞凋亡结果图。图中A为皮层地面对照组的细胞凋亡结果图;B为皮层模拟微重力组;C为小脑地面对照组;D为小脑模拟微重力组
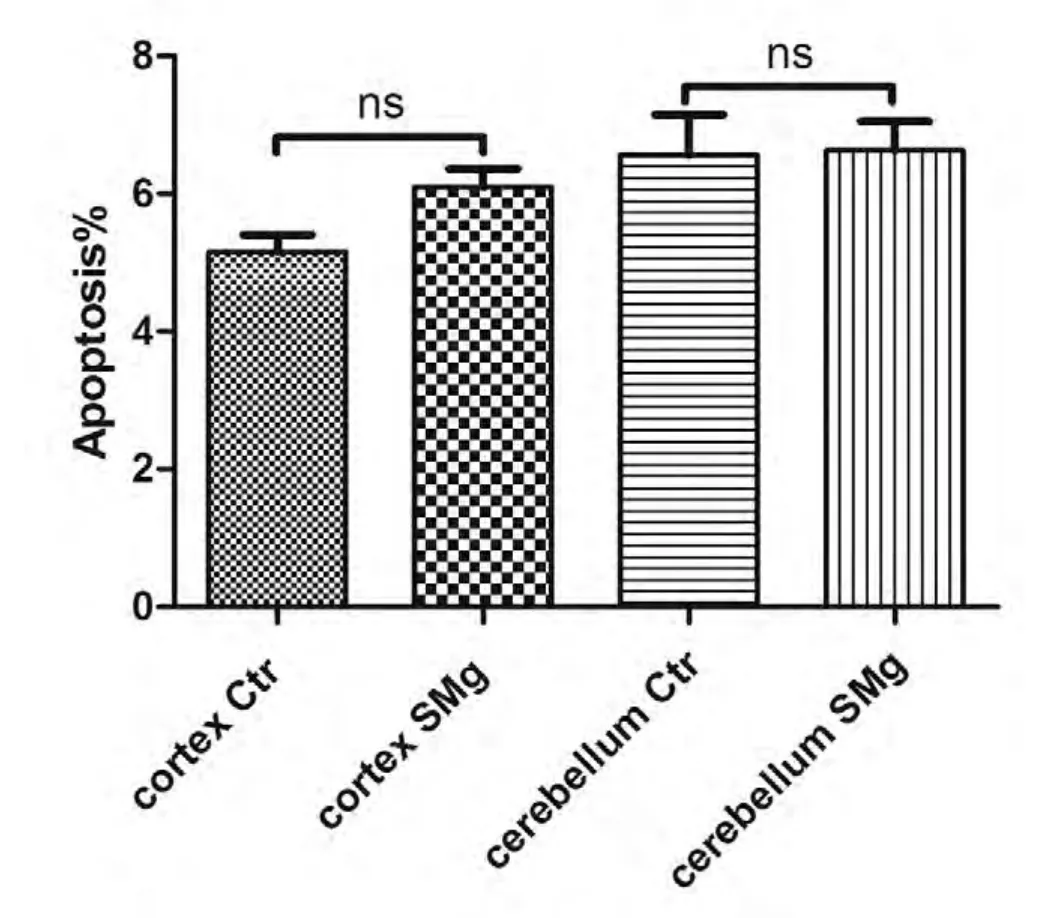
图3模拟微重力对皮层、小脑两个脑区的细胞凋亡率的影响(实验结果的分析采用t检验,p<0.05时被认为两组间具有显著差异)
细胞凋亡是细胞由基因控制的程序性死亡,早期凋亡的标志之一是位于细胞膜内侧的磷酯酰丝氨酸迁移至细胞膜外侧;晚期凋亡的标志之一则是细胞膜破损兼DNA被核酸内切酶切割成DNA片段。流式细胞术作为一种灵敏度高、可定量的检测方法,是目前常用的一种检测细胞凋亡的方法,相较于形态学观察更具有可靠性[9]。Annexin V-FITC凋亡试剂盒的原理是Annexin V可与外翻的磷酯酰丝氨酸结合,由于Annexin V带有FITC,所以可通过检测绿色激发光的量来判断细胞是否发生早期凋亡。当细胞膜破损以后,碘化丙啶(PI)可与DNA片段相结合,可通过检测红色激发光的量来判断细胞的晚期凋亡情况。细胞坏死也可导致PI与DNA结合,但坏死细胞的磷酯酰丝氨酸未发生外翻,所以Annexin V-FITC凋亡试剂盒将Annexin V和PI结合共同鉴定细胞的凋亡程度。当细胞既不结合Annexin V又不结合PI时(Annexin V-/PI-,图2中B3象限),说明该细胞为正常活细胞;当细胞为Annexin V+/PI-时(图2中B4象限),说明细胞处于早期凋亡状态;当细胞为Annexin V-/PI+时(图2中B1象限),说明该细胞为坏死细胞;当细胞为Annexin V+/PI+时(图2中B2象限),细胞则处于晚期凋亡状态。
由图3我们可以看出,虽然皮层和小脑的模拟微重力组和地面对照组相比没有显著差异,说明模拟微重力并不会明显改变这两个脑区的细胞凋亡率。但皮层的模拟微重力组比地面对照组略高,小脑的两组几乎持平,说明皮层对模拟微重力较小脑更为敏感,但程度有限。
皮层与小脑在中枢神经系统中负责不同的功能,细胞组成也有一定差异,所以模拟微重力对两个脑区造成的影响可能会有所差异,丁桂荣等研究电磁脉冲辐射对大鼠小脑和海马两个脑区中一氧化氮合酶的变化,研究发现辐照不同时间后,海马中NOS阳性神经元数目显著性下降,但小脑的NOS阳性神经元数目在辐照之后无明显变化[10]。李积胜等在研究睡眠剥夺对大鼠大脑皮层及海马一氧化氮合酶的影响时发现,与正常对照组比较, 各组睡眠剥夺大鼠皮层及海马NOS阳性神经元数目均显著减少,两个脑区的变化趋势虽一致,却有细微的数值差别[11],这一现象与本实验皮层和小脑的细胞凋亡率的微重力响应相似,但在NOS酶活上无明显体现。
本实验中采用的双轴回转器是一种可以有效模拟生物微重力效应的设备,回转器的内外框在随机模式下转动[12],使得回转器上装载的生物样本在未来得及感受到重力的时候,重力的矢量方向就已发生了改变,其结果就是重力来不及对生物体产生作用,即模拟了微重力效应[13~15]。由于航空搭载的费用昂贵、机会少以及会受其他因素的干扰(噪音、辐射)等原因,使得在真实失重环境下进行实验有一定难度。加之落塔提供的微重力时间太短,无法满足长时间微重力效应研究的需求。这些原因共同促进了回转器的广泛使用。回转器操作简便、可满足长时间模拟微重力的需求,而且价格低廉,目前已成为一种模拟微重力效应的有效手段。实验结果表明,在双轴回转器上回转过的拟南芥,其根的生长方向较对照组相比杂乱无序,与空间实验结果一致[13]。
本实验通过检测SD乳鼠皮层和小脑两个脑区的细胞凋亡率及一氧化氮合酶活性在模拟微重力刺激后的变化,发现一天的模拟微重力刺激对凋亡率和NOS活性均无显著性的改变,但将皮层和小脑两组数据相比较可以发现,在细胞凋亡方面,两个脑区对模拟微重力的敏感程度稍有差异,说明这两个脑区的模拟微重力响应稍有不同。
[1] Limper U, Gauger P, Beck P,et al.Interactions of the human cardiopulmonary, hormonal and body fluid systems in parabolic fl ight. Eur. J. Appl. Physiol., 2014, 114(6): 1281-1295.
[2] Jia B, Xie L, Zheng Q,et al.A hypomagnetic fi eld aggravates bone loss induced by hindlimb unloading in rat femurs. PLoS One, 2014,26,9(8): e105604.
[3] Tauber S, Hauschild S, Paulsen K,et al.Signal transduction in primary human T lymphocytes in altered gravity during parabolic flight and clinostat experiments. Cell. Physiol. Biochem., 2015,35(3):1034-1051.
[4] Mandsager K T, Robertson D, Diedrich A. The function of the autonomic nervous system during spaceflight. Clin. Auton. Res.,Mar. 2015 [Epub ahead of print].
[5] Pani G, Samari N, Quintens R,et al.Morphological and physiological changes in mature in vitro neuronal networks towards exposure to short-, middle- or long-term simulated microgravity.PLoS One, 2013, 16, 8(9): e73857.
[6] Chen H L, Qu L N, Li Q D. Simulated microgravity-induced oxidative stress in different areas of rat brain. Sheng Li Xue Bao,2009, 25, 61(2):108-114.
[7] 罗南萍, 黄厚斌. 一氧化氮、一氧化氮合酶与视网膜病变. 放射免疫学杂志, 2001, 14 (2) : 118-120.
[8] 许敬, 方明, 黄叔怀. 运动后大鼠小脑诱导型一氧化氮合酶的动态变化. 中国临床康复, 2004, 8 (33) : 7514-7515.
[9] 矫毓娟, 刘江红. 细胞凋亡的检测方法. 中国神经免疫学和神经病学杂志, 2004, 11 (1) : 53-56.
[10] 丁桂荣, 谢学军, 张李燕, 等. 电磁脉冲辐照后大鼠小脑、海马中一氧化氮合酶的变化. 中华物理医学杂志, 1998, 20 (2) : 81-83.
[11] 李积胜, 李朝福, 陈俊, 等. 睡眠剥夺对大鼠大脑皮层及海马一氧化氮合酶的影响. 武警医学院学报, 2005, 14 (1) : 5-7.
[12] Hoson T, Kamisaka S, Masuda Y,et al.Evaluation of the threedimensional clinostat as a simulator of weightlessness. Planta, 1997,203 Suppl: S187-197.
[13] 蒋远大, 李维宁, 王鲁峰, 等. 几种新型回转器. 航天医学与医学工程, 2008, 21 (4) : 368-371.
[14] 王路, 支天. 回转器基本特性分析及其实现方法. 电力学报, 2008,23 (5) : 386-401.
[15] 陈曦. 模拟微重力效应的单轴回转器转速设定的研究[D]. 大连:大连海事大学生物物理学, 2011.
