通过相关性分析进行水质检测质量控制的探讨
2015-04-23刘晓芳
刘晓芳,韩 宇
(东北煤田地质局沈阳测试研究中心煤质化验室,辽宁 沈阳110016)
1 水质检测
水质检测是水资源保护的基础工作,反映水质状况的检测数据也日益受到社会重视。水质即水的品质,是指水及其所含杂质共同表现出来的综合特性。水质指标是指水体中除水分子以外所含其他物质的种类和数量,是描述或表征水质质量优劣的参数。日常所说的水(天然水)实质上是含有多种物质的水溶液,因而水质指标数量繁多,且因用途不同而不同。一般来说,天然水、生活饮用水以及工业污水的常用水质指标也有十几项到几十项不等。
对于每个水样来说,一般需要几个人分别检测不同项目,因此,检测中的偶然误差出现机率也在增加。由于检测数据往往直接关系到各部门对水质的要求,所以,就要求检测数据必须能准确、及时、科学地反映水样的真实情况。而要确保水质检测数据准确可靠,对检测数据进行合理性分析十分重要。
2 水质检测中数据的相关性分析
2.1 水中游离二氧化碳和侵蚀性二氧化碳的相关性
游离二氧化碳是指溶于水中的二氧化碳。水体中的二氧化碳来自有机物的分解及接触空气时的吸收等。其溶解度与温度、压力等有关。游离二氧化碳的含量,可在规定条件下用碱液滴定法测定,用二氧化碳的mg/L来表示。二氧化碳在地下水中含量一般为10~50 mg/L,高时达100~200 mg/L。由于温度、压力的变化,导致二氧化碳溶解度的变化,地面水中二氧化碳含量一般约在10~20 mg/L。
侵蚀性二氧化碳是超过平衡量并能与碳酸钙起反应的游离CO2。当水溶解碳酸钙形成重碳酸钙时,水中必有相应量的游离CO2与之保持平衡。
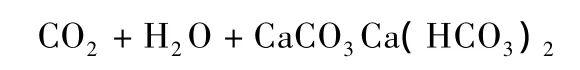
式中可见,当游离CO2等于或小于平衡量时,碳酸钙就不再溶解。但当游离CO2大于平衡量时,反应向右进行。这些大于平衡量的多余的CO2,除一部分留作与新产生的重碳酸钙保持平衡外,大部分参加反应形成重碳酸钙。游离二氧化碳能使碳酸钙变成可溶性重碳酸盐,此时的游离二氧化碳被称为侵蚀性二氧化碳。对混凝土与金属有破坏作用,特别是与氧共存时,对金属的侵蚀性更强。
由以上可见,理论上来说:游离二氧化碳含量要大于或等于侵蚀性二氧化碳。但是我们在实际分析的过程中会出现侵蚀性二氧化碳的测值大于游离二氧化碳的测值。
2.1.1 侵蚀性二氧化碳会大于游离二氧化碳的原因
经过在实际工作中数据比较和分析,总结主要有三个方面原因导致侵蚀性二氧化碳测值会大于游离二氧化碳测值:
(1)水样送验过程中未进行密封保存(数据分析见表1)。
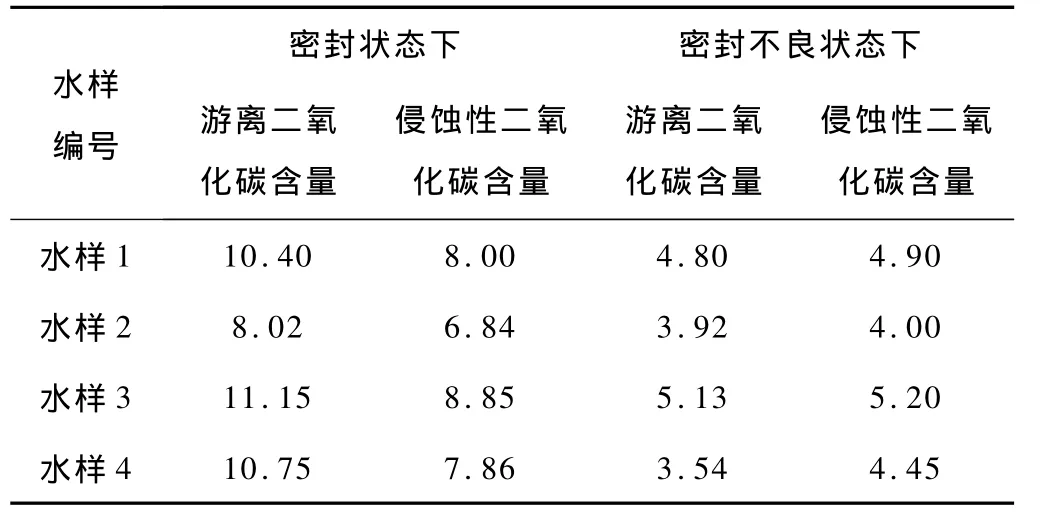
表1 水样不同密封状态下游离二氧化碳与侵蚀性二氧化碳的含量 mg/L
由上表可见,密封不良的水样要比密封状态下的水样,游离二氧化碳含量明显降低。这是因为水样的压力减小,水溶解度也相应减小,也就是水中溶解的游离二氧化碳减小,游离二氧化碳极不稳定,放置过程中就会因为密封不严而损失。而侵蚀性二氧化碳是在加入大理石粉之后,就产生CO2+H2O+CaCO3Ca(HCO3)2的反应,减少了二氧化碳的外溢。
因此,密封不良会造成侵蚀性二氧化碳测值大于游离二氧化碳测值的现象。(2)添加的大理石粉未按标准处理或未妥善储存导致碳酸钙与二氧化碳反应生成部分碳酸氢钙,使侵蚀性二氧化碳测值升高(分析数据见表2)。
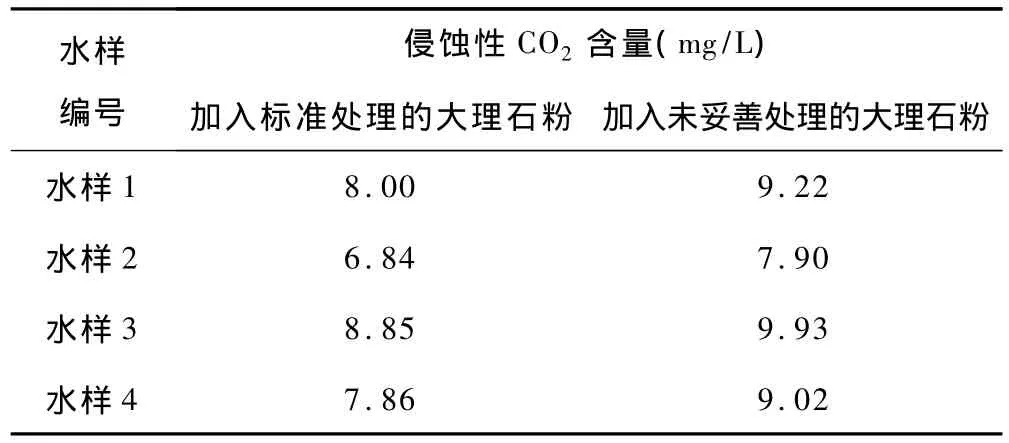
表2 水样经不同大理石粉处理后的侵蚀性二氧化碳的含量
按照标准,进行侵蚀性二氧化碳检测前,大理石粉必须经过处理:将一定粒度的大理石粉末,在蒸馏水中浸泡2h,用热蒸馏水多次冲洗至滤液呈中性,滤干然后烘干,密封备用。
由表2可见,加入未处理的大理石粉后,测定的侵蚀性二氧化碳含量明显高于加入处理大理石粉所测得侵蚀性二氧化碳含量,这是因为未处理的大理石粉极易与空气中的二氧化碳反应生成碳酸氢钙,化学反应式:CaCO3+CO2+H2OCa(HCO3)2。水样中若加入未处理的大理石粉,则把空气中的二氧化碳带入了水样中,造成侵蚀性二氧化碳的测值偏高,也就造成侵蚀性二氧化碳值高于游离二氧化碳值。
(3)水样中有机物含量较高时,放置五天侵蚀性二氧化碳测值也会偏高;
这是由于水中的有机物含量较高时,在放置五天的过程中,微生物会分解有机物与溶解氧生成二氧化碳,二氧化碳与碳酸钙反应,在测定侵蚀性二氧化碳时,就会出现测值偏高。如此也就造成侵蚀性二氧化碳含量高于游离二氧化碳含量。
2.1.2 水样中游离二氧化碳与侵蚀性二氧化碳之间存在的理论关系
通过游离二氧化碳可以计算出侵蚀性二氧化碳含量的理论值:
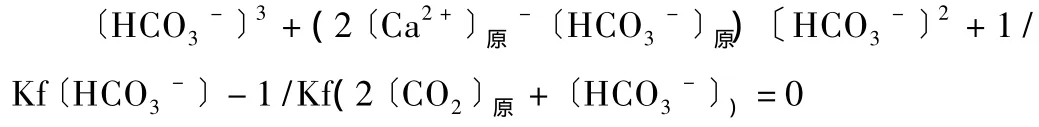
式中:〔Ca2+〕原,〔HCO3-〕原,〔CO2〕原为原水样中钙离子,碳酸氢根离子,游离二氧化碳实测浓度(mol/L);〔HCO3-〕为水样中加入大理石粉后,达到平衡时碳酸氢根离子的浓度(mol/L);K为平衡常数(与水温有关);F为活度系数(与离子浓度和电荷数有关)。
如果在实际工作中出现侵蚀性二氧化碳含量大于游离二氧化碳含量的情况,我们就应该在各环节找出出现颠倒的原因并加以纠正。再就是如果游离二氧化碳含量为0,则侵蚀性二氧化碳就无需再测,含量也应该是0。
2.2 水中阴、阳离子的相关性
因为水是电中性的,简单来说就是正电荷数目等于负电荷数目。水又是由阴阳离子组成的液体矿产,阴阳离子间也保持一种平衡状态,在做水质分析时,对于水中阴阳离子间的平衡系统应该如何掌握?
2.2.1 电荷守恒
电解质溶液中所有阳离子所带有的正电荷数与所有阴离子所带的负电荷数相等;但在实际工作中,有时阴阳离子的正负电荷数差别很大,主要原因是:
(1)水样暴露空气中受到了污染;(2)水样中本来就存在检测不出来的离子;(3)滴定过程中指示剂变色判断出现误差;(4)标准溶液标定浓度时有误差;(5)仪器在检测过程中出现漂移。
2.2.2 物料守恒
考虑水解前后碳元素守恒;
2.2.3 定组成守恒
电解质溶液中由于电离或水解因素,离子会发生变化,变成其他的离子或分子,但离子或分子中某种特定元素的原子的总数是不会改变的;
水中阴离子mol/L总计(∑A)与阳离子mol/L总计(∑B),二者在理论上是相等的。但在实际检测中由于分析中存在的种种误差,∑A与∑B,二者往往不相等,但误差不得超过±2%。
当水样中的K+、Na+未测定时,阴离子(mol/L)总计应该大于阳离子(mol/L)总计,也就是∑A大于∑B,否则检测出的值是存在错误的。
在我们日常的水质分析过程中,是经常用阴阳离子平衡来评价水质和检测质量的。所以在检测过程中应遵守以上的守恒定律,来进行阴、阳离子的测试。
2.3 水中pH值与酸、碱度的相关性
pH值,酸碱度,硬度,和矿化度四项综合指标,集中地表示了地下水的化学性质。
pH值反映了地下水的酸碱性,由酸、碱和盐的水解因素所决定。pH值与电极电位存在一定关系,它影响地下化学元素的迁移强度,是进行水化学平衡计算和水检测结果的重要指标。
酸度是指强碱滴定水样中的酸至一定pH值的碱量。地下水中酸度的形成主要是未结合的二氧化碳、无机酸、强酸弱碱盐以及有机酸。
碱度是指水中能与强酸发生中和作用的物质总量,包括强碱、弱碱、强碱弱酸盐。地下水中的碱度主要是由重碳酸盐、碳酸盐和氢氧化物引起的,其中重碳酸盐是水中碱度的主要形式。
酸度、碱度和pH都是水的酸碱性质的指标,它们既互相联系,又有一定差别。水的酸度或碱度是表示水中酸碱物质的含量,而水的pH值表示水中酸或碱的强度,即水的酸碱性强弱。
在检测中应注意的是:氢氧根离子和重碳酸盐是不能共存的,因为:HCO3-+OH-CO32-+H2O,所以在检测过程中,可能存在的碱度组成有五类:OH-碱度;OH-和CO32-碱度;CO32-碱度;CO32-碱度和 HCO3-碱度;HCO3-碱度,如果出现其他情况,则是检测过程中出现了问题。
pH值与酸碱度关系公式:
2.3.1 碱度 HCO3-与游离CO2共同存在的情况下
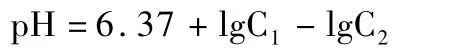
式中:C1为碱度的含量(mg/L);C2为游离CO2的含量(mg/L)
2.3.2 碱度 HCO3-、CO32-存在的情况下

式中:C1为 HCO3的含量(mg/L);C3为CO32-的含量(mg/L)
2.3.3 只有碱度 HCO3-存在的情况下
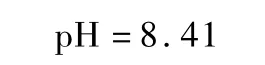
在实际操作中,当 pH >8.41应该检出 CO32-,pH <8.41应该检出游离二氧化碳。
多数地下水的 pH在 4.4-8.3范围,H2CO3H++HCO3-水解平衡时,水中既有 CO2酸度,又有HCO3-碱度。所以同一个水样既能测酸度又能测碱度。
碱度和酸度是判断水质和废水处理控制的重要指标,pH值是水质分析最重要的理化参数之一,因此在在水质分析领域都需要测量pH值、酸度和碱度。
掌握了水中pH值与酸、碱度的相关性,也为我们在水质检测过程中的质量控制提供了极大的依据,使检测数据更科学、规范。
2.4 水中硬度与总碱度的相关性
水的硬度指水中Ca2+、Mg2+浓度的总量,是水质的重要指标之一。水的硬度按阴离子组成分为碳酸盐硬度和非碳酸盐硬度两类,总硬度等于碳酸盐硬度和非碳酸盐硬度的总和。
水中的碱度主要是由重碳酸盐、碳酸盐和氢氧化物引起的,其中重碳酸盐是水中碱度的主要形式。碱度也常用于评价水体的缓冲能力及金属在其中的溶解性和毒性等。工程中用得更多的是总碱度这个定义,一般表征为相当于碳酸钙的浓度值。
碳酸盐硬度是由重碳酸盐(Ca(HCO3)2、Mg(HCO3)2)和碳酸盐(CaCO3)引起的硬度,一般加热煮沸可以除去,所以也称为暂时硬度。
非碳酸盐硬度主要是由 CaSO4、MgSO4、CaCl2、MgCl2等引起的硬度,经加热煮沸除不去,因此又称为永久硬度。
负硬度(钾钠硬度)是地下水中碱金属钾钠的碳酸盐、重碳酸盐和氢氧化物的含量。
即:总硬度=暂时硬度+永久硬度=碳酸盐硬度+非碳酸盐硬度
负硬度(钾钠碱度)=总碱度-总硬度(总碱度>总硬度)
2.4.1 碳酸盐硬度
当HCO3-(mol/L)>(Ca2++Mg2+)(mol/L)时,碳酸盐硬度=总硬度=总碱度;
当HCO3-(mol/L)<(Ca2++Mg2+)(mol/L)时,碳酸盐硬度(按CaCO3计)=HCO3-(mol/L)×50.05;
2.4.2 非碳酸盐硬度
当HCO3-(mol/L)<(Ca2++Mg2+)(mol/L)时,非碳酸盐硬度=总硬度-碳酸盐硬度;
当HCO3-(mol/L)>(Ca2++Mg2+)(mol/L)时,非碳酸盐硬度=0。
对水碱度(HCO3-)与水硬度(Ca2++Mg2+)的相关性分析,可以对水质的硬度进行直观的判断,而且通过各种关系的推算,可以得到不同水质对不同指标的要求。
3 结语
质量是企业的生命,每个数据的准确与否决定着提供的单位在激烈的市场竞争中生存和发展,和每个检测人员及检测单位息息相关。掌握不同指标间的相互关系,对质量控制也提供了依据性。
进行质量控制的过程,就是发现问题并进行及时纠正的过程:水质检测中,每个项目既是单独存在,又是相互联系的。既起着独自提供单一项目数据的作用,又同时互相验证,为质量控制提供依据。但这一切都必须在认真、科学、客观地提供每一个数据前提下,如此才能准确地验证每个指标之间的相互关系。
[1王虎.水质检验技术.北京:科学出版社出版.2011.
[2]唐益群,杨坪,王建秀,等.工程地下水.上海:同济大学出版社出版.2011.1.
[3]DZ/T0064.1 ~0064.80 -93.地下水质检验方法.中华人民共和国地质矿产部发布.1993-10-01实施.
[4]MT/T206-2011.煤矿水硬度的测定.中华人民共和国煤炭行业标准.2012-05-01实施.
[5]MT/T204-2011.煤矿水碱度的测定.中华人民共和国煤炭行业标准.2012-05-01实施.
[6]MT/T367-2007.煤矿水中侵蚀性二氧化碳的测定.中华人民共和国煤炭行业标准.2008-01-01实施.
