外周T细胞淋巴瘤患者65例预后的相关因素分析
2015-04-23何红梅孙秀华徐丽叶丁晓蕾
何红梅,程 晔,孙秀华,张 弦,徐丽叶,丁晓蕾
外周T细胞淋巴瘤患者65例预后的相关因素分析
何红梅,程 晔,孙秀华*,张 弦,徐丽叶,丁晓蕾
(大连医科大学附属第二医院肿瘤4科,大连116027)
从临床角度分析外周T细胞淋巴瘤(PTCL)的相关因素对预后的影响,为临床病情监测及预后评估提供参考。收集2005年1月至2014年12月入住大连医科大学附属第二医院的76例PTCL患者的临床资料,其中65例资料完整,11例病例失访。采用Kaplan-Meier法进行生存分析。对年龄、性别、临床分期、淋巴瘤国际预后指数(IPI)、B症状、血红蛋白(Hb)、血清β2微球蛋白(β2-MG)、乳酸脱氢酶(LDH)、血清白蛋白(ALB)水平,以及治疗方法、病理分型、首发部位、预后指数PIT、骨髓是否受侵等因素进行单因素分析,并进一步采用Cox回归风险模型对单因素分析中有统计学意义的参数进行多因素分析。65例PTCL病例中包括非特异型(PTCL-U)25例,结外自然杀伤细胞(NK)/鼻型T细胞淋巴瘤(TCL)10例,血管免疫母细胞性T细胞淋巴瘤(AITL)9例,间变性大细胞淋巴瘤(ALCL)9例。单因素分析表明,年龄≤60岁的患者比>60岁的患者预后好(=0.008);Ⅰ/Ⅱ期患者比Ⅲ/Ⅳ期患者的5年生存率高(74.4%19.0%,=0.011);IPI指数低危、中低危、中高危、高危组的5年生存率分别为85.7%、52.5%、0.0%和0.0%(=0.004);初诊时LDH升高的患者预后比LDH正常或降低的患者差(=0.048);初诊时ALB降低的患者比ALB正常者预后差(=0.008);首发部位为结外的患者比首发部位在淋巴结的患者预后较好(=0.002)。将PIT指数分为0、1、2和≥3组,其5年生存率分别为92.3%、85.7%、17.4%和0.0%(=0.002)。多因素分析显示,PIT评分指数为PTCL的独立预后危险因素(=0.002)。年龄、临床分期、IPI指数、LDH、ALB、病理分型、首发部位及PIT为预后影响因素,PIT为PTCL的独立预后影响因素。
外周T细胞淋巴瘤;预后
外周T细胞淋巴瘤(peripheral T-cell lymphoma,PTCL)的恶性程度高、侵袭性强,发生部位不局限于淋巴结内,经常侵及肝、脾、骨髓、皮肤等结外器官,病程进展快、预后差[1−3]。已有国际预后指数(international prognostic index,IPI)、PTCL−非特异型(unspecified,PTCL-U)的预后指数(PIT)等多种指标作为治疗决策和预后的参考。本研究对大连医科大学附属第二医院近10年来的65例完整的PTCL病例进行了回顾性分析,从临床角度分析各种因素对预后的影响。
1 对象与方法
1.1 研究对象
回顾性分析2005年1月至2014年12月期间入住我院的65例PTCL患者,男性41例,女性24例,中位年龄为56岁,≤60岁37例,>60岁28例。按照WHO非霍奇金淋巴瘤(non-Hodgkin lymphoma,NHL)分类(2008年版)T细胞淋巴瘤分类,其中PTCL-U患者25例,血管免疫母细胞性T细胞淋巴瘤(angioimmunoblastic T-cell lymphoma,AITL)9例,结外自然杀伤(natural killer,NK)细胞/鼻型T细胞淋巴瘤(TCL)10例,间变性大细胞淋巴瘤(anaplastic large cell lymphoma,ALCL)9例[间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性5例、阴性2例、未检测2例],原发皮肤PTCL者2例,T淋巴母细胞瘤2例,毒性TCL 1例,不确定为AITL或PTCL-U 1例,未给出具体病理亚型的TCL共6例。
根据安娜堡(Ann Arbor)分期,Ⅰ/Ⅱ期29例,Ⅲ/Ⅳ期36例。其中,有B症状者38例。首发部位及症状:无痛性淋巴结肿大40例,鼻塞9例,扁桃体、腭部肿物5例,皮肤肿物、丘疹4例,胃肠道症状、腹部肿物5例,腰痛、脊椎肿物1例,脑部肿物1例。治疗前乳酸脱氢酶(lactate dehydrogenase,LDH)升高38例,血红蛋白(hemoglobin,Hb)降低24例,血清白蛋白(serum albumin,ALB)降低29例。血清β2微球蛋白(serum β2microglobulin,β2-MG)升高17例,正常或略降低30例,18例未检测。IPI低危组21例、低中危组10例、中高危组20例、高危组14例。PIT评分为0分、1分、2分及≥3分4组,分别有13例、10例、23例及12例,有7名患者未测骨髓,故未进行评分。仅接受化疗者37例,仅接受放疗者3例,接受放疗联合化疗者15例,接受综合治疗(手术治疗联合放疗和化疗)者10例。
1.2 随访
随访始于2005年1月,截止于2014年12月,共10年。总生存时间指确诊日期至死亡、最后随诊日期或截止观察日期。
1.3 统计学处理
应用SPSS20.0统计学软件进行统计学处理。采用Kaplan-Meier法绘制生存曲线,计算生存率,进行生存分析。用log-rank对单因素进行分析;用Cox回归对多因素进行分析。组间比较采用2检验。<0.05为差异有统计学意义。
2 结 果
2.1 单因素分析
在随访过程中死亡25例,后期失访10例,到截止日期仍存活30例。中位随访时间57个月。单因素分析表明:年龄、临床分期、IPI评分、LDH、ALB、首发部位与预后有关(<0.05),而性别,B症状,Hb、β2-MG水平,骨髓是否受侵与PTCL预后无关(>0.05;表1)。
2.2 治疗方式与预后
化疗37例,1、3、5年生存率分别为71.7%、35.9%、35.9%。放疗3例,1、3、5年生存率均为100.0%。联合放化疗15例,1、3、5年生存率分别为85.6%、73.3%、55.0%。手术治疗联合放化疗10例,1、3、5年生存率均为78.8%。不同的治疗方法对PTCL预后的影响,差异无统计学意义(>0.05)。
2.3 病理类型与预后
PTCL-U患者25例,1、3、5年生存率分别为58.1%、31.8%、31.8%;AITL患者9例,1、3、5年生存率分别为55.6%、37.3%、37.3%;结外鼻型TCL患者10例,1、3、5年生存率均为90.0%;ALCL患者9例,1、3、5年生存率均为87.5%。未给出具体病理亚型的PTCL共12例,其1、3、5年生存率分别为90.9%、72.7%、36.4%。不同的病理分型对PTCL预后的影响,差异具有统计学意义(=0.039)。
2.4 PIT评分与预后
PIT评分0分组13例,1、3、5年生存率均为92.3%,1分组10例,1、3、5年生存率均为85.7%,2分组23例,1、3、5年生存率分别为61.8%、34.8%、17.4%,≥3分组12例,1、3、5年生存率分别为38.1%、28.6%、0.0%。不同PIT评分对PTCL预后的影响,差异具有统计学意义(=0.002)。
2.5 多因素预后分析
在单因素基础上,对年龄、性别、Ann Arbor分期、IPI评分、B症状、LDH水平、ALB水平、首发部位、病理类型、PIT评分等预后因素进行Cox回归多因素预后分析。结果显示:PIT评分为PTCL的独立预后因素(Wald2=11.340,=0.011;图1)。
3 讨 论
国际T细胞淋巴瘤项目(International T-cell Lymphoma Project,ITLP)将1 153例PTCL和NK/TCL患者按照组织类型进行分类,其中最常见的类型是PTCL-U(25.9%)、AITL(18.5%)、NK/TCL(10.4%)及成人TCL白血病(9.6%)。根据5年生存率,预后较好的类型为ALCL及鼻型NK/TCL,预后较差的为PTCL-U、AITL和肠病型TCL等[4]。在本研究报道中,最常见的是PTCL-U(38.5%),结外NK/TCL约占15.4%,AITL约占13.8%,ALCL约占13.8%,其他类型少见,与ITLP报道略有差别。本研究结果显示,根据5年生存率,NK/TCL及ALCL预后明显好于PTCL-U及AITL,与ITLP报道相一致。
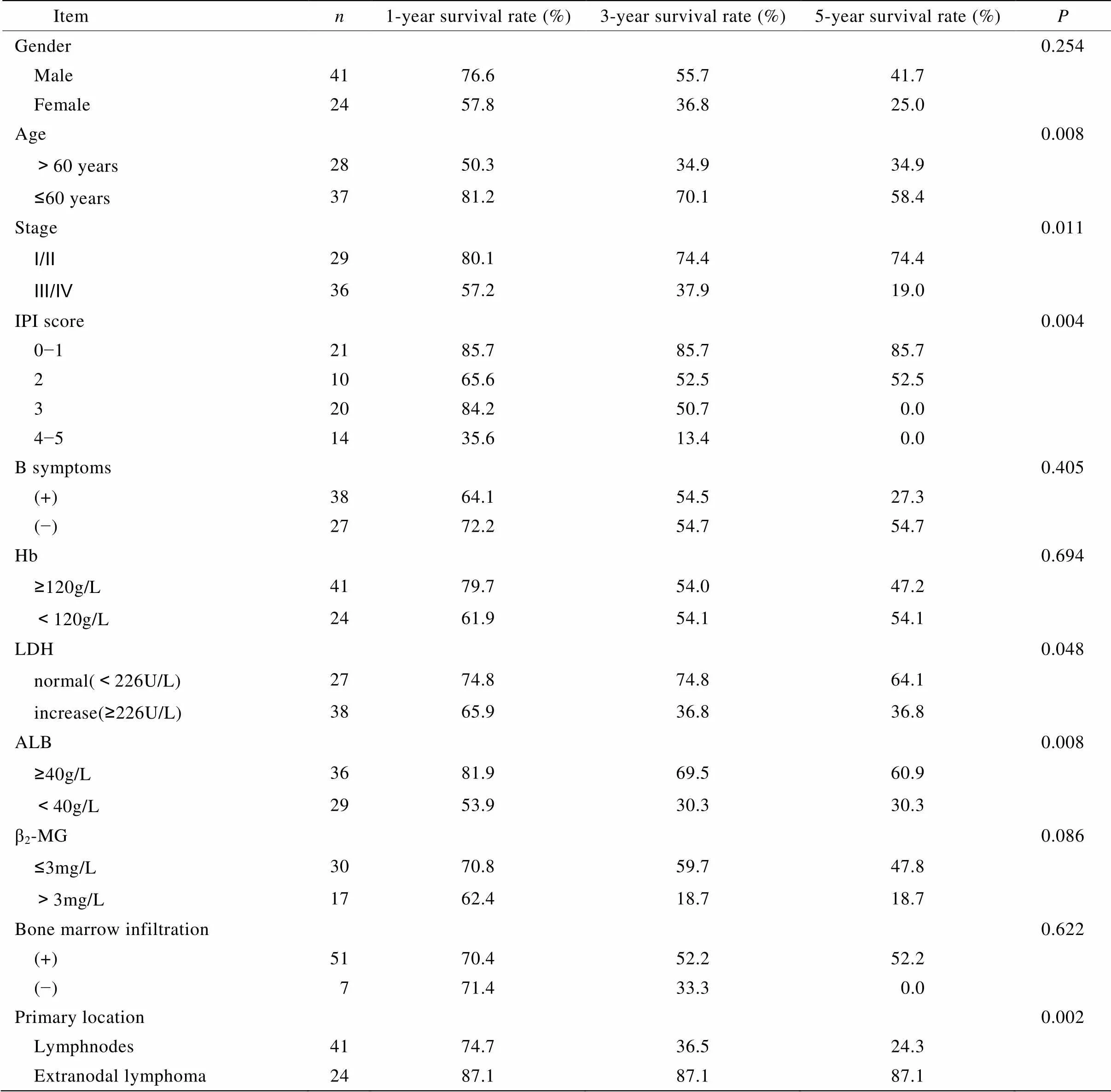
表1 各临床因素对预后的影响
IPI: intermational prognostic index; Hb: hemoglobin; LDH: lactate dehydrogenase; ALB: serum albumin; β2-MG: serum β2microglobulin
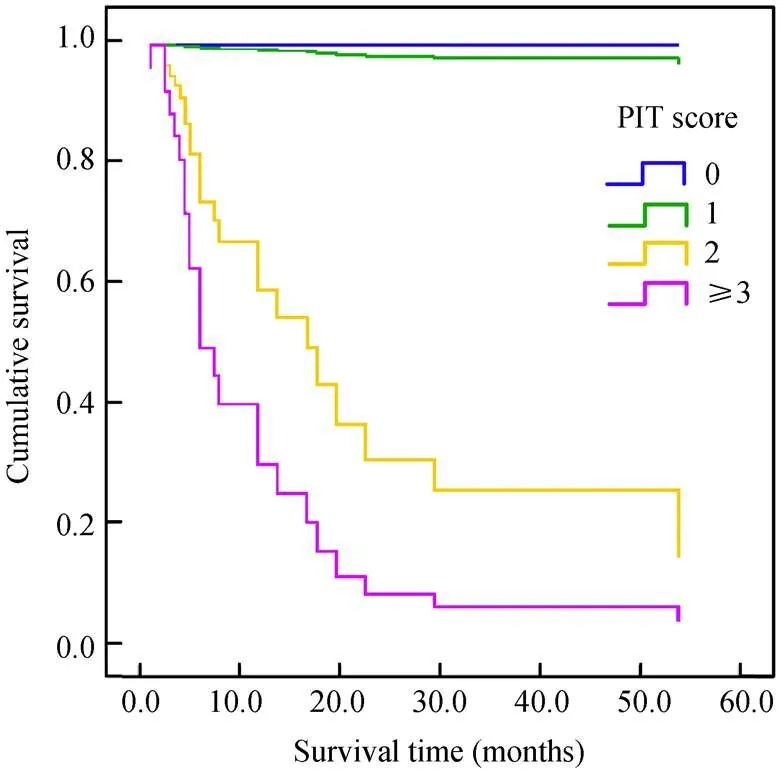
图1 Cox回归因素分析曲线
Figure 1 Cox regression factor analysis curve
PIT: prognostic index of peripheral T-cell lymphoma-unspecified
IPI是NHL十分重要并且常用的预后因素。研究者将年龄≥60岁,Ann Arbor分期为Ⅲ/Ⅳ期、PS评分≥2分、结外受累部位多位于一处、血清LDH水平升高这5项组成IPI评分。虽然IPI评分对预后关系密切,但会出现与PTCL的预后不一致的情况[5]。一部分研究显示在肠病型TCL和结外鼻腔NK/TCL等亚型中,虽然IPI评分较低,但是预后还是比较差。在本研究中发现,IPI评分越高,预后越差,这提示IPI评分对于判断预后仍然具有一定的意义。
Gallamini等[6]通过分析385例PTCL-U制定了PIT评分,根据4个风险因素(年龄、LDH、是否有骨髓侵犯及行为状态评分)分成0、1、2、≥3分4组,其5年生存率分别为62%,53%,33%和18%,并且考虑是独立的预后不良因素,建议利用PIT评分对预后进行评估。在本研究中,根据PIT评分将患者分成4组,相对应的中位生存期分别为98.0、83.0、32.7和16.5个月(<0.05)。并且在Cox多因素分析中显示PIT评分是独立预后因素。均可以证实PIT评分可以较好地提示患者的预后,也希望有越来越多的临床分析对PIT评分进行评价。
血清LDH值可反映NHL的肿瘤负荷和免疫监视系统识别肿瘤的能力,其高低往往反映了肿瘤的增殖活性[7],所以在临床中LDH值对肿瘤的诊断及预后有重要的价值。Yang等[8]发现LDH与有无B症状、分期早晚以及有无骨髓侵犯有关。在本研究中LDH水平升高的患者预后明显比正常的患者差,与大部分研究结果一致。
最近有研究表明白蛋白降低与PTCL-U患者的生存率相关[9]。其机制尚不明确,有文献指出ALB降低可能是由于细胞因子IL-6,它能调节肝细胞产生ALB;大量肿瘤细胞增殖与宿主竞争营养物质,导致ALB下降。ALB被认为是营养状态的指标,可受肿瘤患者异常代谢状态的影响,也可能由于机体对抗肿瘤引起的全身炎症反应,而在疾病晚期时营养不良和炎症会抑制ALB合成[10]。在本研究中也证明ALB低下的患者预后差,监测ALB水平对于判断预后有一定的意义。
在2014年美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中,很多PTCL患者推荐参与临床试验进行积极治疗,在缺少合适的临床试验情况下,多数PTCL亚型推荐Ⅰ/Ⅱ期低危患者行多药联合化疗加上局部辅助放疗,Ⅰ/Ⅱ期高危患者和Ⅲ/Ⅳ期患者行多药联合化疗加或不加放疗,多药联合化疗方案包括CHOEP(依托泊苷+环磷酰胺+多柔比星+长春新碱+泼尼松)、CHOP(环磷酰胺+多柔比星+长春新碱+泼尼松)、EPOCH(依托泊苷+泼尼松+长春新碱+环磷酰胺+多柔比星)联合利妥昔单抗(DA-EPOCH-R)或者hyper-CVAD(大剂量环磷酰胺+长春新碱+地塞米松+多柔比星)。
针对NK/TCL,含培门冬酶的方案,如SMILE(行大剂量泼尼松+培门冬酶+异环磷酰胺+依托泊苷+甲氨蝶呤)、P-Gemox(培门冬酶+吉西他滨+奥沙利铂)对其有独特的疗效。在一项二期研究中发现[11],ⅠE/ⅡE患者在放疗后序贯P-Gemox方案治疗,总有效率(overall response rate,ORR)为96%,2年总生存率(overall survival,OS)和无进展生存期(progression free survival,PFS)均为86%。一些研究表明沙利度胺抗CD52单抗、喷司他丁等在药物临床上也取得一定疗效[12−14]。
最近越来越多的研究证实自体干细胞移植(autologous stem cell transplantation,ASCT)可以改善PTCL患者的完全缓解及预后,而移植前完全缓解的时间是一个重要的预后因素[15]。对化疗不敏感及复发的TCL,ACST是一种重要的治疗方式。
本研究为回顾性单中心研究,病例数少,且患者分布在不同的时期。10年期间,很多因素会影响研究结果,如临床理化检查、治疗手段等。随着科技的进步及临床诊疗水平的不断提高,在不同的时间段患者的临床资料会有很大差别。所以,仍需要进一步扩大病例数、缩短研究时间跨度等行进一步研究。因本研究尚有局限性,数据仅供参考。
[1] Armitage JO, Vose JM, Linder J,. Clinical significance of immunophenotype in diffuse aggressive non-Hodgkins lymphoma[J]. J Clin Oncol, 1989, 7(12): 1783−1790.
[2] Grogan TM, Fielder K, Rangel C,. Peripheral T-cell lymphoma: aggressive disease with heterogeneous immunotypes[J]. Am J Clin Pathol, 1985, 83(3): 279−288.
[3] Coiffier B, Brousse N, Peuchmaur M,. Peripheral T cell lymphomas have a worse prognosis than B-cell lymphomas: a prospective study of 361 immunophenotyped patients treated with the LNH-84 regimen[J]. Ann Oncol, 1990, 1(1): 45−50.
[4] International T Cell Lymphoma Project. International Peripheral T Cell and Natural Killer/T Cell Lymphoma Study: pathology findings and clinical outcomes[J]. Am J Clin Oncol, 2008, 26(25): 4124−4130.
[5] Demierre MF, Kim YH, Zackheim HS. Prognosis, clinical outcomes and quality of life issues in cutaneous T-cell lymphoma[J]. Hematol Oncol Clin North Am, 2003, 17(6): 1485.
[6] Gallamini A, Stelitano C, Calvi R,. Peripheral T-cell lymphoma unspecified (PTCL-U): a new prognostic model from a retrospective multicentric clinical study[J]. Blood, 2004, 103: 2474−2479.
[7] Benbobker L, Valat C, Linassier C,. A new serologic index for low-grade non-Hodgkin’s lymphoma based on initial CA 125 and LDH serum levels[J]. Ann Oncol, 2000, 11(11): 1485.
[8] Yang L, Xu XH, Peng CL,. Prognostic values of serum LDH and β2-MG in patients with non-Hodgkin’s lymphoma[J]. Chin-German J Clin Oncol, 2009, 8(6), 353−355.
[9] Chihara D, Oki Y, Ine S,. Analysis of prognostic factors in peripheral T-cell lymphoma: prognostic value of serum albumin and mediastinal lymphadcnopathy[J]. Leuk Lymphoma, 2009, 50(12): 1999−2004.
[10] Gupta D, Lis CG. Pretreatment serum albumin as a predictor of cancer survival: a systematic review of the epidemiological literature[J]. Chin J Cancer, 2010, 29(8): 735−740.
[11] Wang L, Wang ZH, Chen XQ,. First-line combination of gemcitabine, oxaliplatin, and L-asparaginase(GELOX) followed by involved-field radiation therapy for patients with stageⅠE/ⅡE extranodal natural killer/T-cell lymphoma[J]. Cancer, 2013, 119: 348−355.
[12] Ramasamy K, Lim Z, Pagliuca A,. Successful treatment of refractory angioimmunoblastic T-cell lymphoma with thalidomide and dexamethasone[J]. Haematologica, 2006, 91(8 Suppl): ECR44.
[13] Enblad G, Hagberg H, Erlanson M,. A pilot study of alemtuzumab (anti-CD52 monoclonal antibody) therapy for patients with relapsed or chemotherapy refractory peripheral T-cell lymphomas[J]. Blood, 2004, 103(8): 2920−2924.
[14] Dang NH, Hagemeister FB, Duvic M,. Pentostatin in T non-Hodgkin’s lymphomas: efficacy and effect on CD26+T lymphocytes[J]. Oncol Rep, 2003, 10(5): 1513−1518.
[15] Corradini P, Tarella C, Zallio F,. Long-term follow-up of patients with peripheral T-cell lymphomas treated up-front with high-dose chemotherapy followed by autologous stem cell transplantation[J]. Leukemia, 2006, 20(9): 1533−1538.
(编辑: 刘子琪)
Prognostic factors of peripheral T cell lymphoma: analysis based on 65 cases
HE HONG-Mei, CHENG Ye, SUN Xiu-Hua*, ZHANG Xian, XU Li-Ye, DING Xiao-Lei
(The Fourth Department of Oncology, the Second Affiliated Hospital of Dalian Medical University, Dalian 116027, China)
To determine the effects of relative factors of peripheral T cell lymphoma (PTCL) on the prognosis based on clinical data in order to provide references for monitoring clinical condition and predicting prognosis of the disease.Clinical data of 76 PTCL patients were enrolled firstly, but 11 patients were lost to follow-up. So a total of 65 cases with complete medical records admitted in our department from January 2005 to December 2014 were finally enrolled and retrospectively analyzed. Kaplan-Meier analysis was used. Univariate analysis was employed to analyze age, gender, clinical stage, international prognostic index (IPI), B symptoms, hemoglobin (Hb), serum β2microglobulin (β2-MG), lactate dehydrogenase (LDH), serum albumin (ALB). treatment protocol, pathological classification, primary site, prognostic index (PIT) for PTCL-unspecified (PTCL-U), and bone marrow infiltration. And then, Cox regression model was carried out to perform multivariate analysis on those statistically significant parameters from univariate analysis.Among the cohort of 65 patients, 25 of them suffered from PTCL-U, 10 from extranodal natural killer cell (NK)/T lymphocytes-nasal type, 9 from angioimmunoblastic T-cell lymphoma (AITL), and 9 from anaplastic large cell lymphoma (ALCL). Univariate analysis showed that patients older than 60 years had a poor prognosis than those younger (=0.008). The 5-year survival rate was significantly higher in the patients at Ann Arbor stageⅠ/Ⅱthan those at Ⅲ/Ⅳ(74.4%19.0%,=0.011). The 5-year survival rate was 85.7%, 52.5%, 0.0% and 0.0%, respectively for the patients with IPI score as low, low-medium, high-medium, and high risk (=0.004). The patients with elevated LDH at diagnosis had poorer prognosis than those with normal or reduced values (=0.048), so did the patients with lower ALB than those with normal ALB (=0.008). The patients with extranodal lymphoma as primary site had better prognosis than those with intranodal. The 5-year survival rate was 92.3%, 85.7%, 17.4% and 0.0%, respectively for the patients with PIT score of 0, 1, 2 and ≥3 (=0.002). Multivariate analysis indicated that PIT score was an independent prognostic factor for PTCL (=0.002).Age, clinical stage, IPI score, LDH, ALB, pathological classification, primary site and PIT index are prognostic factors, and PIT score is an independent prognostic factor for PTCL.
peripheral T cell lymphoma; prognosis
(2014E21SF001).
R733.4
A
10.11915/j.issn.1671-5403.2015.10.176
2015−07−28;
2015−08−22
大连市科技计划项目(2014E21SF001)
孙秀华,E-mail: 3038668@vip.sina.com
