老年2型糖尿病住院患者甲状腺功能异常及其影响因素的临床分析
2015-04-23朱海清陈晓平邢小燕
王 娜,卜 石,朱海清,陈晓平,邢小燕
老年2型糖尿病住院患者甲状腺功能异常及其影响因素的临床分析
王 娜,卜 石,朱海清,陈晓平,邢小燕*
(中日友好医院内分泌科,北京 100029)
观察和分析老年2型糖尿病(T2DM)住院患者甲状腺功能异常及其影响因素。对2014年10月至2015年5月在中日友好医院内分泌科住院的190例既往无甲状腺病史、年龄≥60岁的老年T2DM患者的甲状腺功能状况和相关临床指标进行调查和分析。(1)在190例患者中,甲状腺功能异常比例为38.4%(73例),其中低T3综合征为22.1%(42例),原发性甲状腺功能减退症(甲减)为15.8%(30例)。(2)3组人群相比较,低T3综合征组糖化血红蛋白(HbAlc)明显高于其他两组,年龄、病程大于甲状腺功能正常组;甲减组甲状腺过氧化物酶抗体(TPOAb)和(或)甲状腺球蛋白抗体(TGAb)阳性率为最高,达到70%(均<0.05)。(3)3组血清25羟维生素D(25-OH-vit D)水平均处于缺乏状态。(4)logistic回归分析显示年龄与低T3综合征发生呈正相关(OR=2.77,=0.012);TPOAb(OR=4.13,=0.026)、TGAb(OR=3.57,=0.026)与甲减发生呈正相关。老年T2DM住院患者甲状腺功能异常发生率较高,存在自身免疫因素易发生甲减;高龄患者更易发生低T3综合征;未看到维生素D缺乏在各组患者中的差异。
老年人;糖尿病,2型;甲状腺功能;低T3综合征
2型糖尿病(type 2 diabetes mellitus,T2DM)和甲状腺疾病均是内分泌科常见疾病,对患者的健康威胁极大。目前国内外多项研究结果显示,在T2DM患者中甲状腺功能异常发生率明显升高,包括原发性甲状腺功能减退症(甲减)、甲状腺功能亢进症(甲亢)、低T3综合征、低T3合并低T4综合征等,临床诊断和鉴别十分重要[1−4]。在T2DM患者中25羟维生素D(25 hydroxy vitamin D,25-OH-vit D)缺乏也较为普遍,近年来研究发现,人体内30多种组织(包括胰岛β细胞)中均表达维生素D受体,25-OH-vit D被认为是调节其他器官例如心血管系统、免疫系统、内分泌系统的最佳调节因子[5]。而甲状腺疾病也存在一定的免疫背景,因此关于血清25-OH-vit D水平和甲状腺功能的关系也是最近研究的热点。本研究对190例年龄≥60岁老年T2DM住院患者的甲状腺功能状况及其相关临床资料进行分析,以探讨上述问题。
1 对象与方法
1.1 研究对象
选取2014年10月至2015年5月在中日友好医院内分泌科因血糖控制欠佳住院治疗年龄≥60岁的T2DM患者190例,其中男性100例,女性90例,年龄(68.28±6.51)岁,病程(14.64±8.33)年。根据甲状腺功能异常发生情况,将研究对象分为甲状腺功能正常组、甲减组和低T3综合征组。排除1型糖尿病、既往明确甲状腺疾病、严重心肝肾功能异常、明确胃肠疾病史、感染、正在服用钙剂和维生素D制剂的患者等。
1.2 诊断标准
1.2.1 糖尿病诊断 糖尿病符合1999年世界卫生组织的糖尿病诊断标准。
1.2.2 甲状腺功能异常诊断[6]我院甲状腺功能正常值:促甲状腺激素(thyroid stimulating hormone,TSH):0.27~4.20μIU/ml,总T3(total T3,TT3):0.8~2.0ng/ml,游离T3(free T3,FT3):2.0~4.4ng/L,总T4(total T4,TT4):5.1~14.1μg/dl,游离T4(free T4,FT4):0.93~1.7ng/dl。临床甲减和亚临床甲减、甲亢、低T3综合征诊断均符合2007年中国甲状腺疾病诊治指南的诊断标准。
1.2.3 维生素D缺乏 以血清25-OH-vit D水平为25~50nmol/L定义为维生素D缺乏[7]。
1.2.4 甲状腺过氧化物酶抗体和甲状腺球蛋白抗体阳性 以甲状腺微粒体抗体(thyroid peroxidase antibody,TPOAb)和甲状腺球蛋白抗体(thyroglobulin antibody,TGAb)高于我院检验正常值范围(0~30IU/ml)定义为阳性。
1.3 临床资料收集
记录患者的年龄、性别、病程,并根据身高和体质量计算体质量指数(body mass index,BMI)。前1天20∶00禁食至第2日清晨6∶00,空腹抽取静脉血,进行糖化血红蛋白(glycosylated hemoglobin,HbA1c)、总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、血清25-OH-vit D、TPOAb、TGAb及甲状腺激素等检测。
1.4 检测方法及仪器
由专门实验室使用同一仪器及试剂测定相关指标。HbA1c采用高压液相方法测定(伯乐VATIANT Ⅱ糖化血红蛋白分析仪)。甲状腺激素和TPOAb、TGAb采用电化学发光测定(罗氏E601电化学发光免疫分析仪)。血脂各项采用酶法测定(全自动生化分析仪)。血清25-OH-vit D采用ELISA方法测定(伯乐iMark酶标仪)。
1.5 统计学处理
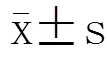
2 结 果
2.1 不同甲状腺功能分布状况
在190例患者中,甲状腺功能正常比例为61.6%(117例);甲状腺功能异常比例为38.4%(73例),其中低T3综合征为22.1%(42例),甲减为15.8%[亚临床甲减为70.0%(21例)、临床甲减为30.0%(9例),共30例],甲亢患者仅1例(因例数太少未纳入统计分析)。
2.2 不同甲状腺功能分组的临床资料比较
表1结果表明,3组间比较,HbA1c在甲减组、甲状腺功能正常组、低T3综合征组依次升高;TPOAb、TGAb水平及阳性率在甲减组明显高于其他两组;低T3综合征组年龄、病程、TC明显高于甲状腺功能正常组;上述差异均有统计学意义(<0.05)。此外,除甲减组TSH高于正常值范围及低T3综合征组TT3低于正常值范围外,其余甲状腺激素变化均在正常值范围波动。3组间比较,血清25-OH-vit D水平差异无统计学意义(>0.05)。
2.3 甲状腺功能异常的相关影响因素分析
模型1:以是否甲减(甲减=0,非甲减=1)为因变量,以年龄、性别、病程、HbA1c、血清25-OH-vit D、TPOAb、TGAb为自变量进行logistic回归分析。结果显示,TPOAb(OR=4.13,=0.026)、TGAb(OR=3.57,=0.026)与甲减发生呈正相关。
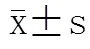
表1 不同甲状腺功能分组的临床资料比较
BMI: body mass index; HbA1c: glycosylated hemoglobin; TC: total cholesterol; TG: triglycerides; HDL-C: high density lipoprotein cholesterol; LDL-C: low density lipoprotein cholesterol; 25-OH-vit D: 25 hydroxy vitamin D; TGAb: thyroglobulin antibody; TPOAb: thyroid peroxidase antibody. Compared with euthyroid group,*<0.05; compared with hypothyroidism group,#<0.05
模型2:以是否低T3综合征(低T3综合征=0,非低T3综合征=1)为因变量,以年龄、性别、病程、HbA1c、血清25-OH-vit D、TPOAb、TGAb为自变量进行logistic回归分析。结果显示,年龄与低T3综合征发生呈正相关(OR=2.77,=0.012)。
3 讨 论
糖尿病是一种对人体健康危害极大的慢性代谢性疾病,其各脏器的功能都会受到不同程度的影响,包括甲状腺功能异常[2−4,8]。张宏等[3]报道在120例平均年龄59岁、平均病程9.42年、既往无甲状腺病史的住院T2DM患者中,甲状腺功能异常者占40%,其中甲亢为16.67%,甲减为23.33%。高谷等[4]回顾性分析420例平均年龄60岁、平均病程6.79年的住院T2DM患者的临床资料,发现甲状腺功能异常者占15.71%,其中甲亢为3.57%,甲减为8.10%,低T3综合征为4.05%。本组人群既往无甲状腺病史,平均年龄68岁,平均病程14.64年,研究结果显示甲状腺功能异常者占38.5%,其中低T3综合征比例最高,为22.1%;其次为甲减(包括亚临床和临床甲减)15.8%;甲亢患者仅有1例。可见甲状腺功能异常发生状况的结果并不一致,可能受到年龄、病程,甚至不同地区、不同碘摄入以及不同甲状腺疾病遗传背景的影响,值得今后进一步探讨。但上述研究均证实了T2DM患者是甲状腺功能异常的易患人群,其表现形式多种多样。在糖尿病患者中应常规筛查甲状腺功能,并给予相应处置。
由于低T3综合征和甲减是截然不同的两种病理生理状态,治疗及预后均不同,因此对二者的临床鉴别尤为重要,本研究对两组人群的临床特征做了重点分析。低T3综合征又称为甲状腺功能正常病态综合征(euthyroid sick syndrome,ESS)、非甲状腺疾病综合征(nonthyroid illness syndrome,NTIS),其并非是甲状腺本身病变,而是由于严重疾病、饥饿状态导致的循环甲状腺激素水平的降低,其机制为上述病因影响了肝脏对5−脱碘酶合成与分泌,导致T4转化成T3减少,反T3(reverse triiodothyronine,rT3)升高,是机体的一种保护性反应,不需要特殊治疗,甲状腺功能可以随着病情缓解而恢复正常[6,9,10]。本研究结果显示,低T3综合征患者HbA1c明显高于其他两组患者,同时年龄、病程明显大于甲状腺功能正常患者,多因素分析也证实年龄与低T3综合征发生呈正相关,提示高龄、长病程、高血糖患者易发生低T3综合征,在临床上应给予高度重视。
原发性甲减的病因包括自身免疫、甲状腺手术或甲亢放射性碘治疗等,由于甲状腺激素合成和分泌减少,往往需要甲状腺激素替代治疗[6]。在本研究中,甲减患者既往无甲状腺病史,其TPOAb、TGAb水平明显高于其他两组人群,TPOAb和(或)TGAb阳性率达到70%,多因素分析显示TPOAb、TGAb水平与甲减发生呈正相关,提示存在着自身免疫因素。由于本组人群亚临床甲减发生率明显超过临床甲减发生率(70%30%),甲状腺功能测定仅见TSH升高,TT4、TT3、FT4、FT3均为正常,但仍然可以很好地与低T3综合征患者鉴别,前者TSH水平明显升高,后者TSH正常、TT3降低。另外,高滴度TPOAb及TGAb水平也有助于甲减的诊断[11,12]。
25-OH-vit D作为一种免疫调节剂,可能影响自身免疫性甲状腺疾病[13]。Chailurkit等[14]在2 582例成人研究中发现,血清25-OH-vit D水平与低TSH独立相关。Barchetta等[15]分析了294例甲状腺功能正常的成人资料,在校正了性别、年龄、季节等因素影响后,发现血清25-OH-vit D水平越低,TSH水平越高。刘佳等[16]在北京地区180例T2DM患者研究中发现血清25-OH-vit D水平与TSH水平呈负相关,提示T2DM患者的维生素D水平与甲状腺功能状态相关。本研究结果显示,3组人群血清25-OH-vit D水平均处在缺乏状态,组间比较差异无统计学意义(>0.05),多因素分析也未见到血清25-OH-vit D水平与低T3综合征及甲减发生的相关性,这与上述研究结果不一致,提示T2DM患者本身易伴发维生素D缺乏。
综上所述,住院老年T2DM患者甲状腺功能异常发生率较高,并普遍存在维生素D缺乏,提示在此类人群中应积极筛查甲状腺功能及监测血清25-OH-vit D水平。另外,应注意低T3综合征和甲减的临床鉴别,以避免由于错误的甲状腺激素替代治疗导致疾病恶化。
[1] Vikhe VB, Kanitkar SA, Tamakuwala KK,. Thyroid dysfunction in patients with type 2 diabetes mellitus at tertiary care centre[J]. Natl J Med Res, 2013, 3(4): 377−380.
[2] Díez JJ, Sánchez P, Iglesias P. Prevalence of thyroid dysfunction in patients with type 2 diabetes[J]. Exp Clin Endocrinol Diabetes, 2011, 119(4): 201−207.
[3] Zhang H, Fang PH, Zheng N,. Analysis of the thyroid function of the in-patients with type 2 diabetes mellitus[J]. J Int Endorinol Metab, 2007, 27(2): 139−141. [张 宏, 方佩华, 郑 凝, 等. 住院2型糖尿病患者甲状腺功能状态的分析[J]. 国际内分泌代谢杂志, 2007, 27(2): 139−141.]
[4] Gao G, Xia SG, Yu XD,. Clinical analysis of type 2 diabetes mellitus patients with thyroid dysfunction[J]. Chin J Diabetes, 2014, 22(6): 507−510. [高 谷, 夏斯桂, 郁新迪, 等. 2型糖尿病合并甲状腺功能异常的临床分析[J]. 中国糖尿病杂志, 2014, 22(6): 507−510]
[5] Holick MF. Vitamin D deficiency[J]. N Engl J Med, 2007, 357(3): 266−281.
[6] Writing Group for Thyroid Disease Diagnosis and Treatment Guidelines, Endocrinology Society, Chinese Medical Association. Thyroid Disease Diagnosis and Treatment Guidelines—Hypothyroidism[J]. Chin J Intern Med, 2007, 46(11): 967−971. [中华医学会内分泌学分会《中国甲状腺疾病诊治指南》编写组. 甲状腺疾病诊治指南——甲状腺功能减退症[J]. 中华内科杂志, 2007, 46(11): 967−971.]
[7] Holick MF, Binkley NC, Bischoff-Ferrari HA,. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline[J]. J Clin Endocrinol Metab, 2011, 96(7): 1911−1930.
[8] Palma CC, Pavesi M, Nogueira VG,. Prevalence of thyroid dysfunction in patients with diabetes mellitus[J]. Diabetol Metab Syndr, 2013, 5(1): 58.
[9] Warner MH, Beckett GJ. Mechanisms behind the non-thyroidal illness syndrome: an update[J]. J Endocrinol, 2010, 205(1): 1−13.
[10] De Vries EM, Fliers E, Boelen A. The molecular basis of the non-thyroidal illness syndrome[J]. J Endocrinol, 2015, 225(3): R67−R81.
[11] Gerenova JB, Manolova IM, TzonevaⅥ. Clinical significance of autoantibodies to parietal cells in patients with autoimmune thyroid diseases[J]. Folia Med(Plovdiv), 2013, 55(2): 26−32.
[12] Aliesky H, Courtney CL, Rapoport B,. Thyroid autoantibodies are rare in nonhuman great apes and hypothyroidism cannot be attributed to thyroid autoimmunity[J]. Endocrinology, 2013, 154(12): 4896−4907.
[13] Tamer G, Arik S, Tamer I,. Relative vitamin D insufficiency in Hashimoto’s thyroiditis[J]. Thyroid, 2011, 21(8): 891−896.
[14] Chailurkit LO, Aekplakorn W, Ongphiphadhanakul B. High vitamin D status in younger individuals is associated with low circulating thyrotropin[J]. Thyroid, 2013, 23(1): 25−30.
[15] Barchetta I, Baroni MG, Leonetti F,. TSH levels are associated with vitamin D status and seasonality in an adult population of euthyroid adults[J]. Clin Exp Med, 2015, 15(3): 389−396.
[16] Liu J, Xu Y, Ning ZW,. Relationship between thyroid function and serum vitamin D levels in type 2 diabetic patients[J]. Chin J Endocrinol Metab, 2015, 31(3): 245−248. [刘 佳, 徐 援, 宁志伟, 等. 2型糖尿病患者血清维生素D水平与甲状腺功能的关系研究[J]. 中华内分泌代谢杂志, 2015, 31(3): 245−248.]
(编辑: 周宇红)
Thyroid dysfunction and influencing factors in elderly hospitalized patients with type 2 diabetes mellitus
WANG Na, BU Shi, ZHU Hai-Qing, CHEN Xiao-Ping, XING Xiao-Yan*
(Department of Endocrinology, China-Japan Friendship Hospital, Beijing 100029, China)
To observe the incidence of thyroid dysfunction in the elderly patients with type 2 diabetes mellitus (T2DM) and investigate the influencing factors.A total of 190 T2DM patients (over 60 years old) without history of thyroid diseases hospitalized in our department from October 2014 to May 2015 were enrolled in this study. Their clinical and pathological data were retrospectively reviewed and analyzed.(1) The incidence of thyroid dysfunction was 38.4% (73/190), including 22.1% (42 cases) of low T3 syndrome and 15.8% (30 cases) of idiopathic hypothyroidism. (2) The patients with low T3 syndrome had higher level of HbA1c, older age and longer T2DM duration when compared to idiopathic hypothyroidism group and those without thyroid dysfunction (<0.05). The positive percentages of thyroglobulin antibody (TGAb) and/or thyroid peroxidase antibody (TPOAb) were obviously higher (70%) in hypothyroidism group (<0.05). (3) The 25-hydroxy vitamin D (25-OH-vit D) level was deficient among the 3 groups. (4) Logistic regression analysis showed that age was positively correlated with the incidence of low T3 syndrome (OR=2.77,=0.012), and the levels of TGAb (OR=3.57,=0.026) and TPOAb (OR=4.13,=0.026) were respectively correlated with hypothyroidism.Thyroid dysfunction is quite common in the elderly with T2DM, and their autoimmune background may induce hypothyroidism. Elderly patients are more likely to suffer from low T3 syndrome. But there is no difference in vitamin D deficiency among those without thyroid dysfunction, hypothyroidism and low T3 syndrome.
aged; diabetes mellitus, type 2; thyroid function; low T3 syndrome
R592; R581
A
10.11915/j.issn.1671-5403.2015.10.170
2015−08−18;
2015−09−02
邢小燕, E-mail: Xingxy221@126.com
