成年大鼠局灶脑缺血/再灌注后海马BDNFmRNA 和bFGF mRNA的动态变化研究
2015-04-21黄艳君张中念曹飞虎宋晓灵张弟文
黄艳君 罗 勇 张中念 曹飞虎 董 明 宋晓灵 张弟文
成年大鼠局灶脑缺血/再灌注后海马BDNFmRNA 和bFGF mRNA的动态变化研究
黄艳君罗勇张中念曹飞虎董明宋晓灵张弟文
【摘要】目的观察局灶脑缺血/再灌注大鼠海马脑源性神经营养因子(brain derived neurotrophic factor,BDNF) mRNA和碱性成纤维生长因子(basic fibroblast growth factor,bFGF ) mRNA的动态表达。方法将108只雄性Wistar大鼠随机分为正常组(NC组)、假手术组(SC组)、模型组(I/R组),每组再于缺血1h后再灌注于1,3,7,14,21,28d六个时间点进行观察,正常组和假手术组于相应时间点同步观察。采用线栓法制备大鼠右侧大脑中动脉局灶脑缺血/再灌注模型。应用原位杂交法检测大鼠缺血再灌注后1,3,7,14,21,28d缺血侧海马BDNF mRNA和bFGF mRNA表达。结果正常海马区可见少量BDNF mRNA和bFGF mRNA的阳性表达。BDNF mRNA阳性反应主要集中于齿状回颗粒细胞以及CA2、CA3中的锥体细胞胞浆中,bFGF mRNA主要位于海马锥体细胞层、CA1、CA2区。局灶脑缺血/再灌注后,I/R组缺血侧海马BDNF mRNA表达增加,主要见于齿状回颗粒细胞层和锥体细胞层。缺血/再灌注后1d时BDNF mRNA阳性反应即有增多,3d时达到高峰(P<0.01),阳性产物染色较深,7d后迅速下降(P<0.01),28d时接近正常水平。局灶脑缺血/再灌注后,I/R组缺血侧海马可见bFGF mRNA的强阳性表达,1d时开始增加(P<0.05),3d即达一小高峰(P<0.01),7d开始下降,21d时明显下降,28d时降到正常水平(P<0.05)。结论局灶脑缺血/再灌注可上调BDNF mRNA和bFGF mRNA的表达,有利于脑缺血后神经功能恢复,具有神经保护作用。
【关键词】局灶脑缺血/再灌注; BDNFmRNA; bFGF mRNA;海马;大鼠
作者单位:621000绵阳市第三人民医院(黄艳君,张中念,曹飞虎,董明,宋晓灵,张弟文),重庆医科大学附属第一医院神经内科(罗勇) ;重庆市神经病学重点实验室(罗勇)
在脑缺血的恢复过程中,神经细胞的再生和细胞间突触联系的重建或重组是关键,而脑内神经营养因子与中枢神经系统的恢复密切相关,对神经再生、神经元迁移、轴突的发芽、延长和成束以及正确神经环路的形成起着重要作用。本研究观察了局灶脑缺血/再灌注大鼠脑内海马区域BDNF mRNA和bFGF mRNA的动态变化,以探讨受损脑组织的自我修复机制,为通过“非药物”手段调控某些化学信号因子提供理论基础,为缺血性脑血管疾病的防治开辟新的途径,以期为临床的进一步研究和应用提供客观实验依据。
1 材料和方法
1.1材料
1.1.1实验动物选取健康雄性Wistar大鼠108只,清洁级,8周龄,体质量250~300g,由重庆医科大学实验动物中心提供。大鼠术前12h禁食不禁水。实验组:大鼠随机分为正常组(NC组)、假手术组(SC组)、模型组(I/R组),每组根据再灌注时间的不同又分为1,3,7,14,21,28d 6个时间点进行观察(n=6)。均于缺血后1h行再灌注,假手术组(SC 组)分离颈外动脉并结扎远端,线栓插入颈内动脉但不栓塞大脑中动脉。正常组不造模。
1.1.2试剂针对大鼠BDNF靶基因的mRNA序列的寡核甘酸探针:5'-CTTAC TATGG TTATT TCATA CTTTG GTTGC-3'; 5'-GCTGA GCGTG TGTGA CAGTA TTAGT GAGTG-3'; 5'-ACACT TCTTG TGTAT GTACA TTGAC CATTA-3'。针对大鼠bFGF靶基因的mRNA序列的寡核甘酸探针: 5'-GGCTT CTTCC TGCGC ATCCA CCCCG ACGGC-3';5'-AGCAG AAGAG AGAGG AGTTG TGTCT ATCAA-3'; 5'-TGGAA TCTAA TAACT ACAAT ACTTA CCGGT-3'。(探针由武汉博士德生物技术有限公司设计合成并用地高辛标记)。原位杂交试剂盒和原位杂交专用盖玻片(武汉博士德),DAB显色剂(北京中山) ; DEPC和Poly-L-Lysine(Sigma(USA) )。
1.2方法
1.2.1模型制作根据Longa等[1]报道的方法,参照罗勇等[2]的经验,采用线栓法制备右侧大脑中动脉局灶脑缺血/再灌注模型(middle cerebral artery occlusion,MCAO) ;栓塞成功的大鼠缺血1h,再次麻醉,拔出线栓至颈外动脉残端内,实现再灌注。模型成功标准:左侧肢体疼痛回缩迟钝或消失,提尾倒悬时左上肢向胸前屈曲,行走时向左侧倾倒或向左转圈;右侧出现霍纳(Honer's)氏征。排除标准:神经学症状评分低于2分者(评分标准参照1.2.4神经症状学评分),蛛网膜下腔出血者,HE染色无缺血病理改变者,未到观察时相点死亡者。凡因上述因素导致各实验组动物数不足预定数量者采用随机抽样原则补齐。
1.2.2TTC染色TTC是脂溶性光敏感的复合物,与活细胞线粒体内脱氢酶反应生成深红色脂溶性物质,死亡细胞由于线粒体脱氢酶失活而不显色,即TTC染色正常组织产生红色,而缺血组织呈苍白色。其主要步骤是:大鼠MCAO1h再灌注24h后断头取脑,-20℃下10min,连续冠状切片(片厚约2mm)。脑片置于2% TTC (PH7.2) 37℃孵育30min,0.1 MPBS溶液冲洗2-3次,并拍照。
1.2.3HE染色石蜡切片常规脱蜡至水;苏木素染色:切片置苏木素染液5min,洗去多余的染料;分色和返蓝:切片先后入盐酸酒精和氨水溶液中至细胞核变蓝;伊红复染:将返蓝的切片充分水洗,1%伊红水溶液中5min;梯度酒精脱水、封片。
1.2.4神经功能评分参照Zea Longa 5分制评分标准[1],大鼠清醒后评分: 0分,无神经功能缺失症状;1分,轻度局灶性神经功能缺失(不能完全伸展左侧前肢) ;2分,中度局灶性神经功能缺失(向左侧转圈) ;3分,中度局灶性神经功能缺失(向左侧倾倒) ;4分,不能自发行走,意识水平降低。所有动物于脑缺血/再灌注后1,6,12h,1,3,7d进行评定。分值越高,说明动物行为障碍越严重。
1.2.5固定、取材、切片于脑缺血再灌注后1,3,7,14,21,28d,经左心室常规灌注固定,开颅取脑,由前向后作冠状切片,取经海马脑组织块各1块,行固定、脱水、浸蜡、包埋、石蜡切片(片厚4μm)。取材部位:海马(A-P坐标,bregma-4.5至bregma-3.14mm)。
1.2.6原位杂交检测海马bFGF mRNA、BDNF mRNA表达按常规SABC法进行。阴性对照用预杂交液代替杂交液,用正常羊血清代替地高辛抗体,其余步骤相同。
1.2.7图像分析将切片在统一放大倍数(×200)下,随机选择10个非重叠视野,以缺血侧海马为观察部位,每个时相点6只动物,每只动物的每个部位随机取5张非连续切片,应用重庆医科大学电镜室北航CM-2000B型生物医学图像分析系统进行自动计算平均阳性细胞数。
1.3统计方法所得数据用(x—±s)表示,采用SAS8.2统计软件进行统计学处理。采用F检验,P <0.05认为差异有统计学意义。
2 结 果
2.1TTC染色各组大鼠在局灶脑缺血/再灌注24h后取脑行TTC染色,NC组和SC组呈红色,I/R可见明显梗塞灶,缺血累及顶叶、颞叶、额叶皮质及基底节区等深部组织,符合大脑中动脉供血范围。见图1。
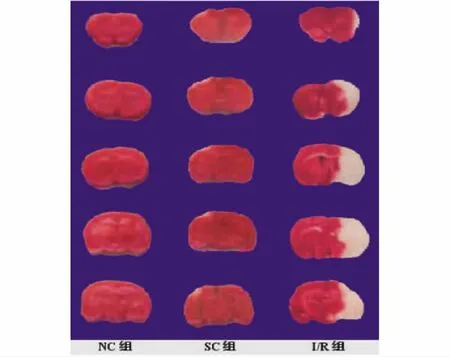
图1 局灶脑缺血/再灌注1d各组大鼠脑梗塞体积:正常为红色,梗塞区呈白色(TTC染色)
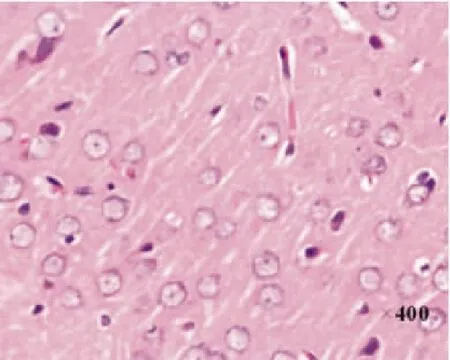
图2 正常组神经细胞形态
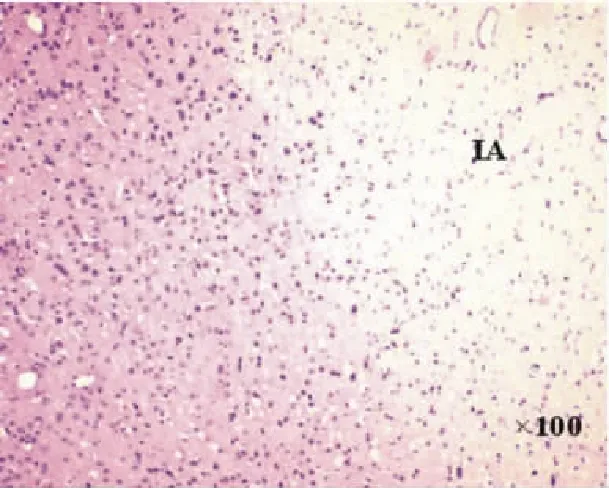
图3 局灶脑缺血1h/再灌注1d时梗死病灶:右侧IA为梗死区(HE染色)
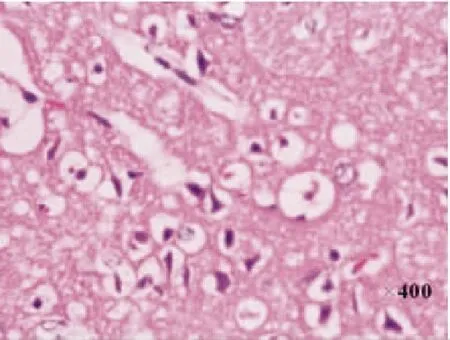
图4 局灶脑缺血/再灌注1d时缺血脑组织稀疏,神经细胞大量脱失
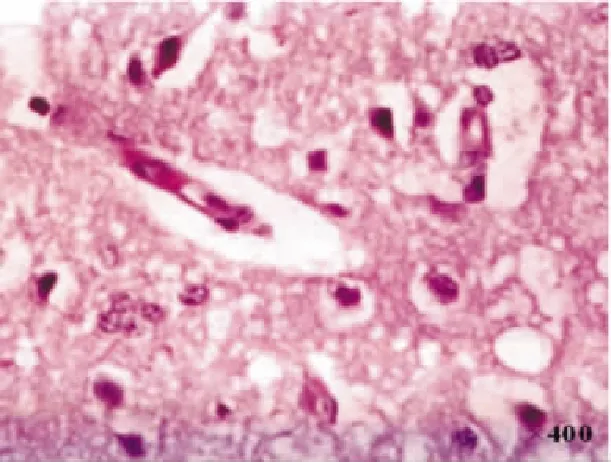
图5 局灶脑缺血/再灌注7d时缺血脑组织变化
2.2HE染色光镜下见NC组和SC组大脑皮质细胞排列有序,组织结构完整,核清楚,核仁明显,胞浆染色均匀,胞膜完整; I/R组术后可见右侧大脑中动脉区脑缺血灶,缺血核心区细胞变性、坏死,镜下可见核固缩,核仁消失,胞浆疏松,间质水肿;缺血/再灌注后1d时,I/R组组织水肿、疏松;缺血中心区片状组织坏死,有炎性细胞浸润;缺血周边区神经细胞不规则,核固缩,7d时I/R组可见大量神经元细胞死亡,留下很多空泡,至14d时,I/R组缺血区见胶质细胞广泛增生,缺血中央区出现液化坏死腔,常被瘢痕取代。见图2-图5。
2.3神经症状学评分正常组和假手术组未评分,I/R组局灶脑缺血/再灌注后1h均出现神经功能缺损,随着缺血/再灌注时间的延长,神经功能缺失症状逐渐减轻。见表1。

表1 大鼠局灶脑缺血/再灌注后神经功能评分
2.4海马区BDNF mRNA阳性反应光镜下BDNF mRNA阳性反应主要集中于齿状回颗粒细胞以及CA2、CA3中的锥体细胞胞浆中,胞核不染色。局灶脑缺血/再灌注后,I/R组缺血侧海马BDNF mRNA表达增加,主要见于齿状回颗粒细胞层和锥体细胞层。缺血/再灌注后1d时BDNF mRNA阳性反应即有增多,3d时达到高峰(P<0.01),阳性产物染色较深,7d后迅速下降(P<0.01),14d后明显下降(P<0.01),21d后进一步下降(P<0.05),28d时接近正常水平。见表2。
2.5海马区bFGF mRNA的阳性表达正常海马区可见少量bFGF mRNA的阳性表达,主要位于海马锥体细胞层、CA1、CA2区,SC组与NC组变化相似,比较差异无统计学意义(P>0.05)。局灶脑缺血/再灌注后,I/R组缺血侧海马可见bFGF mRNA的强阳性表达,1d时开始增加(P<0.05),3d即达一小高峰(P<0.01),7d开始下降,21d时明显下降,28d时降到正常水平(P<0.05),与NC组和SC组对应时间点比较,差异有统计学意义(P<0.05)。见表3。
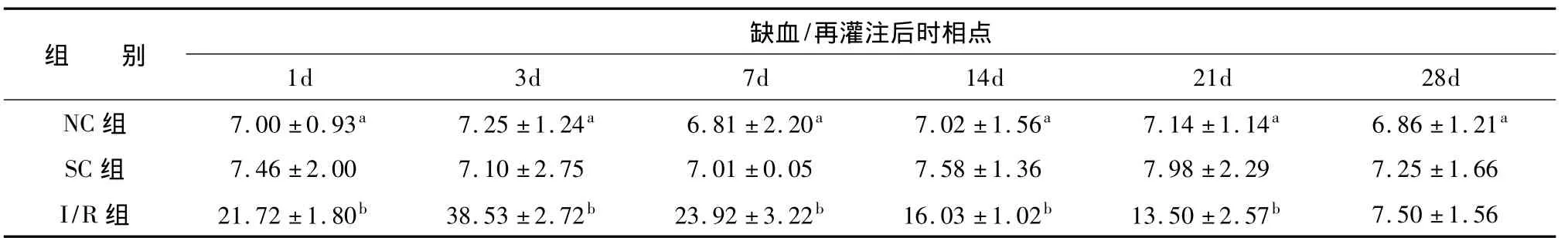
表2 各实验组海马区BDNF mRNA的表达水平(光密度)
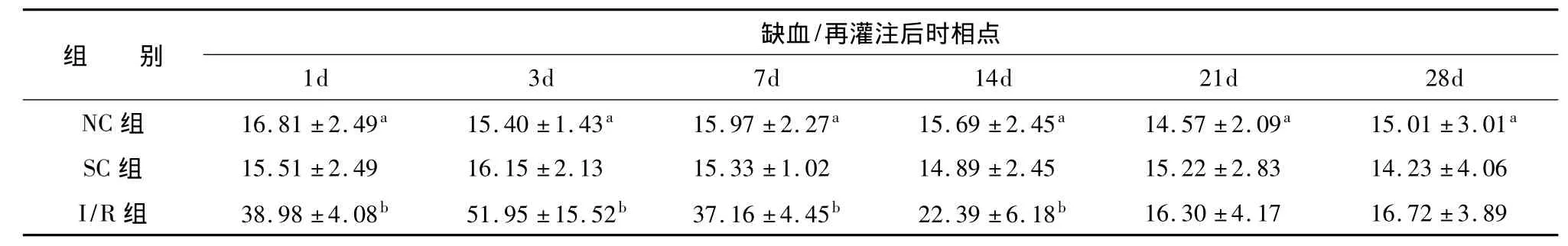
表3 各实验组海马区bFGF mRNA的表达水平(光密度)
3 讨 论
神经营养因子是神经系统重要的生物活性因子,对神经系统的正常分化、发育、成熟、维持功能和存活、损伤修复等均具有重要的生物学作用。BDNF是广泛分布于中枢神经系统的一种蛋白质,是1982年德国神经生物学家Brade等首次从猪脑中纯化获得。BDNF表达广泛,包括大脑皮质、海马、基底前脑、纹状体、下丘脑、小脑,其中皮质和海马含量最高[3]。BDNF具有增殖分化营养的作用,使其在中枢神经系统发育过程中起重要作用。BDNF能减少缺血引起的梗死面积,保护半影区神经元,并能抑制迟发性神经元坏死[4]。
本实验观察到,在正常脑组织中,BDNF mRNA表达广泛,但阳性反应很弱。局灶脑缺血/再灌注后3d,BDNF mRNA在缺血侧海马可达一小高峰。而胡跃强等[5]采用线栓法制作局灶性脑缺血大鼠模型,研究缺血半暗带BDNF mRNA及其蛋白的表达,发现缺血再灌注后3h开始明显上升,6h表达继续增强,12h达高峰,3d后表达开始减弱,7d后降至基础水平,与本研究结果有所不一致。研究发现,BDNF mRNA及其受体TrkB在靶神经元变性区域特异性上调,其上调发生在前3周,即细胞迁移、分化及整合阶段,且在锥体神经元进行性凋亡的时期上调尤为明显,表明BDNF可能参与并影响了脑损伤后新生细胞的增殖、分化和移行[6]。
bFGF是多肽神经生长因子一员,具有强烈促增殖效应的多肽因子,也是内皮细胞的有丝分裂原和血管再生因子[7-8]。有实验证实bFGF首先可通过神经营养作用和通过促进内皮细胞的分裂和分化,促进中枢神经系统血管的形成与功能恢复[9]。bFGF还可通过提高抗氧化酶活性,清除自由基,防治脑缺血再灌注后的神经细胞凋亡[10]。
正常情况下,脑内仅有少量bFGF表达,当脑受到各种损害时,即可诱导bFGF表达增加。本实验观察到,在正常脑组织中,bFGF mRNA表达广泛,但阳性反应较弱。局灶脑缺血/再灌注后3d,bFGF mRNA在缺血侧海马区可达一小高峰,7d后开始下降,因bFGF是一个强效扩管剂,可以在不引起全身血管扩张的同时优先扩张脑血管或特异性扩张梗塞周围血管,增加半影区的血供,减少梗塞面积[11]。bFGF是一种具有多种生物活性的神经营养因子,其与相关联的受体结合导致广泛的细胞反应,包括细胞增殖和分化、血管形成和抑制凋亡等[12]。推测局灶脑缺血/再灌注后内源性bFGF mRNA的上调,对新生细胞的增殖、迁移、存活、分化都会起到积极作用。体内外实验表明,EGF促进神经干细胞分化成神经胶质细胞,而bFGF则促进神经干细胞分化成神经元[13-14]。
目前认为缺血性脑血管疾病是一个有众多因素参与的复杂病理生理过程。研究发现在成年哺乳动物(包括人类)侧脑室外侧壁的室下带(SVZ)和海马齿状回(DG)的颗粒下层,还存在着持续的神经发生(neurogenesis)现象[15-16]。即认为存在具有自我更新和多分化潜能的神经干细胞(neural stem cell,NSC)。正常情况下成年脑内的神经干细胞大多处于静息状态,只有在某些因素作用下或者受到损伤刺激时,神经干细胞才被激活,重新进入细胞增殖周期,在趋化因子的作用下向损伤部位迁移,并进一步分化为特定功能的神经细胞。国内有研究显示脑梗死后在梗死灶周围BDNF和bFGF表达均增加,但两者表达时间并不一致,bFGF表达较BDNF早,BDNF主要表达于梗死灶区的神经细胞和胶质细胞胞浆,而bFGF主要表达于梗死灶外周的神经细胞和胶质细胞胞浆,在梗死中心区有少量细胞表达,表明BDNF和bFGF在脑梗死后的不同时间发挥保护作用[17]。石旺清等[18]研究发现大鼠脑缺血/再灌注后3 d,大鼠出现了明显的神经功能缺损及运动功能障碍,缺血区周边组织神经元凋亡亦达到高峰,同时bFGF和GAP-43表达增强,7d达到高峰,以后逐渐减弱,缺血周边组织可见散在的新生神经元,持续到28d。
研究表明,脑缺血后神经营养因子可在一定时间内表达上调,而神经营养因子可调节合成代谢,修复受损神经元并促进神经元的再生;另外其能刺激成年神经元的轴突和树突出芽,增强突触递质的释放,调节突触传递,加强了突触联系,同时也能维持成熟神经元的正常功能。高俊淑等[19]运用探索学习训练脑缺血再灌注大鼠,采用免疫组织化学染色检测大鼠脑梗死灶周围BDNF阳性神经元数量,发现探索学习组最高,对缺血性脑损伤起到保护作用。本实验提示局灶缺血/再灌注后脑内细胞分泌内源性BDNF mRNA和bFGF mRNA,改善了脑内神经元生存环境而促进神经元再生修复。因临床上对缺血性脑血管病患者的治疗是长期的,所以,通过“非药物”手段调控内源性BDNF mRNA和bFGF mRNA的合成和释放,可避免给予外源性BDNF和bFGF所带来的各种困难,将是神经科学领域研究的方向之一。
参考文献
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1) :84-91.
[2]罗勇,董为伟.Wistar大鼠插线法局灶性脑缺血/再灌注模型的实验研究[J].重庆医科大学学报,2002,27(1) :1-4.
[3]Kim WS,Lim JY,Shin JH,et al.Effect of the presence of brainderived neurotrophic factor val(66) met polymor-phism on the recovery in patients with acute subcortical stroke[J].Ann Rehabil Med,2013,37(3) :311-319.
[4]Endres M,Fan G,Hirt L,et al.Ischemic brain damage in mice after selectively odifying BDNF or NT4 gene expression[J].J Cereb Blood Flow Metab,2000,20(1) :139-144.
[5]胡跃强,唐农,刘泰,等.大鼠局灶性脑缺血再灌注后BDNF mRNA及其蛋白的表达变化[J].中风与神经疾病杂志,2011,28(3) :220-222.
[6]Wang Y,Sheen VL,Macklis JD.Cortical interneurons upregulate neurotro-phins in vivo in response to targeted apoptotic degeneration of neighboring pyramidal neurons[J].Exp Neurol,1998,154 (2) :389-402.
[7]Eckenstein FP.J Neurobiol.Fibroblast growth factors in the nervous system[J].1994,25(11) :1467-1480.
[8]Powell PP,Finklestein SP,Dionne CA,et al.Temporal,differential and regional expression of mRNA for basic fibroblast growth factor in the developing and adult rat brain[J].Brain Res Mol Brain Res,1991,11(1) :71-77.
[9]Burger PE,Coetzee S,Mckeehan WL,et al.Fibroblast growth factor receptor-1 is expressed by endothelial progenitor cells[J].Blood,2002,100(10) :3527-3535.
[10]Ay I,Sugimori H,Finklestein SP.Intravenous basic fibroblast growth factor (bFGF) decreases DNA fragmentation and prevents downregulation of Bcl-2 expression in the ischemic brain following middle cerebral artery occlusion in rats[J].Brain Res Mol Brain Res,2001,87(1) :71-80.
[11]Tanaka R,Miyasaka Y,Yada K,et al.Fibroblast growth factor increases regional cerebral blood flow and reduces infarct size after experimental ischemia in a rat model[J].Stroke,1995,26(11) : 2154-2159.
[12]Jin-qiao S,Bin S,Wen-hao Z,et al.Basic fibroblast growth factor stimulates the proliferation and differentiation of neural stem cells in neonatal rats after ischemic brain injury[J].Brain,2009,31(5) :331-340.
[13]Baldauf K,Reymann KG.Influence of EGF/bFGF treatment on proliferation,early neurogenesis and infarct volume after transient focal ischemia[J].Brain Res,2005,1056(2) :158-167.
[14]Weickert CS,Kittell DA,Saunders RC,et al.Basic fibroblast growth factor and fibroblast growth factor receptor-1 in the human hippocampal formation[J].Neuroscience,2005,131(1) : 219-233.
[15]Gage FH.Stem cells in the central nervous system[J].Science,2000,287(5457) :1433-1438.
[16]Alvarez-Buylla A,Garcia-Verdugo JM.Neurogenesis in the adult subventricular zone[J].J Neurosci,2002,22(3) :629-634.
[17]杨小艳,余昌胤,范瑞明.糖尿病大鼠缺血再灌注脑组织脑源性神经生长因子和碱性成纤维细胞生长因子的表达及意义[J].贵州医药,2008,32(2) :99-101.
[18]石旺清,郑关毅,陈晓东,等.大鼠脑缺血/再灌注后bFGF和GAP-43的表达与神经再生[J].中国应用生理学杂志,2013,29(1) :63-67.
[19]高俊淑,李阔,李娜,等.探索学习对局灶性脑梗死大鼠梗死灶周围皮质BDNF表达的影响[J].中国康复医学杂志,2007,22 (7) :584-588.
论著·临床
Study on dynamic changes of BDNF mRNA and bFGF mRNA in hippocampus of adult rats with focal cerebral ischemia/reperfusion
HUANG Yan-jun1,LUO Yong2,3,ZHANG Zhong-nian1,CAO Fei-hu1,SONG Xiao-ling1,ZHANG Diwen11The Third Hospital of Mianyang,Mianyang 621000,China2The Department of Neurology,the First Affiliated Hospital of Chongqing University of Medical Sciences,Chongqing 400016,China3Chongqing Key Laboratory of Neurology,Chongqing 400016,China
【Abstract】Objective To study on dynamic changes of BDNF mRNA and bFGF mRNA in hippocampus of adult rats with focal cerebral ischemia/reperfusion.Methods The animal model of focal cerebral ischemia/reperfusion was made by filament occlusion of the right middle cerebral artery.108 male Wistar rats were randomly divided into three groups: normal control group (NC group),sham operation control group (SC group),ischemia/reperfusion group (I/R group),each group contain 1,3,7,14,21 and 28d six time points (for each point,n=6).In situ hybrization method was used to detect the number of BDNF mRNA and bFGF mRNA expression positive cells following various time in hippocampus of adult rats.Results Normally a small amount of BDNF mRNA and bFGF mRNA in hippocampus.After focal cerebral ischemia/reperfusion,the number of BDNF mRNA and bFGF mRNA positive cells increased at each time point,reached small peak value after 3 days(P<0.01).Immunoprecipitates were dyed deeply,after 7 days decreased rapidly,28d decreased to normal level(P<0.05).Conclusion Focal cerebral ischemia/reperfusion can up-regulated expression of BDNF mRNA and bFGF mRNA,Advantageous to the recovery of neural function after cerebral ischemia and have neuroprotective effect.
【Key words】Focal cerebral ischemia/reperfusion; BDNF mRNA; bFGF mRNA; hippocampus;Rat
(收稿日期:2015-01-30)
项目基金:四川省卫生厅科研课题(080211)。
doi:10.11886/j.issn.1007-3256.2015.01.006
文献标识码:A
中图分类号:R743.3
