大鼠在体肠吸收杜仲中几种成分的特征研究
2015-04-21侯靖宇谢玉敏陈鹏程王永林王爱民
侯靖宇,潘 洁,谢玉敏,陈鹏程,王永林,王爱民
(贵阳医学院1.药学院贵州省药物制剂重点实验室、2.民族药与中药开发应用教育部工程研究中心,贵州贵阳 550004)
大鼠在体肠吸收杜仲中几种成分的特征研究
侯靖宇1,潘洁1,谢玉敏1,陈鹏程1,王永林1,王爱民2
(贵阳医学院1.药学院贵州省药物制剂重点实验室、2.民族药与中药开发应用教育部工程研究中心,贵州贵阳550004)
Characteristics of rat’s intestinal absorption of several components from Eucommia ulmoides
HOU Jing-yu1,PAN Jie1,XIE Yu-min1,CHEN Pengcheng1,WANG Yong-lin1,WANG Ai-min2
(1.Guizhou Provincial Key Laboratory of Pharmaceutics,School of Pharmacy,2.Engineering Research Center for the Development and Application of Ethnic Medicine and TCM,Ministry of Education,Guiyang Medical University,Guiyang 550004,China)
Key words:Eucommia ulmoides; in situ intestinal perfusion model; UPLC-MS/MS; pH value; bile; intestinal absorption
杜仲为杜仲科杜仲属植物杜仲Eucommia ulmoides Oliv.的干燥树皮,其味甘,性温,归肝经、肾经,为国家二级珍稀树种,是传统名贵滋补药材。有补肝肾、强筋骨、安胎等功效,主要用于治疗肝肾不足、腰膝酸痛、筋骨无力、头晕目眩、妊娠漏血、胎动不安等疾病[1-3]。
课题组在前期工作中采用Caco-2细胞模型研究杜仲提取物的摄取机制以及不同因素影响下杜仲提取物的摄取特点[2]。本文进一步采用大鼠在体肠循环灌流模型[4],以原儿茶酸、松脂醇单葡萄糖苷和松脂醇二葡萄糖苷为考察对象,对杜仲提取物的肠吸收特性进行研究,并探讨其在不同因素影响下的肠吸收动力学特征,为杜仲的物质基础研究提供必要的科学依据。
1 材料
1.1仪器与试药超高效液相色谱质谱联用仪(美国Waters公司) ; ZH-2涡旋混合器(天津药典标准仪器厂) ; Allegra 64R高速离心机(美国Beckman Coulter公司) ; MTN-2800D氮吹浓缩装置(天津奥特塞恩斯仪器有限公司) ; EL204电子天平(梅特勒-托利多仪器有限公司) ; HL-2S蠕动泵(上海青浦沪西仪器厂) ; DK-98-ⅡA恒温水裕锅(天津泰斯特仪器有限公司)。
葛根素(内标,批号:111-0906623,中国药品生物制品鉴定所) ;原儿茶酸(批号:110306,四川省维克奇生物科技有限公司) ;松脂醇二葡萄糖苷(批号:201206,上海顺勃生物工程有限公司) ;松脂醇单葡萄糖苷(批号:201206,江苏弘惠医药有限公司) ;乌拉坦(上海行知化工厂) ;盐酸维拉帕米(阿拉丁) ;杜仲提取物(自制,批号: 20130823) ;甲醇、乙腈为色谱纯; Krebs-Ringer’s(K-R)营养液(NaCl 7.8 g、KCl 0.35 g、NaHCO31.37 g、NaH2PO40.32 g及MgCl20.02 g,加500 mL蒸馏水溶解,0.37 g CaCl2、葡萄糖1.4 g溶于500 mL蒸馏水,两者混匀即可)。
1.2动物健康SD大鼠(♀♂各半),体质量200~240 g,由贵阳医学院动物中心提供。批号: SCXK(黔) 2014-0003。
2 方法
2.1色谱条件色谱柱: Waters BEH C18(2.1 mm×100 mm,1.7 μm)柱,流动相:0.1%甲酸乙腈(A)-0.1%甲酸水(B),梯度为0~0.5 min: 5%~10% (A),0.5~3.5 min: 10%~20% (A),3.5~4 min: 20%~90% (A),4~5 min: 90%~5%(A) ;流速: 0.30 mL·min-1;柱温: 45℃;进样体积:1 μL。
2.2质谱条件电喷雾电离源(ESI),毛细管电压:3 kV,离子源温度120℃;喷雾气与反吹气: N2,去溶剂气流速650 L ·h-1,温度350℃;反吹气流速50 L·h-1;扫描方式为多反应离子监测(MRM)。原儿茶酸: m/z(-) 152.9→109、松脂醇二葡萄糖苷: m/z(-) 681.3→357.2、松脂醇单葡萄糖苷: m/z(-) 519.3→357.2及葛根素: m/z(+ ) 417→267。
2.3供试药液的制备取适量杜仲提取物,加入适量K-R营养液,超声使溶解,10 000 r·min-1离心5 min,取上清液备用,获得2.0、4.0、8.0 mg·L-1的供试液。
2.4在体肠吸收实验参照文献[5-6],本实验据其具体内容并进行适当修改,对大鼠麻醉后固定进行手术,取50 mL肠循环液以5 mL·min-1流速循环10 min,再以2.5 mL· min-1的速度继续回流,立即读出循环液体积并取样1 mL,另向量筒中补加K-R缓冲液1 mL,其后每隔30 min亦按同法读数,取样并补加等体积K-R缓冲液,循环3 h后中止。取肠灌流样品溶液100μL,加20μL20.03mg·L-1内标溶液,400 μL甲醇及100 μL 0.1%的甲酸,涡混1 min,15 000 r ·min-1离心5 min,取上清液进样UPLC-MS/MS分析。
2.5统计学分析同参考文献[6]
3 结果
3.1不同pH值及浓度的考察对3个成分在不同pH条件及不同浓度下累计吸收常数(A)进行方差分析比较,pH=6.0时,各成分的3 h累计吸收量相对较高。原儿茶酸在低浓度时A%明显高于中、高浓度(P<0.05),松脂醇单葡萄糖苷在中浓度时A%明显低于高浓度(P<0.05) ;提示其在体内的吸收机制可能为被动吸收,见Tab 1、2。
3.2胆汁及P-gp抑制剂对3种成分吸收的影响3种成分在结扎胆管及维拉帕米抑制P-gp条件下的累计吸收常数(A)经方差分析,表明胆汁对3种成分的吸收均具有抑制作用(P<0.05),加入P-gp抑制剂后原儿茶酸吸收明显增加(P<0.05),结果见Tab 3。
3.3不同肠段中3个成分的累计吸收常数(A)和Ka比较
对3个成分在不同肠段的累计吸收常数(A)进行方差分析,原儿茶酸在空肠的累积吸收量较回肠大(P<0.05)。3种成分在不同肠段的吸收趋势,原儿茶酸:空肠>回肠>十二指肠>结肠;松脂醇二葡萄糖苷:回肠>空肠>十二指肠>结肠;松脂醇单葡萄糖苷:十二指肠>回肠>空肠>结肠。见Tab 4。
Tab 1 A% and Ka of three components in different pH values±s,n=4)
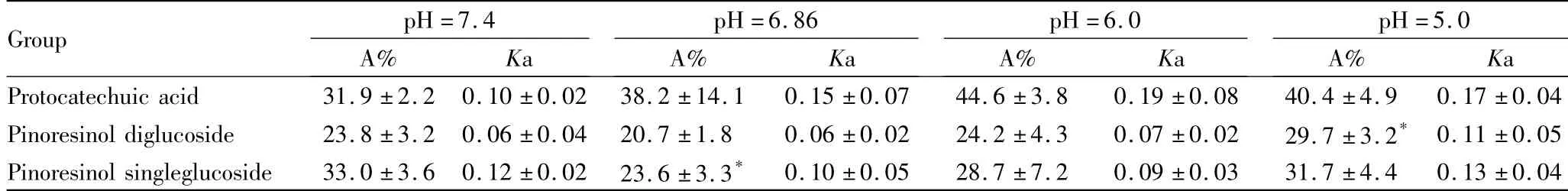
Tab 1 A% and Ka of three components in different pH values±s,n=4)
A%:*P<0.05 vs pH 7.4
Group pH=7.4pH=6.86pH=6.0pH=5.0 A% KaA% KaA% KaA% Ka Protocatechuic acid 31.9±2.2 0.10±0.02 38.2±14.1 0.15±0.07 44.6±3.8 0.19±0.08 40.4±4.90.17±0.04 Pinoresinol diglucoside 23.8±3.2 0.06±0.04 20.7±1.8 0.06±0.02 24.2±4.3 0.07±0.02 29.7±3.2*0.11±0.05 Pinoresinol singleglucoside 33.0±3.6 0.12±0.02 23.6±3.3* 0.10±0.05 28.7±7.2 0.09±0.03 31.7±4.4 0.13±0.04
Tab 2 A% and Ka of three components in different concentrations (珋±s,n=4)
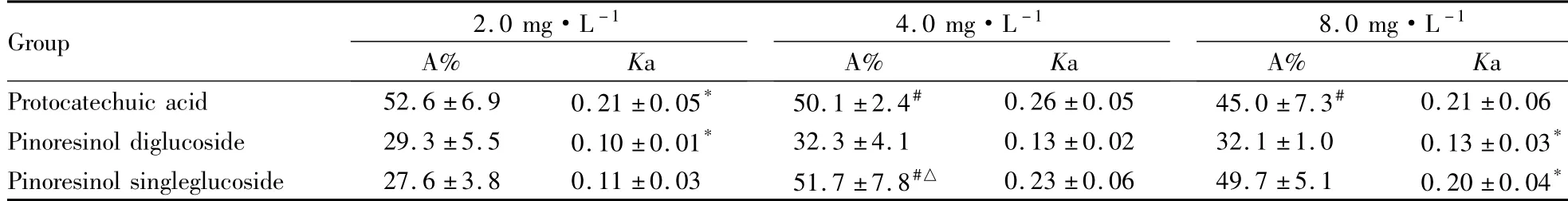
Tab 2 A% and Ka of three components in different concentrations (珋±s,n=4)
Ka:*P<0.05 vs high concentration; A%:△P<0.05 vs high concentration;#P<0.05 vs low concentration
2.0 mg·L-14.0 mg·L-18.0 mg·L-1Group A% Ka A% Ka A% Ka Protocatechuic acid 52.6±6.9 0.21±0.05* 50.1±2.4# 0.26±0.05 45.0±7.3#0.21±0.06 Pinoresinol diglucoside 29.3±5.5 0.10±0.01* 32.3±4.1 0.13±0.02 32.1±1.0 0.13±0.03*Pinoresinol singleglucoside 27.6±3.8 0.11±0.03 51.7±7.8#△ 0.23±0.06 49.7±5.1 0.20±0.04*
Tab 3 A% and Ka of three components with ligation of the bile duct and addition of verapamil(珋±s,n=4)

Tab 3 A% and Ka of three components with ligation of the bile duct and addition of verapamil(珋±s,n=4)
Ka:*P<0.05 vs control group; A%:△P<0.05 vs control group;
Group ControlBile duct ligatedP-gp inhibitors A% KaA% KaA% Ka Protocatechuic acid 25.1±2.8 0.062±0.031 50.1±2.4△ 0.262±0.052* 51.9±2.8△ 0.251±0.017*Pinoresinol diglucoside 29.1±4.6 0.059±0.009 32.3±4.1 0.127±0.020 31.1±1.8 0.085±0.010 Pinoresinol singleglucoside 32.3±4.5 0.095±0.034 51.7±7.8△ 0.230±0.061*31.1±2.9 0.108±0.012
Tab 4 A% and Ka of three components at various intestinal segments (珋±s,n=4)
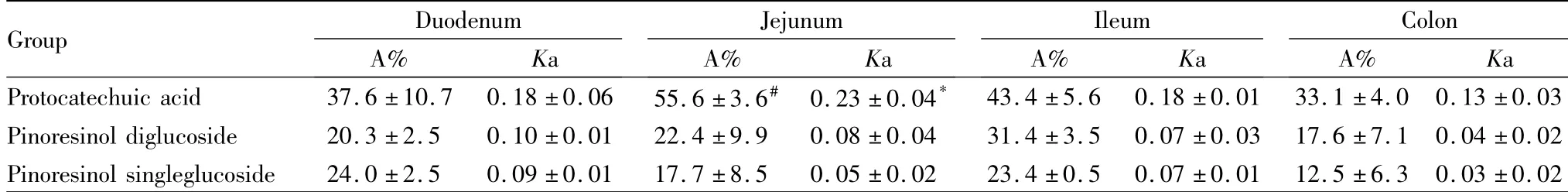
Tab 4 A% and Ka of three components at various intestinal segments (珋±s,n=4)
Ka:*P<0.05 vs colon; A%:#P<0.05 vs ileum
Group DuodenumJejunumIleumColon A% KaA% KaA% KaA% Ka Protocatechuic acid 37.6±10.7 0.18±0.06 55.6±3.6# 0.23±0.04*43.4±5.6 0.18±0.01 33.1±4.0 0.13±0.03 Pinoresinol diglucoside 20.3±2.5 0.10±0.01 22.4±9.9 0.08±0.04 31.4±3.5 0.07±0.03 17.6±7.1 0.04±0.02 Pinoresinol singleglucoside 24.0±2.5 0.09±0.01 17.7±8.5 0.05±0.02 23.4±0.5 0.07±0.01 12.5±6.3 0.03±0.02
4 讨论
本实验研究表明,原儿茶酸、松脂醇单葡萄糖苷、松脂醇二葡萄糖苷在小肠均有吸收,胆汁对3种成分的吸收存在抑制作用,原儿茶酸可能是P-gp的底物。3种成分的吸收速率与药物浓度有一定的关系,3种成分的吸收为一级吸收动力学,提示其吸收机制可能是被动转运过程。
参考文献:
[1]国家药典委员会.中国药典,一部[S].北京:中国医药科技出版社,2010:154.
[1]Chinese Pharmacopoeia Commission.Pharmacopoeia of the People’s Republic of China.Beijing: China Medical Science Press,2010.Vol I:154.
[2]兰燕宇,刘跃,曹旭,等.杜仲提取物4种主要成分在Caco-2细胞的摄取特征性研究[J].中国药理学通报,2014,30 (9) :1306-11.
[2]Lan Y Y,Liu Y,Cao X,et al.Uptake of Euconmmia ulmoides extract in Caco-2 cell monolayer[J].Chin Pharmacol Bull,2014,30(9) :1306-11.
[3]彭红梅,李小姝.杜仲的药理研究现状及应用展望[J].中医学报,2013,28(176) :72-3.
[3]Peng H M,Li X S.Pharmacological research and application of Eucommia ulmoides[J].China J Chin Med,2013,28(176) :72- 3.
[4]王春,魏伟,杨昭毅,等.芍药苷微乳溶液在大鼠在体肠的吸收动力学研究[J].中国药理学通报,2009,25(2) :181-5.
[4]Wang C,Wei W,Yang Z Y,et al.Studies on absorption kinetics of paeoniflorin microemulsion in rats intestines[J].Chin Pharmacol Bull,2009,25(2) :181-5.
[5]Yu L X,Lipka E,Crison J R,et al.Transport approaches to the biopharmaceutical design of oral drug delivery systems : prediction of intestinal absorption[J].Adv Drug Deliv Rev,1996,19(3) :359 -76.
[6]唐靖,罗丽娜,张海龙,等.基于procaspase-3激活的抗肿瘤活性分子SM-1吸收机制研究[J].中国药理学通报,2014,30 (4) :542-6.
[6]Tang J,Luo L N,Zhang H L,et al.Absorption mechanism of SM-1: a procaspase-3-activated anti-tumor agent[J].Chin Pharmacol Bull,2014,30(4) :542-6.
作者简介:侯靖宇(1991-),女,硕士生,研究方向:药物生物等效性评价与药代动力学,Tel: 0851-6908468,E-mail: 772964576 @ qq.com;王爱民(1962-),男,教授,研究方向:中药新药的研究与开发,通讯作者,Tel: 0851-6908899,E-mail: gywan100 @ 163.com
基金项目:贵州省科技重大专项项目(黔科合重大专项字[2012]6009号) ;贵州省中药现代化研究开发专项(黔科合中药字[2013]5062号,黔科合重G字[2013]4001号) ;贵州高等学校创新能力提升计划(黔教合协同创新字[2013]04)?
收稿日期:2015-01-25,修回日期:2015-03-25
文献标志码:A
文章编号:1001-1978(2015) 06-0885-03中国图书分类号: R-332; R282.71; R284.1; R322.45; R333.3关键词:杜仲提取物;在体肠灌流模型; UPLC-MS/MS; pH 值;胆汁;肠吸收
doi:10.3969/j.issn.1001-1978.2015.06.030
