鸭肝炎病毒对雏鸭脑组织损伤的研究
2015-04-20刘承军王海丽
刘承军 李 营 王海丽
(1聊城市动物医院 山东聊城 252000 2聊城职业技术学院 山东聊城 252000)
鸭病毒性肝炎是由I型鸭肝炎病毒引起雏鸭的一种急性传染病,该病发病急、传播快及死亡率高[1]。1980年至今,鸭病毒性肝炎在我国多次暴发,且发病严重,流行区域广、造成巨大损失,给养鸭业带来巨大经济损失。本文针对鸭肝炎病毒人工感染雏鸭出现的明显神经症状,对神经系统进行病理组织学研究和分子生物学的研究,采用人工复制鸭病毒性肝炎模型,动态取材脑组织,普通组织固定和HE染色,脑组织中NO和MDA含量的测定等方法,分析临床症状、组织学病变与组织NO、MDA含量之间的关系。
1 材料与方法
1.1 试剂及仪器
752紫外可见光分光光度计(上海精密科学仪器有限公司)、NO试剂盒(南京建成生物有限公司)、MDA试剂盒(南京天成生物科技有限公司)、离心机(上海化工机械)、切片机(上海化工机械)。
1.2 毒株
接种材料I型鸭肝炎病毒(DHV-1)由华中农业大学病理实验室保存。毒株的复壮过程为:接种敏感、抗体阴性的健康樱桃谷鸭5只,每只腿部肌肉注射0.2mL。收集死亡鸭的肝脏进行匀浆,5倍生理盐水稀释,加双抗(青霉素、链霉素),过滤后-20℃保存备用。
1.3 实验动物
50羽1日龄鸭肝炎抗体阴性的健康樱桃谷鸭,购自武汉市天绿农业科技有限公司,常规饲喂正大牌肉鸭料,自由饮水采食。4日龄后随即分为2组,每组25羽,其中第一组为对照组,另外一组为试验组。在试验过程中死亡的鸭,及时取材脑组织,用于HE染色。
1.4 方法
1.4.1 人工感染模式的复制及取材
试验组雏鸭进行腿部肌肉注射DHV-I病毒悬液0.2mL/羽,对照组25只,相同部位注射等量生理盐水。饲养于隔离器内。观察期临床症状,并与感染后0、3、6、12、24和48h按照3羽/组进行静脉放血处死,剖检观察病变,采集脑组织,1份甲醛固定用于石蜡切片制作,常规的HE染色;另一份研磨制成10%脑匀浆,用于NO和MDA浓度等的测定。
1.4.2 脑匀浆的制备
滤纸吸干脑组织表面的血液,准确称取1g脑组织块,用冷生理盐水冲洗,加入10mL冰冻磷酸盐缓冲液(pH7.2),制成100g/L组织匀浆,3000r/min离心15min,取上清液,-20℃保存待用。
1.4.3 测定方法
MDA含量测定采用硫代巴比妥酸法;NO浓度利用硝酸还原酶特异性将硝酸根还原为亚硝酸根,通过显色深浅测定。所有试剂盒均为南京建成生物工程研究所产品。
1.4.4 数据处理数据结果均以平均数表示,用t检验法分析对照组和试验组间的差异显著性。
1.4.5 脱水及染色严格按有关程序对组织块脱水及HE染色。
2 结果及分析
2.1 临床变化
临床观察发现,对照组鸭没有发现特征性表现,在攻毒24h后,试验组雏鸭表现呆滞,离群独立,行动迟缓,精神沉郁,垂翅缩颈,部分鸭出现抽搐和运动失调等症状;48h时部分雏鸭死亡,并于攻毒后72h全部死亡,死鸭呈典型角弓反张状态,剖检发现,肝脏肿大、质脆、色暗或发黄,表面有大小不等的斑点状出血;雏鸭的大脑、肾脏、脾及胰腺的表面有点状或块状出血,肠黏膜肿胀、充血。
2.2 组织病理学变化
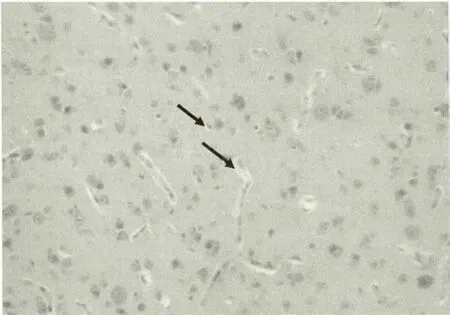
图1 感染雏鸭大脑病理变化(感染3小时后,血管水肿)
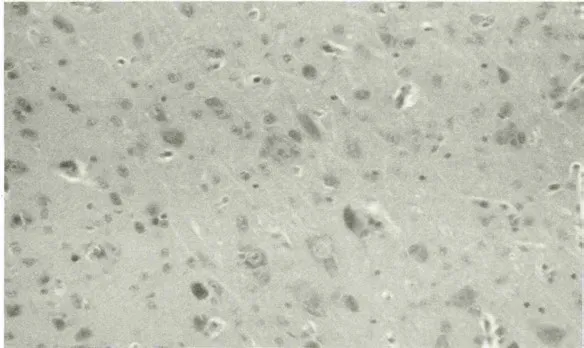
图2 感染雏鸭大脑病理变化(感染3h后,神经元坏死)
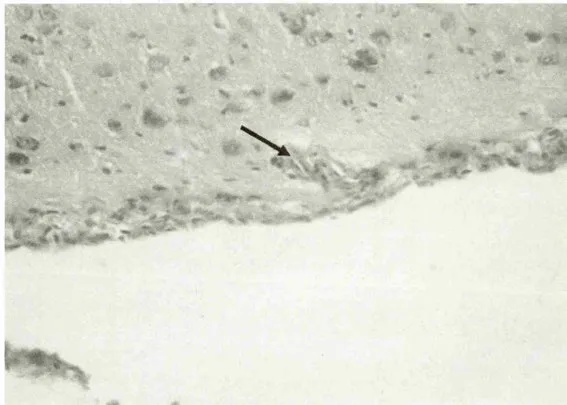
图3 感染雏鸭大脑病理变化(感染24h后,脑膜下充血)
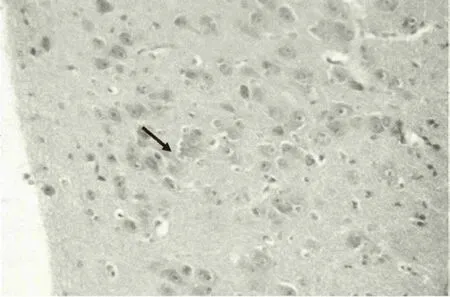
图4 感染雏鸭大脑病理变化(感染24h,神经元坏死)
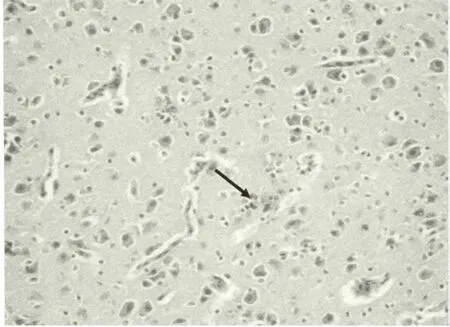
图5 死亡雏鸭脑组织病理变化(神经元坏死后的小胶质细胞结节)
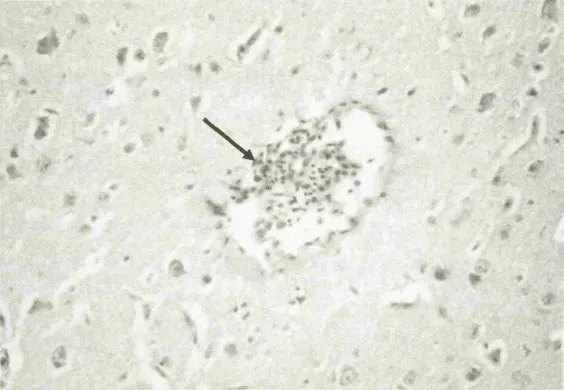
图6 死亡雏鸭脑组织病理变化(血管周围淋巴细胞浸润)

图7 感染雏鸭脑组织病理变化(感染80h后,典型的坏死灶)
大脑于攻毒后3h出现轻度水肿(图1),3h到12h出现个别神经元死亡和血管淋巴细胞浸润(图2、图4)。24h神经细胞和血管周围出现明显的水肿,血管充血并见轻度出血(图3),48h后及死亡鸭只的脑组织,胶质细胞呈局造型增生,神经元形成坏死结节(图5),血管周围淋巴细胞浸润(图6),出现典型的神经元坏死病灶(图7)。
对照组神经组织如大脑、小脑等基本正常,偶尔见有轻度充血和水肿。
2.3 NO、MDA测定结果
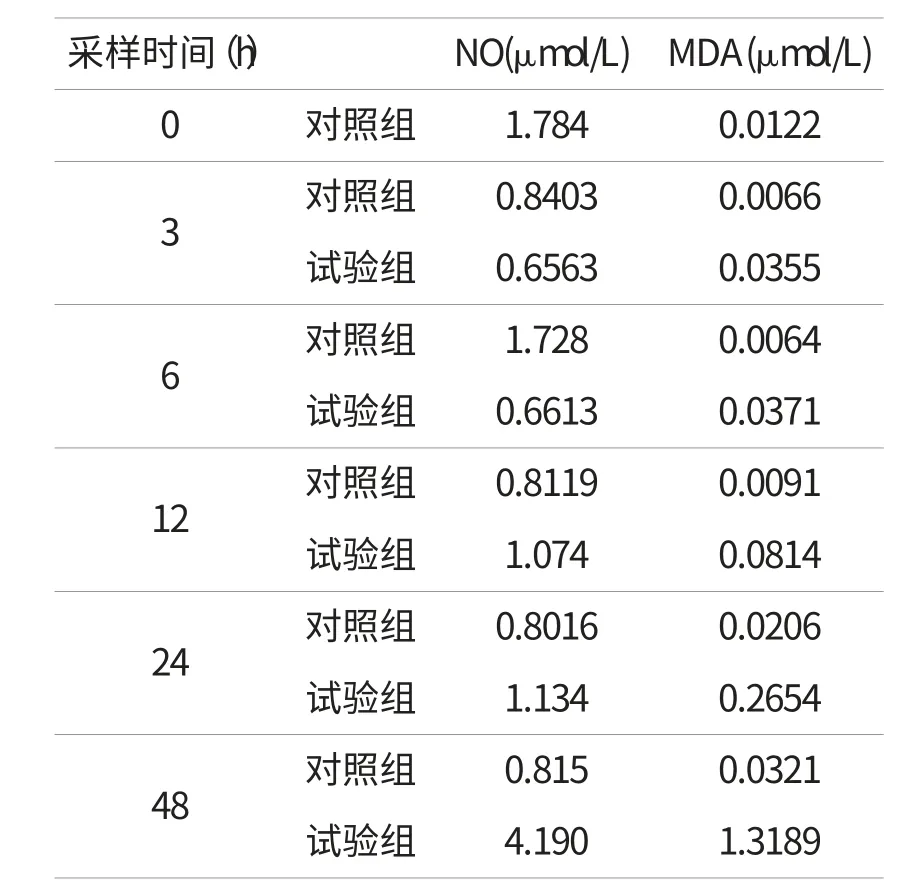
表1 脑组织中NO、MDA含量的测定结果(n=3)
试验组雏鸭脑组织中NO含量测定结果见表1。脑组织中NO含量在接种后12h开始逐步升高,48h到达测定最大值,随后雏鸭开始死亡。脑组织中MDA含量从12h开始逐步增高,到48h达到测定最大值,和脑组织中NO含量变化一致。对照组脑组织中NO和MDA含量均变化不显著。这2项数据的一致性可以一定程度反映出,随着NO含量的增加,脑组织过氧化反应也在加剧,脑组织损伤不断推进。
2.4 结论
试验组雏鸭临床症状和剖检病变及组织学病理变化相一致,可以一定程度反映出脑组织病变和雏鸭神经症状之间的关联程度。经过脑组织中NO和MAD的测定显示,NO含量随时间的变化规律和MDA随时间的变化相一致,可以反映出NO在脑组织病变中发挥了一定作用。纵向来看,NO在雏鸭病毒性肝炎的发生、发展的过程中发挥了一定作用;NO可能是雏鸭出现神经症状和脑组织病变的原因之一。
3 讨论
自由基是机体正常生化过程的产物,参与生物体许多病理、生理过程[2]。正常情况下,自由基的产生与清除保持着动态平衡。任何增强氧化作用和(或)降低抗氧化能力的因素均可打破这一平衡,致氧自由基增加。试验结果表明,氧自由基可以介导脑组织的损伤,导致疾病的发生、发展。生物体内的自由基,与过氧化氢反应所产生的羟自由基可引发脂类过氧化,导致细胞损伤,使细胞膜破坏,通透性增加,蛋白质及DNA变形[2]。
有研究结果表明,鸭肝炎病毒对雏鸭神经组织的损伤,早期以水肿为主,后期以变形、坏死增生为主,与本试验结果相同。
PUFA在ROS的作用下,可在不饱和双键上不断发生过氧化反应,MDA为脂质过氧化的最终产物之一,它可反映脂质过氧化的程度,间接反映自由基变化程度。本试验结果表明,脑组织中MDA含量随着时间的发展不断增加,且在攻毒后48h时含量最高,脑组织中的MDA含量增加规律同鸭的临床症状和组织学病变的发展规律一致,一定程度上反应了组织损伤的发展规律,同时也验证了脑组织的损伤一定程度上是由自由基反应引起的。
NO是常见的炎症介质。研究表明,NO参与了各种原因引起的组织损伤,既有保护性作用,又有细胞毒性作用。NO生成过多,将通过机体内蛋白质、脂肪和核酸等生物分子的作用,损伤组织细胞,对机体产生毒性作用。试验组脑组织中NO含量随着时间的增加而不断增加,表明NO在疾病发生发展过程中扮演了重要的角色,在脑组织损伤方面发挥了一定的作用。NO作为一种重要的自由基,在脑组织生理、病理方面都扮演了重要的角色;MDA作为自由基脂质过氧化反应的一种重要产物,其测定从反应细胞膜损伤方面具有一定意义[3]。但是NO和MDA之间具体的量化关系尚不明确,NO引起脑组织细胞其他方面的病变(比如增生、核酸和蛋白质损伤)尚不明确,需要我们进一步研究。
[1]王丙云,黄兴国,陈志胜,等.雏鸭感染鸭病毒性肝炎后神经系统的动态病理学观察[J].中国兽医杂志,2003(1):14-15.
[2]郑艳华,胡薛英,程国富,等.感染新型鸭肝炎病毒雏鸭的SOD活性和MDA含量变化[J].中国兽医科技,2004(12),6-9.
[3]丛涛,赵霖,鲍善芬.临床营养学研究中脂质过氧化的评价方法 [J].中国临床营养杂志,2004(2):127-131.
