他莫昔芬对牙髓干细胞体外分化的影响
2015-04-20刘宝刚马逢乐何欣遥王志华何文喜
王 娟,刘宝刚,马逢乐,何欣遥,王志华,何文喜
(1.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院牙体牙髓病科,陕西西安710032;2.第二炮兵总医院礼士路门诊部,北京100820)
他莫昔芬对牙髓干细胞体外分化的影响
王 娟1,刘宝刚2,马逢乐1,何欣遥1,王志华1,何文喜1
(1.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院牙体牙髓病科,陕西西安710032;2.第二炮兵总医院礼士路门诊部,北京100820)
目的:体外观察他莫昔芬(Tamoxifen)对牙髓干细胞分化的作用。方法:培养人牙髓干细胞(hDPSCs),将hDPSCs用不同浓度的他莫昔芬刺激不同时间,CCK-8法检测细胞的增殖情况;矿化诱导培养2周后茜素红染色观察矿化结节的形成,RT-PCR检测各组矿化相关基因碱性磷酸酶(ALP)、骨钙素(OCN)、骨唾液酸蛋白(BSP)、牙本质涎磷蛋白(DSPP)的表达水平。结果:10μmol/L他莫昔芬抑制hDPSCs增殖,其他浓度对hDPSCs无明显影响;与对照组相比0.5、1、2.5、5、10μmol/L他莫昔芬均能促进矿化结节的形成,其中5μmol/L最明显;且与对照组相比,5μmol/L他莫昔芬明显上调矿化相关基因ALP、OCN、BSP和DSPP的mRNA表达水平。结论:他莫昔芬可明显促进牙髓干细胞向成骨/成牙分化。
他莫昔芬;人牙髓干细胞;成牙分化;成骨分化
[Chinese Journal of Conservative Dentistry,2015,25(5):294]
牙髓干细胞(dental pulp stem cells,DPSCs)是Gronthos等[1](2000)利用酶消化法从牙髓组织中分离纯化出的一种间充质干细胞,具有很强的增殖力、自我更新和多向分化能力,在一定诱导条件下可向特定的细胞类型分化,在牙髓修复和牙齿再生中发挥着重要的作用。研究发现牙髓干细胞在体外矿化液诱导下可形成成牙本质样细胞,形成矿化结节[1],但其分化的细胞内分子机制目前尚不清楚。
他莫昔芬(Tamoxifen)是一种雌激素受体抑制剂,在临床有着广泛的应用。研究发现他莫昔芬是治疗雌激素受体阳性乳腺癌的“金标准”药物[2],临床长期使用他莫昔芬会引起非酒精性脂肪性肝病(NAFLD),同时也会导致骨质疏松[3-4]。体外研究证实,他莫昔芬能促进HepG2细胞的脂肪变性[5]。雌激素在调控干细胞分化方面有重要作用,黄素类物质可以促进骨髓间充质干细胞的成骨分化[6],而他莫昔芬作为一种雌激素受体抑制剂,有关其对人牙髓干细胞(human dental pulp stem cells,hDPSCs)的作用尚不清楚,他莫昔芬是否可以促进hDPSCs的分化,目前尚未见相关报道。
1 材料和方法
1.1 主要试剂和仪器
α-MEM培养基、I型胶原酶、Dispase酶、胰蛋白酶(Gibco公司,美国);胎牛血清(HyClone,美国);他莫昔芬(Invivo Gene,美国)、β-甘油磷酸钠、地塞米松、维生素C、茜素红(Sigma,美国);细胞活力检测试剂盒(上海恩晶生物);细胞总RNA提取试剂盒(Omega,美国);反转录试剂盒、Real-Time PCR试剂盒(Takara,日本);二氧化碳恒温孵箱(Thermo,美国);超净工作台(苏净集团苏州安泰空气技术有限公司);倒置相差显微镜和照相系统(Olympus,日本);Real-time PCR仪、ABI Prism 7500 Real-Time PCR系统(Applied Biosystems,美国)。
1.2 hDPSCs的体外分离和培养
临床收集18~25岁志愿者正畸减数新鲜拔除的健康完整恒牙,750 mL/L乙醇擦拭牙体,含双抗的PBS浸洗2次;无菌条件下取出牙髓,置PBS浸洗2次,将牙髓剪成1~2 mm大小的组织块后,1 000 r/min离心5 min,弃上清;加入4 mg/L I型胶原酶37℃消化40 min;每10 min震荡1次,共3次,1 000 r/min离心5min,弃上清;用含200 mL/L胎牛血清的α-MEM培养液清洗3遍;1 000 r/min离心5 min,收集细胞并用含200mL/L胎牛血清的α-MEM重悬后,接种于35 mm培养皿,置37℃,50 mL/L CO2恒温培养箱中培养。3 d换液1次,倒置显微镜下观察细胞生长情况,细胞融合至80%时,50 g/L胰酶消化,用有限稀释法挑取单细胞克隆扩大培养,备用。
1.3 他莫昔芬对hDPSCs增殖的影响
将第3代hDPSCs用无血清10 mL/Lα-MEM培养液以3×103/孔接种于96孔板,共30孔,为防止边缘效应,周边36孔加200μL PBS。置于37℃,50 mL/L CO2孵箱24 h后,分为对照组(空白组)和分别含有0.5、1、2.5、5、10μmol/L他莫昔芬实验组;分别在1、3、5、7 d时每孔加入10μL CCK-8工作液,置于37℃,50 mL/L CO2孵箱4 h后用酶联免疫检测仪测定450 nm处的吸光度值。每组设5个复孔,取平均值,实验重复3次。
1.4 他莫昔芬对hDPSCs成骨/成牙分化的影响
1.4.1 实验分组及矿化诱导培养
将P3代hDPSCs接种于6孔板中,实验组分别加入含0.5、1、2.5、5μmol/L他莫昔芬的10 mL/L矿化诱导液(含10 mmol/Lβ-甘油磷酸钠,50μg/mL维生素C,1×10-8mol/L地塞米松、100 mL/L FBS的α-MEM培养液)继续培养2周;空白组为10 mL/Lα-MEM培养液,对照组加入10 mL/L矿化液均继续培养2周。
1.4.2 RT-PCR检测矿化相关基因OCN、ALP、BSP、DSPPmRNA
矿化诱导2周后各组细胞弃上清,PBS冲洗两遍;将6孔板置于冰上,用RNA提取试剂盒提取细胞总RNA,并用反转录试剂盒合成cDNA(所有操作步骤均严格按产品说明);利用NCBI网站的BLAST工具设计相关引物,并以cDNA为模板、GAPDH作为内参,按照TAKARA实时PCR试剂盒步骤用ABIPrism 7500 Real-Time PCR系统检测各矿化相关基因碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteonectin,OCN)、骨唾液酸蛋白(bone sialoprotein,BSP)、牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)mRNA的表达水平。所用引物由上海生工生物股份有限公司合成,各引物序列见表1。

表1 实时定量PCR所用引物名称及序列
1.4.3 茜素红染色观察矿化结节的形成
不同刺激组细胞经矿化诱导2周后,PBS漂洗3遍,40 g/L多聚甲醛室温固定30 min,PBS漂洗3遍后加入100 g/L(pH=4.2)的茜素红液,室温闭光固定15 min后蒸馏水漂洗至染液无色,倒置显微镜观察矿化结节形成情况,最后用PBS配置的100 g/L氯化十六烷基吡啶进行茜素红定量分析,6孔板每孔加1 mL 100 g/L氯化十六烷基吡啶,置于摇床上混匀20 min后,将各组样本取100μL,5个复孔加入96孔板,测定490 nm处的吸光度值,取各组平均值作统计分析。
1.5 统计学分析
采用SPSS 13.0软件进行统计分析,组间比较用t检验,检验水准α=0.05。
2 结果
2.1 不同浓度他莫昔芬对hDPSCs增殖的影响
10μmol/L他莫昔芬组与对照组相比在第5天后表现出明显的抑制hDPSCs增殖的作用,而0.5、1、2.5、5μmol/L刺激组对hDPSCs增殖无明显影响(图1)。
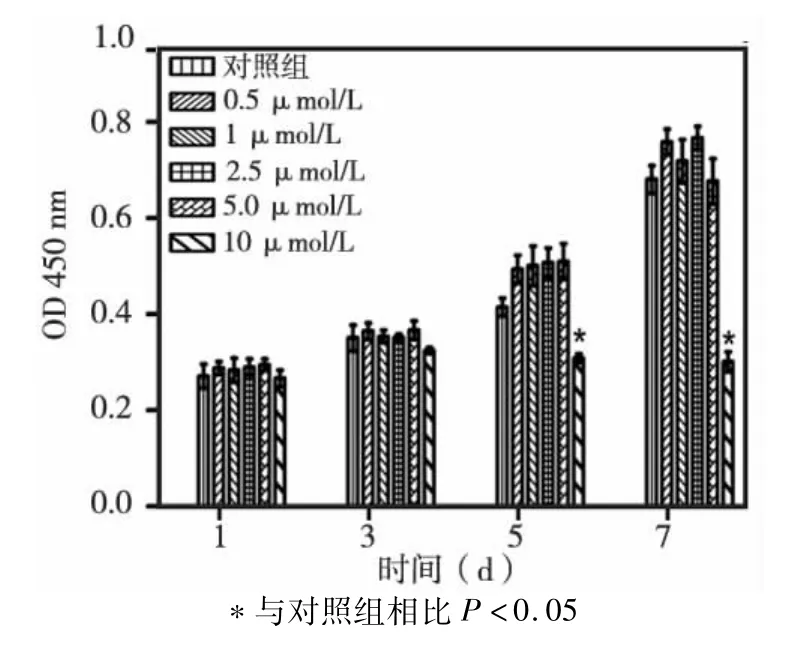
图1 不同浓度他莫昔芬刺激hDPSCs后对其增殖能力的影响
2.2 他莫昔芬对hDPSCs成骨/成牙分化的影响
2.2.1 矿化诱导2周后茜素红染色观察各组矿化结节的形成
矿化2周后茜素红染色结果表明(图2),与对照组相比各组均能促进矿化结节的产生,其中5μmol/L刺激组矿化效果比其他刺激组更加明显,镜下及茜素红定量结果(图3~4)与肉眼观察一致。
2.2.2 RT-PCR检测他莫昔芬刺激矿化诱导2周后矿化相关基因变化
矿化2周后,与对照组相比,实验组中矿化相关基因OCN、ALP、BSP、DSPP的mRNA表达水平,以5μmol/L组最显著(图5)。

图2 矿化诱导2周后茜素红染色情况

图3 显微镜下矿化诱导2周后观察(×40)
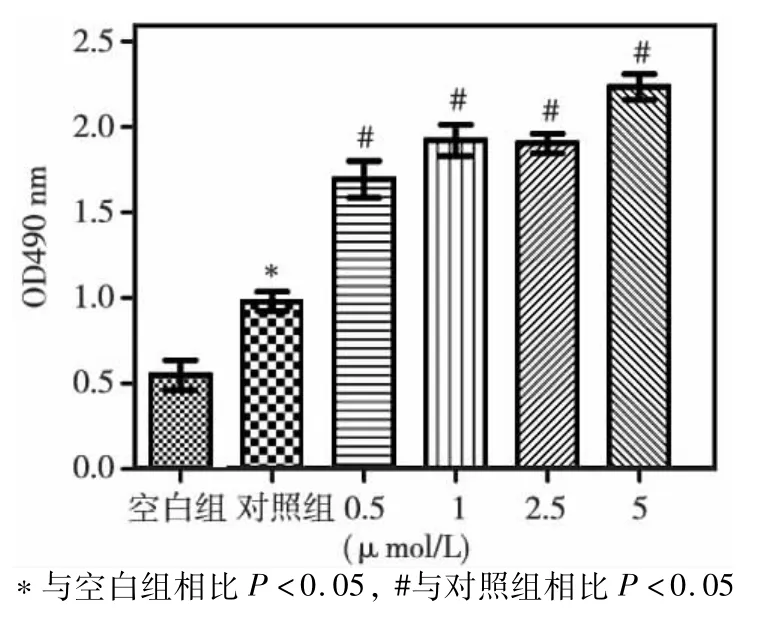
图4 矿化诱导2周后茜素红定量结果
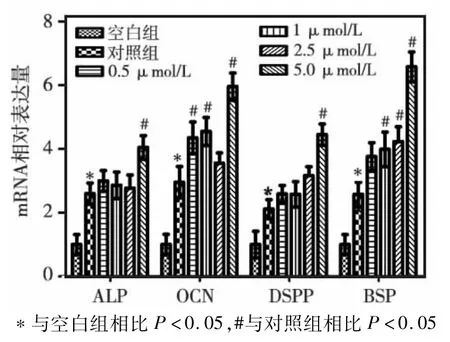
图5 矿化诱导2周后各组ALP、OCN、DSPP、BSPmRNA表达水平的比较
3 讨论
干细胞是人体内较原始,未分化的细胞,具有自我更新、高度增殖和多向分化能力,可分为胚胎干细胞和成体干细胞。Gronthos等[1]第一次成功分离鉴定hDPSCs并阐明其生物学特性后,使得牙髓干细胞成为当下研究的新焦点。在中枢神经系统、骨组织和免疫系统中都存在雌激素受体[7],雌激素在调节炎症以及肿瘤细胞方面有重要的作用[8-9]。研究发现在牙周膜细胞中存在雌激素受体,女性更易于发生牙周炎可能与牙周膜细胞存在雌激素受体有关[10-11]。通过检测人牙髓细胞雌激素基因表达水平以及成骨诱导分化,表明牙髓细胞表面存在雌激素受体,且雌激素能够促进牙髓细胞的骨向分化[12-14];在牙髓干细胞方面,也有研究证实雌二醇能够通过NF-κB通路促进牙髓干细胞成骨/成牙分化的能力[15],表明牙髓干细胞表面存在雌激素受体。
他莫昔芬作为临床治疗乳腺癌常用药物,能够作为雌激素受体抑制剂发挥作用,但常有骨质疏松及肝脂肪变性现象发生[4-5]。本实验通过CCK-8实验观察他莫昔芬对hDPSCs增殖的影响,结果显示,与对照组相比,0.5、1、2.5、5μmol/L他莫昔芬对细胞存活率无明显影响,而当浓度提高到10μmol/L时,hDPSCs增殖明显抑制。为了排除他莫昔芬的药物毒性导致细胞死亡所造成对细胞增殖的抑制,后续实验选择5μmol/L为药物干预浓度。研究显示,他莫昔芬抑制人垂体腺瘤细胞的增殖,并呈剂量依赖性[16],20μmol/L可抑制大鼠星形胶质细胞的增殖,低于20μmol/L则无抑制作用[17]。他莫昔芬对hDPSCs增殖的影响不同于上述两者可能是因为细胞来源及刺激浓度不同导致。
矿化能力是干细胞成骨的重要特性之一,组织内的钙质大部分以磷酸钙或碳酸钙的形式存在。茜素红AR-S法通过钙离子与茜素红特异性结合,可使矿化结节呈现鲜红色,因此茜素红染色是鉴定成骨分化或成牙分化的常用方法之一。本研究发现不同浓度他莫昔芬矿化诱导2周后,hDPSCs茜素红染色结果显示,与不加他莫昔芬矿化组相比,0.5、1、2.5、5μmol/L各组均能促进矿化结节形成,其中以5μmol/L组最显著。表明他莫昔芬可促进hDPSCs成骨/成牙向分化。
成骨细胞和成牙本质细胞可分泌众多矿化基质蛋白如ALP、OCN、BSP和DSPP等,这些基质蛋白在成骨细胞和成牙本质细胞分化过程中均发挥重要的作用。本结果发现,与不加刺激对照组比较,加入他莫昔芬刺激后矿化相关基因ALP、OCN、BSP、DSPPmRNA表达上调,但只有5μmol/L他莫昔芬组作用最显著。表明他莫昔芬能够促进牙髓干细胞的成骨/成牙分化,但具有浓度特异性。本结果与雌激素促进牙髓细胞和牙髓干细胞的骨向分化作用相矛盾,分析原因可能有:①与细胞来源不同有关;②他莫昔芬除抑制雌激素受体外,还可作为细胞自噬的诱导剂,在矿化过程中,他莫昔芬诱导牙髓干细胞自噬是否发挥作用,发挥多大作用,尚需进一步研究证实。
总之,本结果表明低浓度他莫昔芬对牙髓干细胞增殖无明显影响,一定浓度的他莫昔芬对hDPSCs成骨/成牙分化具有促进作用。进一步深入研究他莫昔芬对hDPSCs作用的细胞内分子机制,将有利于探讨临床应用此药物时对牙髓的影响,另外可探索其在牙髓损伤修复或再生中的应用。
[1]Gronthos S,Mankani M,Brahim J,et al.Postnatal human dental pulp stem cells(DPSCs)in vitro and in vivo[J].Proc Natl Acad Sci USA,2000,97(25):13625-13630.
[2]Tomao F,Spinelli GP,Vici P,et al.Current role and safety profile of aromatase inhibitors in early breast cancer[J].Expert Rev Anticancer Ther,2011,11(8):1253-1263.
[3]Lee MH,Kim JW,Kim JH,et al.Gene expression profiling of murine hepatic steatosis induced by tamoxifen[J].Toxicol Lett,2010,199(3):416-424.
[4]HattoriM,Horio A,SawakiM,etal.Assessmentof the clinical efficacy and safety of fulvestrant in heavily pretreated patients with hormone-receptor positivemetastatic breast cancer-a single-institution experience[J].Gan To Kagaku Ryoho,2013,40(13):2535-2538.
[5] 赵斐,谢萍,姜佳丽,等.他莫昔芬体外促进HepG2细胞脂肪变性观察[J].实用肝脏病杂志,2014,17(1):30-33.
[6]Strong AL,Ohlstein JF,Jiang Q,et al.Novel daidzein analogs enhance osteogenic activity of bone marrow-derived mesenchymal stem cells and adipose-derived stromal/stem cells through estrogen receptor dependent and independentmechanisms[J].Stem Cell Res Ther,2014,5(4):105.
[7]Enmark E,Gustafsson Jʎ.Oestrogen receptors-an overview[J].J Intern Med,1999,246(2):133-138.
[8]Ushiyama T,Inoue K,Nishioka J.Expression of estrogen receptor related protein(p29)and estradiol binding in human arthritic synovium[J].JRheumatol,1995,22(3):421-426.
[9]Jeannon JP,Soames JV,Bell H,et al.Immunohistochemical detection of oestrogen and progesterone receptors in salivary tumours[J].Clin Otolaryngol Allied Sci,1999,24(1):52-54.
[10]Parkar MH,Newman HN,Olsen I.Polymerase chain reaction analysis of oestrogen and androgen receptor expression in human gingival and periodontal tissue[J].Arch Oral Biol,1996,41(10):979-983.
[11]Cao M,Shu L,Li J,etal.The expression of estrogen receptors and the effects of estrogen on human periodontal ligament cells[J].Methods Find Exp Clin Pharmacol,2007,29(5):329-335.
[12]Inaba T,Kobayashi T,Tsutsui TW,et al.Expression status of mRNA for sex hormone receptors in human dental pulp cells and response to sex hormones in the cells[J].Arch Oral Biol,2013,58(8):943-950.
[13]JukiçS,PrpiçMehiçiçG,Talan-Hranilov'c J,et al.Estrogen receptors in human pulp tissue[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,2003,95(3):340-344.
[14]Manokawinchoke J,Ritprajak P,Osathanon T,et al.Estradiol induces osteoprotegerin expression by human dental pulp cells[J].Odontology,2014 Sep 26[Epub ahead of print].
[15]Wang Y,Zheng Y,Wang Z,et al.10-7 m 17β-oestradiol enhances odonto/osteogenic potency of human dental pulp stem cells by activation of the NF-κB pathway[J].Cell Prolif,2013,46(6):677-684.
[16]邹自英,袁成良,黄海,等.他莫昔芬影响人垂体腺瘤细胞增殖及其机制[J].中国药理学通报,2005,21(5):614-617.
[17]何丹,谢敏杰,王伟,等.他莫昔芬对星形胶质细胞增殖的作用[J].脑与神经疾病杂志,2012,20(1):1-4.
The effect of tamoxifen on the osteoblastic/odontoblastic differentiation of human dental pulp stem cells in vitro
WANG Juan*,LIU Bao-gang,MA Feng-le,HE Xin-yao,WANG Zhi-hua,HEWen-xi
(*State Key Laboratory of Military Stomatology,Department of Operative Dentistry and Endodontics,School of Stomatology,The Fourth Military Medical University,Shaanxi Key Laboratory of Stomatology,Xi′an 710032,China)
AIM:To investigate the effects of tamoxifen on the osteoblastic/odontoblastic differentiation of human dental pulp stem cells(hDPSCs)in vitro.METHODS:hDPSCs were treated by different concentrations of tamoxifen.Kit-8 assay was applied to assess cell proliferation.Aftermineralization induction culture for 2 weeks,alizarin red S staining was used to observe themineral nodules,themRNA expression of the alkaline phosphatase(ALP),osteonectin(OCN),bone sialoprotein(BSP)and dentin sialophosphoprotein(DSPP)was detected by RT-PCR.RESULITS:Tamoxifen at 10μmol/L inhibited hDPSCs proliferation and lower concentration showed no effect.All concentration of tamoxifen increasedmineral nodule formation of hDPSCs,5μmol/L tamoxifen showed themost significant effect(P<0.05).Furthermore,themRNA expression of ALP,OCN,BSP and DSPPwasmarkedly upregulated by 5μmol/L tamoxifen treatment.CONCLUSION:Tamoxifen promotes mineralization and mineralization-related genes expression and might play a vital role on the differentiation of hDPSCs.
tamoxifen;human dental pulp stem cells;osteoblastic differentiation;odontoblastic differentiation
R780.2
A
1005-2593(2015)05-0294-05
10.15956/j.cnki.chin.j.conserv.dent.2015.05.007
2014-12-19;
:2015-03-31
国家自然科学基金资助项目(81271125,81470733)
王娟(1987-),女,汉族,山西长治人。硕士生(导师:何文喜)
何文喜,E-mail:hewenxi@fmmu.edu.cn
