饲喂沙棘嫩枝叶对绵羊部分脂代谢相关基因mRNA表达量的影响*
2015-04-19刘艳丰王慧媛王文奇侯广田唐淑珍
王 晶,刘艳丰,王慧媛,王文奇,侯广田,唐淑珍
(1.新疆绒毛用羊遗传育种与繁殖重点实验室,新疆 乌鲁木齐 830000;2.新疆畜牧科学院饲料研究所,新疆 乌鲁木齐 830000)
饲喂沙棘嫩枝叶对绵羊部分脂代谢相关基因mRNA表达量的影响*
王 晶1,刘艳丰2*,王慧媛2,王文奇2,侯广田2,唐淑珍1
(1.新疆绒毛用羊遗传育种与繁殖重点实验室,新疆 乌鲁木齐 830000;2.新疆畜牧科学院饲料研究所,新疆 乌鲁木齐 830000)
试验旨在研究饲喂沙棘嫩枝叶对绵羊FAS、HSL、LPL和Leptin基因mRNA表达量的影响。选择60只体重相近健康的6月龄阿勒泰羊随机分成4组,对照组(Con组)饲喂基础日粮,试验组(SJZY-1、SJZY-2和SJZY-3)分别用沙棘嫩枝叶替代2.5%、5.0%和7.5%的麦秸。在试验期第56 d从股二头肌肌肉和肌内脂肪、皮下脂肪、尾部脂肪和腹部脂肪的同一部位取3个重复样本,检测绵羊部分脂代谢相关基因mRNA的表达量。结果表明:与Con相比,试验组腹部脂肪的FAS mRNA、HSL mRNA呈依次降低;SJZY-3尾部脂肪的FAS mRNA和HSL mRNA均增加(P<0.01),SJZY-3的LPL mRNA增加(P<0.05);试验组皮下脂肪的FAS mRNA增加(P<0.05) ,SJZY-2和SJZY-3的LPL mRNA降低(P<0.01);SJZY-3肌内脂肪的FAS mRNA增加(P<0.05),HSL mRNA降低(P<0.05)。试验组的肌肉FAS mRNA和HSL mRNA增加(P<0.01),LPL mRNA增加(P<0.05)。结果提示,沙棘嫩枝叶对绵羊的脂代谢基因mRNA表达量有一定的影响。
沙棘嫩枝叶;绵羊;脂肪酸合成酶;激素敏感性甘油三酯脂肪酶;脂蛋白脂肪酶;瘦素
沙棘为胡颓子科酸刺属的落叶灌木或小乔木,在中国,沙棘属植物分布南起云南西北部和喜马拉雅南坡的亚东,北至新疆阿尔泰山地,东抵内蒙古木盟库伦以东地区,西到帕米尔高原地广大地区[1]。尤其在新疆,总面积达3×104hm2[2]。开发沙棘叶作为一种非常规饲料,资源非常巨大。沙棘叶的粗脂肪(6.70±0.32)%、粗纤维(12.97±0.38)%、总类胡萝卜素(106.67±0.61)mg/100g、维生素B6(1.49±0.03)mg/100g、维生素E(77.16±0.04)mg/100g的含量均高于绿茶[3],并且富含生物活性物质——沙棘叶黄酮[4]。因此,近几年来其产品对人的保健功能及作为功能性动物饲料资源开发受到关注。据研究报道,沙棘叶黄酮可以增加肉鸡腿肌肌内脂肪[5],影响猪的脂肪酸合成酶和瘦素的表达量[6-7]。沙棘嫩枝叶能否促进绵羊的育肥,降低脂肪率[8]?阿勒泰羊尾脂囤积量大,影响羊肉品质,沙棘叶是否具有调节绵羊脂肪合成和沉积的作用?未见研究报道。因此,本试验在前期研究的基础上,旨在通过研究沙棘嫩枝叶对绵羊不同部位的脂肪酸合成酶(fatty acid synthetase,FAS)、激素敏感性甘油三酯脂肪酶(hormone-sensitive lipase,HSL)、脂蛋白脂肪酶(lipoprotein lipase,LPL)和瘦素(Leptin)基因mRNA表达量的影响,探讨沙棘对绵羊脂代谢的分解和沉积的调控作用。
1 材料与方法
1.1 试验材料
沙棘嫩枝叶采自新疆青河县。沙棘嫩枝叶与麦秸的营养水平见表1。
1.2 试验动物和饲养管理
选择体重相近(28±3.5) kg健康的6月龄阿勒泰羔羊60只,随机分成4组,1个对照组和3个试验组(每组3个重复,每个重复5只)。试验前对羊舍进行消毒。试验羊采用按重复群饲,预试期按组打好耳号,免疫注射羊痘、口蹄疫和三联四防苗并进行驱虫。每天饲喂2次,分别为8∶00和19∶00,每次以吃饱略剩料约为10%为准,自由饮水。其他饲养管理措施和免疫接种按羊场的常规进行。在预试期内试验组由基础饲粮逐渐过渡到试验饲粮。试验期间,每天8∶00、13∶00、19∶00和0∶00点分4次监测羊舍内温湿度。
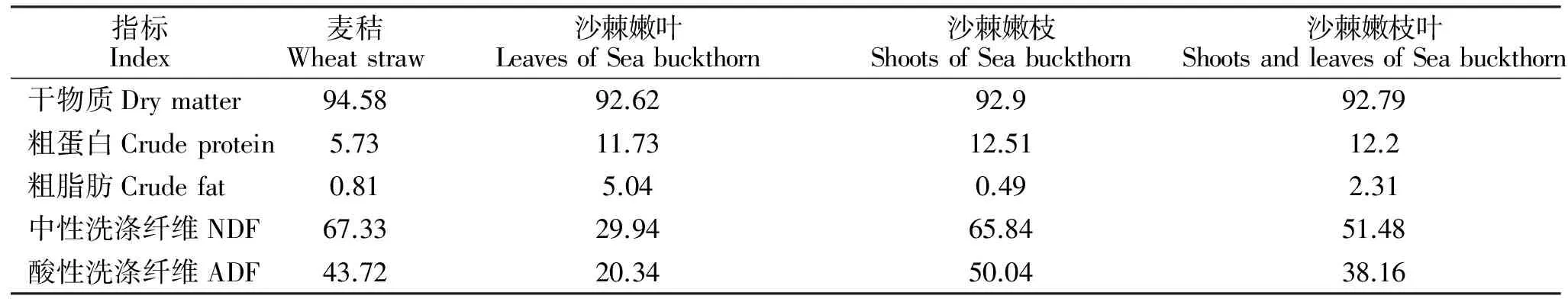
表1 麦秸和沙棘嫩枝叶的营养成分
1.3 试验设计和饲粮
饲粮参照中国肉羊饲养标准(NY/T 816-2004)[9],配制成育肥羊的全混合粉状饲料,其组成及营养水平见表2。对照(Con)组饲喂基础饲粮,试验1组(SJZY-1)、试验2组(SJZY-2)和试验3组(SJZY-3)分别饲喂在基础饲粮中添加2.5%、5.0%、7.5%的沙棘嫩枝叶替代麦秸的饲粮,营养水平见表2。试验预试期7 d,试验期56 d。
1.4 样品采集
在正试期最后一天,每组选取3只体重相近、膘情近似、体高和外貌特征接近的试验羊,共12只进行屠宰。宰前16 h断料,2 h断水。用灭菌活体取样钳快速从每只羊的股二头肌肌肉、肌内脂肪、皮下脂肪、尾部脂肪和腹部脂肪的同一部位取3个重复样本。所取样本分别包于带标记的灭菌锡箔纸中后迅速置于液氮中,带回实验室-80 ℃保存待测。
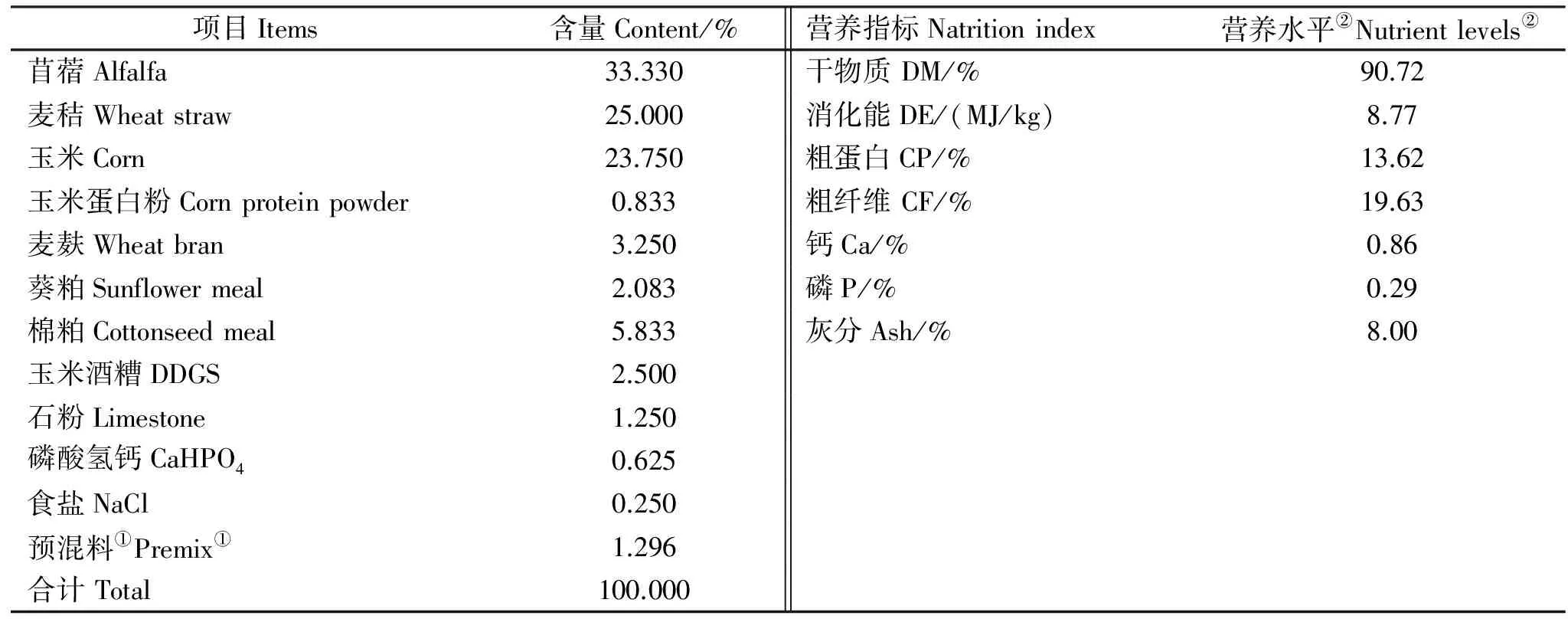
表2 基础饲粮组成和营养水平(风干基础)
注:①预混料为每千克饲料提供: 维生素A 15 000 IU,维生素D 5 000 IU,维生素E 50 mg, Fe 90 mg, Cu 12 mg, Mn 50 mg, Zn 110 mg, Se 0.3 mg, Co 0.5mg。②营养水平除消化能之外,均为实测值。
Note:①Per kg of the premix contained the following: VA 15 000 IU,VD 5 000 IU,VE 50 mg, Fe 90 mg, Cu 12 mg, Mn 50 mg, Zn 110 mg, Se 0.3 mg, Co 0.5mg。②The nutrient levels are values measured, except DE value was through calculation.
1.5FAS、HSL、LPL及Leptin基因mRNA表达量检测
1.5.1 引物设计与合成 根据Gen bank提供的绵羊FAS(DQ223929)、HSL(EU273879.1)、LPL(DQ997818)、Leptin(GU944974.2)以及内参基因(JN412676)的序列,使用Premier 5软件分别设计以上基因引物。引物序列及产物大小见表3。
1.5.2 PCR目的片段扩增、产物回收纯化、克隆测序 以获得的cDNA为模板进行PCR扩增反应,经优化最佳反应条件为: 95 ℃预变性5 min,94 ℃变性30 s,55 ℃(18 s、LPL、FAS、HSL)/52 ℃(Leptin)退火30 s,72℃延伸30 s,共35个循环,然后72℃延伸10 min。反应体系如下:DNA聚合酶Mix 10 μL,cDNA 1 μL,上游引物1 μL,下游引物1 μL,灭菌ddH2O 7 μL,总反应体系为20 μL。将PCR扩增产物在1%琼脂糖凝胶电泳进行电泳,用DNA胶回收试剂盒(北京鼎国)回收纯化目的片段。

表3 目的基因引物参数
将回收的目的基因FAS、HSL、LPL、Leptin和18s产物连接到PMD-18T载体上,并转化到JM109感受态细胞中,然后进行质粒提取。将PCR鉴定为阳性的菌落制成甘油菌,送往上海生工公司测序。利用Bio Edit软件将测序结果与Gen Bank上已知绵羊的FAS、HSL、LPL、Leptin和18 s配序列进行比对分析。对比对一致的菌液进行质粒提取,并检测。
1.5.3 荧光定量PCR反应 分光光度仪测定OD260/OD280比值在1.8-2.0之间的质粒可以用于构建标准品。使用 TB(pH 8.0)作稀释液,将所提取的质粒进行 1,10-1,10-2,10-3,10-4,10-5,10-6,10-7,10-8,10-9,10-10,10-11,10-12,10-13,10-14的梯度稀释。
对反转录的cDNA带标准品进行绝对定量PCR。反应体系为:SYBR Green I 1 μL,2×Mix 12.5 μL,cDNA 1 μL,上游引物0.5 μL,下游引物0.5 μL,,ddH2O 9.5 μL,总反应体系25 μL。采用两步法以提高特异性,反应程序为:95 ℃预变性1 min,95 ℃变性15 s,60 ℃退火30 s,总共40个循环。62 ℃到95 ℃进行溶解曲线分析,每隔0.3 ℃读板一次。
1.6 数据统计与分析
荧光定量PCR中,对目的基因以及管家基因,每个样本3个重复,结果取平均值。每个样本相对表达量的值等于目的基因的表达量均值除以管家基因的表达量均值,即获得目的基因的一个相对比值,用以表示相应基因mRNA水平。试验数据用Excel 2007初步整理和计算后,采用SPSS 19.0进行单因子方差分析,并使用Duncan法进行多重比较,以P<0.05、P<0.01为差异显著、差异极显著。结果以“平均值±标准误”表示。
2 结果与分析
2.1 荧光定量PCR结果
这5个基因的标准曲线均存在一个极高的相关系数(R2>0.99),表明标准品构建的准确性;18s、FAS、HSL、LPL和Leptin基因的质粒DNA的扩增效率分别为0.9962、0.9970、0.9991、0.9941及0.9981,均在要求的范围内;同时扩增曲线显示引物的特异性良好,故该标准曲线具有很好的代表性;各基因的熔解曲线中都只出现一个主峰,无非特异性杂峰,因此定量准确。
2.2 定量结果数据处理及分析
从表4可以看出,在腹部脂肪中,Con组与其它组比较FAS mRNA、HSL mRNA均为最高(P<0.01)。在尾部脂肪中,SJZY-3的FAS mRNA和HSL mRNA均高于Con组(P<0.01),SJZY-3的LPL mRNA高于Con(P<0.05),SJZY-1组Leptin mRNA表达量与SJZY-3组差异显著(P<0.05)。在皮下脂肪中,SJZY-1、SJZY-2和SJZY-3组FAS mRNA高于Con组(P<0.05);SJZY-2、SJZY-3组 LPL mRNA低于Con组(P<0.01),其它指标无明显差异(P>0.05)。在肌内脂肪中,SJZY-3组FAS mRNA高于Con组(P<0.05);SJZY-3组HSL mRNA低于Con组 (P<0.05)。在肌肉中,SJZY-1、SJZY-2和SJZY-3组FAS mRNA和HSL mRNA高于Con (P<0.01);SJZY-1、SJZY-2和SJZY-3组LPL mRNA均高于Con (P<0.05)。
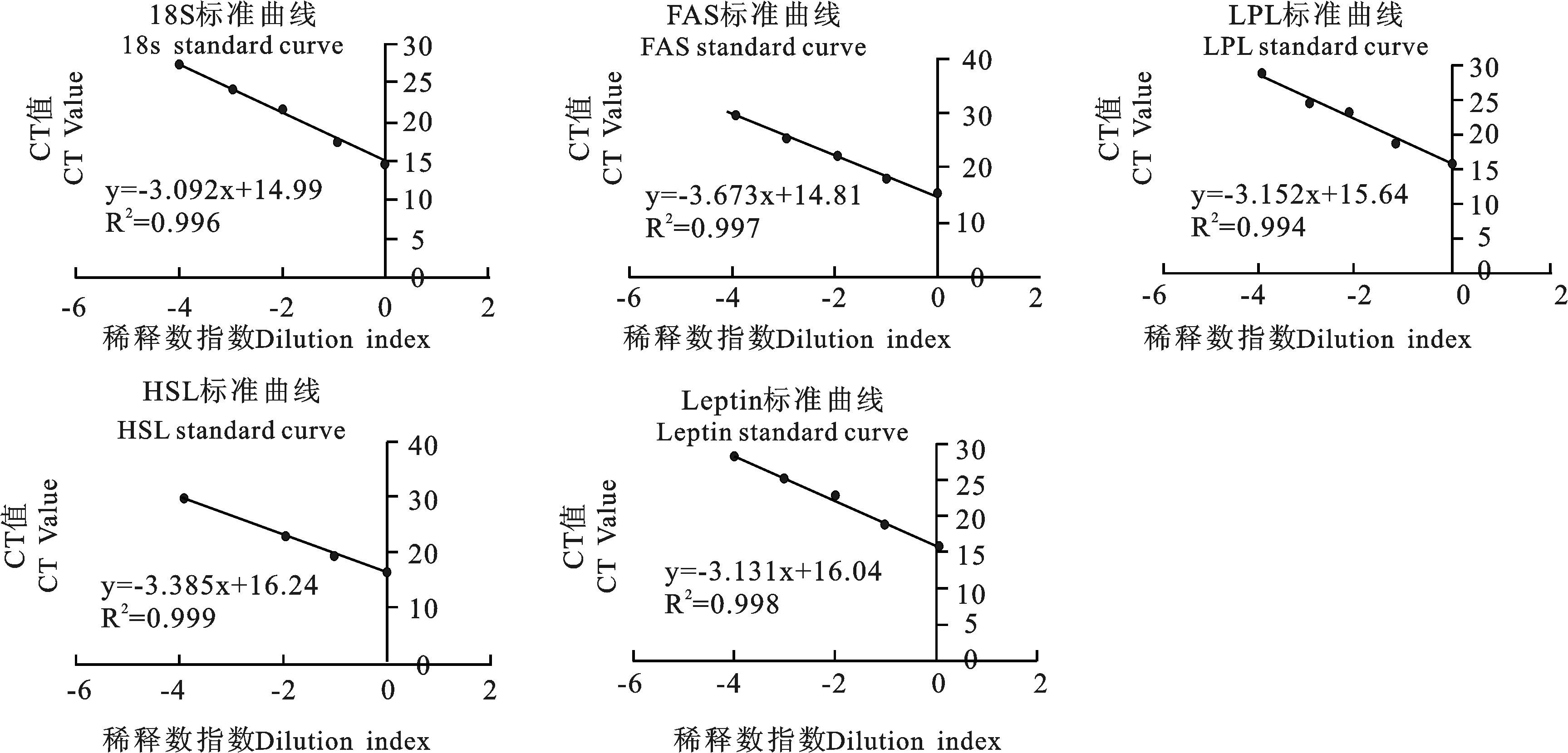
图1 标样和目的基因的标准曲线图

部位测定指标Index对照组Con试验1组SJZY⁃1试验2组SJZY⁃2试验3组SJZY⁃3腹部脂肪BellyfatFAS/18S丰度(Qty∗,copies/μL)3.05A±0.142.46Ba±0.121.93Bb±0.041.91Bb±0.02LPL/18S丰度Qty∗,copies/μL)3.44ab±0.125.65a±0.112.45b±0.062.17b±0.05HSL/18S丰度(Qty#,copies/μL)7.08A±0.155.09Ba±0.114.01Bab±0.243.62Ba±0.17Leptin/18S丰度(Qty#,copies/μL)1.78ab±0.072.97a±0.181.27ab±0.111.11b±0.16尾部脂肪TailfatFAS/18S丰度(Qty∗,copies/μL)1.74B±0.041.93B±0.025.30AB±0.087.32A±0.07LPL/18S丰度Qty∗,copies/μL)1.26b±0.033.38ab±0.053.93ab±0.005.48a±0.05HSL/18S丰度(Qty#,copies/μL)4.16C±0.018.65BC±0.0112.51AB±0.0217.13A±0.07Leptin/18S丰度(Qty#,copies/μL)1.81a±0.041.68a±0.053.13a±0.043.35a±0.05皮下脂肪SubcutaneousfatFAS/18S丰度(Qty∗,copies/μL)3.23b±0.038.00a±0.139.52a±0.209.29a±0.14LPL/18S丰度Qty∗,copies/μL)28.27A±0.3222.30A±0.212.34B±0.133.36B±0.1HSL/18S丰度(Qty#,copies/μL)7.02a±0.117.27a±0.145.38a±0.128.19a±0.08Leptin/18S丰度(Qty#,copies/μL)0.76a±0.121.28a±0.250.61a±0.170.86a±0.16肌内脂肪IntramuscularfatFAS/18S丰度(Qty∗,copies/μL)0.88b±0.021.06ab±0.051.64ab±0.072.02a±0.06LPL/18S丰度Qty∗,copies/μL)2.81a±0.012.98a±0.043.91a±0.053.67a±0.03HSL/18S丰度(Qty#,copies/μL)1.29Aa±0.031.19ab±0.021.05b±0.040.30Bc±0.01Leptin/18S丰度(Qty#,copies/μL)2.56a±0.082.78a±0.103.43a±0.093.23a±0.12肌肉MuscleFAS/18S丰度(Qty∗,copies/μL)1.28C±0.095.06B±0.127.81ABb±0.1612.32Aa±0.12LPL/18S丰度Qty∗,copies/μL)2.00b±0.024.26a±0.054.42a±0.084.53a±0.13HSL/18S丰度(Qty#,copies/μL)5.33B±0.2014.31A±0.4221.28A±0.5510.35A±0.31Leptin/18S丰度(Qty#,copies/μL)4.25a±0.085.68a±0.075.40a±0.074.60a±0.05
注: *表示×105;#表示×104;同行肩标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。下同。
Notes: * indicate×105; # indicate×104;in the same line, the same lowercase superscripts indicate insignificant difference (P>0.05), different lowercase superscripts indicate significant difference (P<0.05),and different capital superscripts indicate extreme difference (P<0.01).The same below.
同一组羊不同部位的同一基因的mRNA合并,结果见表5。由表5可知,将各部位的数据综合后,SJZY-3组FAS mRNA和HSL mRNA显著高于Con组 (P<0.05),leptin mRNA和LPL mRNA 差异不显著(P>0.05)。

表5 沙棘嫩枝叶对绵羊基因mRNA表达量的影响
3 讨 论
FAS是脂肪酸合成反应的一个关键酶。FAS表达水平的升高能够增加甘油三脂在体内的沉积而导致肥胖[10]。据熊文中等研究发现,猪脂肪组织中FAS与胴体脂肪量、胴体的脂肪率呈极显著正相关[11]。FAS基因的表达又直接影响着脂肪酸合成酶多寡。单体中等[12]和姚国佳等[13]都证实了随着猪脂肪沉积量的增加,FAS基因在腹部脂肪、皮下脂肪中的表达量呈逐渐增加的趋势。李正娟利用滩羊进行试验,指出日粮能量能够影响FAS mRNA表达量的水平(P<0.05)[14],张英杰等[15]也证实了日粮蛋白水平也有此作用。本试验不同部位不同添加量沙棘嫩枝叶对绵羊FAS mRNA的趋势影响不同,腹部脂肪表现为下降趋势,在皮下脂肪、尾部脂肪、肌内脂肪和肌肉和整个胴体中均表现为增加趋势,表明沙棘嫩枝叶可能促进肌内脂肪和肌肉中脂肪酸的沉积,从而改善绵羊肉品质,同时表明检测部位、添加量也是影响表达效果的因素,并不是预想的单纯降低表达量、抑制脂肪沉积作用。
LPL则是能够催化低密度脂蛋白和乳糜微粒中的甘油三酯水解为游离脂肪酸的酶类,也是脂质代谢的关键酶[16]。Leptin是肥胖基因(ob)的表达产物,被认为是由脂肪细胞分泌的激素,在动物体内具有调节体重、脂肪沉积和摄食行为等功能[17]。Leptin基因既可以促进甘油三酯的分解,又能够抑制脂肪酸合酶的表达[18]。在本试验中,LPL mRNA表达量在肌肉和尾部脂肪中表现出明显增加的趋势,在腹部脂肪和皮下脂肪呈下降趋势。反刍动物体内脂肪的合成途径有两条:第一条途径为甘油三酯(triaglycerol, TAG)的合成,LPL是此途径的主要酶;第二条途径为脂肪酸的从头合成,脂肪酸的从头合成的一个重要的酶促反应脂肪酸合成酶(fatty acid synthase, FAS)催化乙酰辅酶A和丙二酸单酰辅酶A转变成长链脂肪酸。表明皮下脂肪的合成中,以第二条途径为主。尾部脂肪中LPL mRNA表达量升高,而皮下脂肪中LPLLPL mRNA表达量则降低?同为脂肪组织,为何添加沙棘嫩枝叶引起的作用完全相反,需要进一步研究验证。
HSL在体内脂质和能量代谢中发挥关键作用,它是发动脂肪组织中甘油三酯分解的关键酶和限速酶,负责分解脂肪组织中甘油三酯释放出游离脂肪酸,是调控脂肪组织分解的最关键因素,也是影响动物脂肪沉积的关键酶之一,其活性受多种激素的调控[19]。在本试验中,HSL mRNA表达量在腹部和肌内脂肪中表现下降,尾部和肌肉中表现上升趋势。表明饲喂沙棘嫩枝叶可能促进绵羊肌内脂肪的沉积,但在腹部脂肪,脂肪分解酶和合成酶的活性均下降,在皮下脂肪、肌肉和总体综合中,脂肪分解酶和合成酶的活性均上升(FAS和HSL),但到底是脂肪合成酶还是分解酶起主导作用,还需进一步研究。
4 结 论
在本试验条件下,沙棘嫩枝叶对绵羊脂类基因 mRNA表达有一定的影响,但表达量与剂量没有线性相关性,FAS mRNA表达量在腹部脂肪表现为下降趋势,在皮下脂肪、尾部脂肪、肌内脂肪和肌肉中均表现为增加趋势;HSL mRNA表达量在腹部和肌内脂肪中表现下降,尾部和肌肉中表现上升趋势,表明饲喂沙棘嫩枝叶可能促进绵羊肌内脂肪的沉积,但肌肉中FAS mRNA和HSL mRNA哪种起主导作用还需进一步研究。
LPL mRNA在肌肉和尾部脂肪中表现出明显增加的趋势,在腹部脂肪和皮下脂肪呈下降趋势,表明皮下脂肪的合成以FAS 为主。Leptin mRNA表达量在各部位无明显变化。
[1] 刘锡建.总黄酮的提取、精制和抗氧化性能的研究[D].北京:北京化工大学,2004.
[2] 新疆维吾尔自治区林业厅.新疆沙棘资源及其利用情况[J].防护林科技,1995(4):55-63.
[3] 张 粲.植物蛋白的开发与利用[D].北京:北京林业大学,2012.
[4] 高锦明,张鞍灵,李芸生,等.沙棘叶黄酮化学研究进展[J].沙棘,1998,11(2):34-40.
[5] 赵 伟,陈 鑫,刘红南,等.沙棘叶黄酮对肉鸡生长性能及胴体品质的影响[J].动物营养学报, 2012, 24(1): 117-123.
[6] 夏 蕾,张志宏,左金国,等.沙棘提取物对猪脂肪中部分脂肪代谢相关基因表达的影响[J].营养学报, 2009, 31(2): 177-180.
[7] 张志宏,夏 蕾,陈 鑫,等.早期饲喂沙棘提取物对猪生长性能、肉品质和血清Leptin水平及脂肪Leptin mRNA表达的影响[J]. 动物营养学报,2009,21(5): 734-740.
[8] 刘艳丰,唐淑珍,张文举,等.沙棘嫩枝叶对绵羊瘤胃发酵特性和血清免疫指标的影响.动物营养学报, 2014,26(9): 163-170.
[9] 中华人民共和国农业部.NY/T 816-2004肉羊饲养标准[S].北京:中国农业出版社,2004.
[10] Semenkovich C F. Regulation of fatty acid synthase (FAS)[J]. Progress in Lipid Research, 1997, 36: 43-53.
[11] 熊文中,杨 凤,周安国.猪重组生长激素对不同杂交肥育猪脂肪代谢调控的研究[J].畜牧兽医学报, 2001, 32(1): 1-4.
[12] 单体中,汪以真,刘建新,等.不同日龄猪腹脂中脂肪酸合成酶(FAS)基因表达规律的研究[J].畜牧兽医学报, 2006, 37(7):662-666.
[13] 姚国佳,单体中,汪以真,等.脂肪酸合成酶基因在皮下脂肪中表达及其与血清Leptin的关系[J].农业生物技术学报,2006, 14(5): 818-819.
[14] 李正娟.日粮能量水平对滩羊肌内两种脂肪酶基因表达的影响[D].宁夏 银川:宁夏大学,2013.
[15] 张英杰,刘月琴,刘景云.日粮不同蛋白水平对绵羊脂肪和肌肉中FAS基因表达的影响[J].畜牧兽医学报, 2010, 41(7): 829-834.
[16] 刘翔宇,尹卫东,唐朝克.脂蛋白酯酶与糖尿病心肌病[J].生理科学进展, 2014,41(1): 16-20.
[17] Zhang Y Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue[J].Nature, 1994, 372(6505):425-432.
[18] 杨东英.Leptin基因的研究进展[J].中国牛业科学, 2013,39(6): 45-48,53.
[19] 孙亚丽,邹晓庭.动物激素敏感脂肪酶在畜牧业中的应用前景[J].中国饲料, 2004(9):5-7.
Part of Lipid Metabolism Gene mRNA Expression of Sheep Fed with Shoots and Leaves of Sea Buckthorn
WANG Jing1, LIU Yan-feng2*, WANG Hui-yuan2, WANG Wen-qi2, HOU Guang-tian2,TANG Shu-zhen1
(1.XinjiangKeyLaboratoryofCashmereSheepGeneticBreedingandReproduction,XinjiangAcademyofAnimalScience,Urumqi,Xinjiang83000,China; 2.FeedReasearchInstitute,XinjiangAcademyofAnimalScience,Urumqi,Xinjiang83000,China)
This experiment was conducted to study shoots and leaves of sea buckthorn on fatty acid synthase (FAS), hormone sensitivity triglyceride lipase (HSL), lipoprotein lipase (LPL) and Leptin gene mRNA expression of sheep.Sixty 6 months-old health Altay sheep with similar weight were selected and randomly divided into 4 groups (each group with three repeat, and 5 sheep each repeat). Control group (Con) were fed a basal diet, and wheat straw in the basal diet was replaced by shoots and leaves of sea buckthorn at 2.5% (SJZY-1 group), 5.0% (SJZY-2 group), and 7.5% (SJZY-3 group). On day 56 of formal trial, 3 sheep per duplicate in each group with similar weight were randomly selected to collected biceps muscle and intramuscular fat and subcutaneous fat and tail fat and belly fat. The results show as follows:compared with the Con,FAS mRNA and HSL mRNA of abdominal fat in test groups gradually reduce; FAS mRNA expression and HSL mRNA expression and LPL mRNA expression of tail fat in SJZY-3 were significantly higher. FAS mRNA expression of subcutaneous fat in test groups were significantly higher. LPL mRNA expression of subcutaneous fat in SJZY-2 and SJZY-3 were significantly decreased. FAS mRNA expression of intramuscular fat in SJZY-3 was significantly higher, and HSL mRNA expression of intramuscular fat in SJZY-2 and SJZY-3 were significantly decreased. FAS mRNA expression and HSL mRNA expression of muscle in SJZY-1 and SJZY-2 and SJZY-3 groups were significantly higher. FAS mRNA expression and HSL mRNA expression of carcass in SJZY-3 were significantly higher. The results indicate that shoots and leaves of sea buckthorn has impact on lipid metabolism related genes mRNA expression,but different mRNA expression has no linear relationship on dose; feeding shoots and leaves of sea buckthorn can promote deposition of intramuscular fat of sheep.
shoots and leaves of sea buckthorn; sheep; fatty acid synthase; triglyceride lipase hormone sensitivity; lipoprotein lipase; leptin
2015-04-01
2015-05-20 [基金项目] 新疆维吾尔自治区公益性科研院所基本科研业务经费资助项目(KY2012015);国家现代肉羊产业技术体系(nycytx-39); 国家科技支撑计划课题(2012BAD13B03);新疆维吾尔自治区科研机构创新发展专项资金项目(2012027)
王 晶(1983-),女,宁夏海源人,助理研究员,研究方向:绵羊营养与繁殖。E-mail:4459247@qq.com
*[通讯作者] 刘艳丰(1981-),男,湖南临湘人,副研究员,研究方向:饲料资源开发与利用。E-mial: liuyanfeng520 @sina.com
S811.6
A
1005-5228(2015)09-0020-06
