常态下仙人掌科植物负离子释放量的比较及其与刺数量的关系
2015-04-18张万超郑金贵黄龙飞时顺锋吴仁烨邓传远
张万超, 郑金贵, 黄龙飞, 时顺锋, 吴仁烨, 邓传远
(1.福建农林大学园林学院;2.福建农林大学农产品品质研究所,福州 350002)
常态下仙人掌科植物负离子释放量的比较及其与刺数量的关系
张万超1, 郑金贵2, 黄龙飞1, 时顺锋1, 吴仁烨2, 邓传远1
(1.福建农林大学园林学院;2.福建农林大学农产品品质研究所,福州 350002)
在常态下的密闭玻璃箱(800 mm×800 mm×800 mm)内测定和比较了32种(含种下分类单位及品种)仙人掌科植物产生的负离子浓度,并通过去刺试验研究了2种仙人掌科植物刺的数量与负离子产生浓度的关系.结果表明:大部分植物在自然状态下能产生负离子,产生负离子浓度低,且不同种类产生负离子浓度有差异.研究植物负离子产生浓度受空气中负离子浓度值影响,且金琥(Echinocactusgrusonii)和银手指(Mammillariagracilisvar.fragilis)负离子产生浓度与刺的数量呈显著正相关.
负离子; 仙人掌科植物; 常态
空气负离子(negative air ion,简称NAI )被誉为“空气维生素”,对人体一些疾病有辅助治疗作用,还能降尘杀菌、清除有害气体[1-3].由于植物具有向大气释放负离子的能力[4,5],因此,关于植物源负离子的研究不断开展,特别是近年来室内污染加剧,治理室内空气污染,解决“病态建筑物综合症”,已成为社会发展迫切需要解决的问题,有鉴于此,作为室内美化和装饰用的盆栽植物负离子释放能力及生态效益研究受到重视.研究表明,单株盆栽植物负离子产生浓度不高,生态效益有限,且不同种类(品种)释放负离子能力差异大[6,7];自然状态下植物释放负离子与植物的形态特征(如叶片的尖端放电)有关[8],也与植物的生理活动(如光合作用等)有关[6,8],且受多种环境因子的影响[9-12].
仙人掌科(Cactaceae)植物种质资源丰富,由于抗辐射能力较强广泛用作室内装饰,同时其营养器官变态为刺,是尖端丰富的植物[13].关于仙人掌科不同种或品种在自然状态下产生负离子浓度的能力已有报道[8],但这些报道仅局限于初步的测量,外界环境因子对实验结果的影响考虑不足,涉及到仙人掌科植物形态丰富的刺是否有利于尖端放电提高负离子产生浓度的研究很少,仅艳珠球(Mammillariaspinosissima‘Pico’)有报道[14],已有研究也常把仙人掌科植物与其他不同科植物产生负离子浓度的差异进行比较[8],对亲缘关系近的同科属仙人掌类植物的比较研究较少,本研究以仙人掌科32种(含种下分类单位及品种)植物为研究对象,检测在自然状态下产生负离子的差异,并对2种仙人掌科植物刺数量与负离子释放量的关系进行研究,以期为具生态效应的室内美化植物的选择提供依据.
1 材料与方法
1.1 试验材料
1.1.1 仙人掌科植物负离子释放能力研究试材 仙人掌科32种(含种下分类单位及品种)植物(表1)购于福建漳州花农苗圃.研究表明,植物负离子释放量与植株形态、年龄和生理状态有关[4,5].因此,试验材料选自试验人员指导花农控制水肥及农药喷施培育的3年生植物,尽量消除同种株间的形态和生理差异.
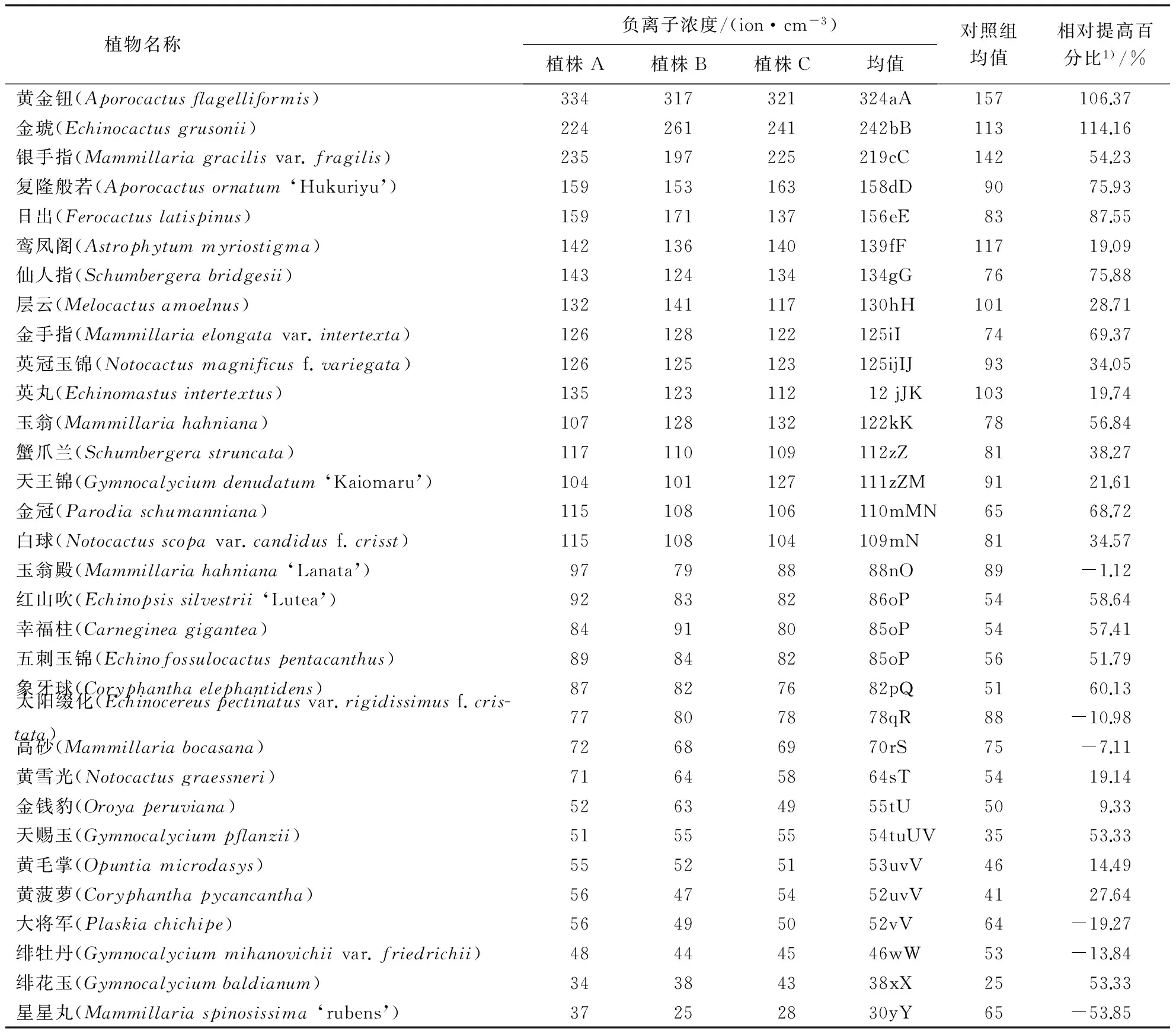
表1 32种仙人掌科植物自然状态下密闭空间中产生负离子浓度及显著性检验
1)相对提高指试验组浓度均值相对于空白对照浓度均值提高的百分比.均值一列数据中小写字母不相同表示多重比较结果差异显著(P<0.05),大写字母不相同的表示多重比较结果差异极显著(P<0.01).
1.1.2 仙人掌科植物小窠和刺数量与负离子释放量关系研究试材 仙人掌科植物常具棱、角、瘤突,小窠(areoles)螺旋状散生,或沿棱、角或瘤突着生,且常有腋芽或短枝变态形成的刺从小窠发出,因此具有较好的曲率半径,具尖端放电效应,可能是负离子来源之一[15,16].选择同科具有硬刺的金琥(Echinocactusgrusonii)和具有软刺的银手指(Mammillariagracilisvar.fragilis)进行去刺处理,用于研究仙人掌科植物小窠和刺数量与负离子释放量的关系.
1.2 试验时间、地点及环境条件
研究表明,植物负离子释放量与光照等外界气候因子有关[4,5].鉴于此,试验选择2011年9月中旬至2011年10月底的晴朗、干爽、无风的天气在室内环境中进行.室内平均温度24±3 ℃,相对湿度75±10%,光照强度1500±200 lx.
由于植物负离子释放随着光照强度的不同而波动[5],因此,每种植物负离子的测定和除刺处理植物负离子的测定统一在每天的7:30到18:30完成,以此段时间的平均值作为不同种植物负离子的释放量.
1.3 方法
1.3.1 主要仪器与试验装置设计 试验选择DLY-4G-232型大气离子测量仪,其测量范围为1-1.999×109ion·cm-3,通过数据线可连接计算机读取数据.为了排除外界环境对负离子测定的影响(风及其引起湿度、温度的变化),本试验中植物负离子释放浓度的测定是在由厚度4 mm的有机玻璃制成800 mm×800 mm×800 mm规格、具较好保温、保湿性能,无可觉察的空气流动的玻璃箱内进行的.在箱体一个侧面截取104 mm×104 mm的正方形小口,使该方形小口与空气离子测量仪的测量进风口大小相吻合,未测量时用玻璃挡板封闭窗口.
1.3.2 仙人掌科植物的负离子释放 由于盆栽植物和土壤都具有释放负离子的能力[4],因此实验设置3个重复,共3株,以放置玻璃室且拔除植物的盆土为对照,于室内同一环境条件下,同时测量每种植物实验组和对照组的释放负离子浓度.
选择仪器读数的时间为45 min,每30 s读取一个数据;结束后重新调零,并把玻璃箱内植物原位置旋转90°,继续测量45 min,每株植物的每个侧面重复测3次,以减少误差,共读取1080个有效数据.取平均值作为该株植物释放的负离子浓度,取3株植物的负离子数据的平均值作为该种植物释放的负离子浓度.
1.3.3 仙人掌科植物小窠和刺数量与负离子释放量的关系 统计小窠数,将总小窠数除以7,得到的整数即每次约剪去刺的小窠数(共去刺7次);用剪刀从顶端向下一圈一圈剪去小窠中的刺,统计每次剪去的刺数.因此,每个研究对象共有8个处理,即不做剪除处理具完整刺的金琥和银手指,分6次依次剪去金琥、银手指1/7小窠中刺的处理,及剪光刺的金琥、银手指.
每种植物每种处理3个重复,于3个玻璃室中放置于室内同一环境条件下测定.
1.4 统计分析
应用SPSS统计分析软件对负离子浓度进行方差分析、LSD多重比较、线性回归分析等统计分析.
2 结果与分析
2.1 仙人掌科植物负离子含量分析
测定的32种仙人掌科植物中有26种实验组负离子浓度均值大于对照组(表1).其中负离子浓度均值最高的黄金钮为324 ion·cm-3,较对照组提高了106.37%,其次为金琥,其负离子浓度均值为242 ion·cm-3,较对照组提高了114.16%.
6种研究植物负离子浓度均值低于空白对照组.其中,星星丸均值为30 ion·cm-3,较对照组下降了53.81%,下降的幅度最大,其次是大将军,下降了19.27%.
对实验组与对照组负离子浓度进行配对t检验,分析两者间的差异,结果表明,实验组与对照组负离子浓度均值相关系数为0.867,t值为4.482,相对应的显著性P值为0,相伴概率P值为0,两者P值均小于极显著水平.由此可见实验组负离子浓度极显著大于空白对照组负离子浓度,且植物在自然状态下释放负离子浓度与空气中本身的负离子浓度之间有极显著的相关性.
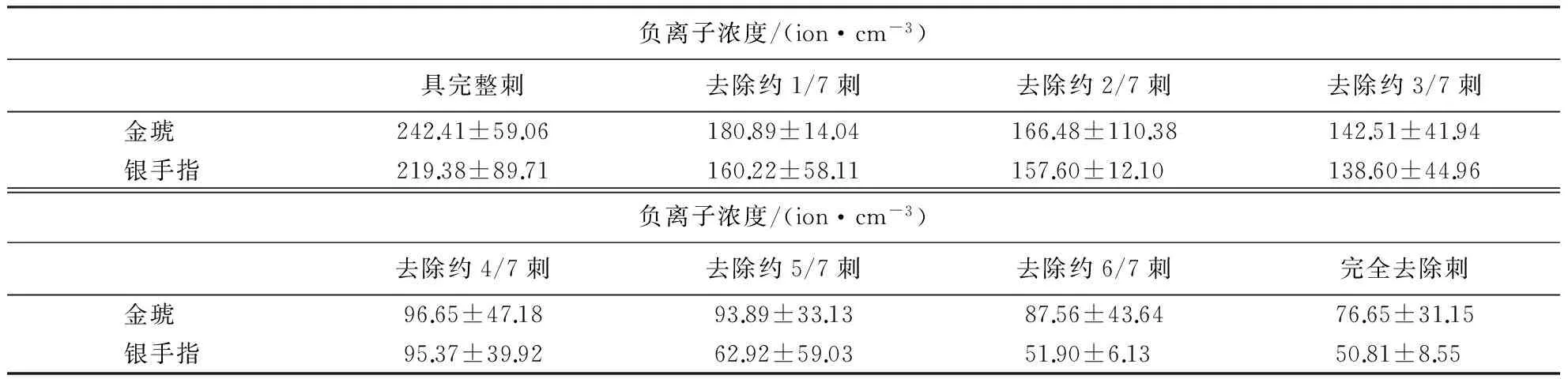
由不同植物与重复试验的双因素方差分析可知常态下植物种类对仙人掌科植物产生负离子浓度存在极显著影响(P<0.01),重复试验处理对研究植物产生负离子浓度影响不显著(P>0.05),但常态下不同植物和重复试验两因素对植物产生负离子存在极显著交互影响(P<0.01),也可能是由于影响研究植物产生负离子的因素中植物种类起主导作用.LSD多重比较分析表明,496对不同植物组合常态下负离子产生浓度差异性比较中,有13对组合无显著差异(P>0.05),即13对植物组合常态下密闭玻璃箱内产生负离子浓度没有显著性差异(P>0.05),分别是大将军与黄菠萝 (P>0.05)、大将军与黄毛掌(P>0.05)、黄菠萝与黄毛掌(P>0.05)、黄菠萝与天赐玉 (P>0.05)、黄毛掌与天赐玉(P>0.05)、天赐玉与金钱豹(P>0.05)、幸福柱与五刺玉锦 (P>0.05)、幸福柱与红山吹(P>0.05)、五刺玉锦与红山吹(P>0.05)、白球与金冠(P>0.05)、天王锦与蟹爪兰(P>0.05)、英丸与英冠玉锦(P>0.05)、英冠玉锦与金手指 (P>0.05);有3对组合具显著差异(0.01 2.2 小窠和刺数量与负离子释放量的关系 选择常态下密闭玻璃箱内负离子产生浓度较高的2种植物为试验材料,即金琥和银手指,通过去叶刺处理(详见1.4.2)研究刺丛、叶尖数量与负离子产生浓度的关系(表2、表3). 表2 金琥、银手指逐步去刺处理各阶段刺和小窠数量1) 1)表格中小窠数量和刺数量的均值和标准差是根据试验中3个重复处理的3株植物统计而来. 表3 除刺各阶段金琥、银手指的负离子浓度 对金琥和银手指分别进行双因素方差分析,以探究剪刺处理和重复试验对研究植物释放负离子的影响.结果表明:常态下重复处理对金琥产生负离子不存在显著影响(P>0.05),但剪刺处理对金琥产生负离子存在极显著影响(P<0.01),重复和剪刺处理对金琥产生负离子有极显著交互影响(P<0.01),这可能是由于剪刺处理的影响起主导作用的结果.基于双因素方差分析的结果,对金琥的各剪刺处理进行LSD多重比较分析,结果表明,28对剪刺处理组合具极显著性差异(P<0.01).银手指的双因素方差分析表明,常态下重复处理对银手指产生负离子不存在显著影响(P>0.05),但剪刺处理对银手指产生负离子存在极显著影响(P<0.01),重复和剪刺处理对银手指产生负离子有极显著交互影响(P<0.01),这也可能是剪刺处理对银手指释放负离子的影响起主导作用.根据双因素方差分析的结果,对银手指的各剪刺处理进行LSD多重比较分析.结果表明,28对剪刺处理组合中仅第2次与第3次处理差异不显著(P>0.05),第7次与第8次剪刺处理差异不显著(P>0.05),其余各对处理均具极显著性差异(P<0.01).对金琥和银手指分别进行多元回归分析.结果表明:随着小窠和刺数量的减少,常态下密闭玻璃箱内2种植物负离子产生浓度逐渐降低,金琥负离子产生浓度与小窠和刺数量建立的全回归方程模型为:Y=51.687+0.291X1+0.034X2(其中,Y为负离子浓度,X1为小窠数量,X2为刺数量,R=0.879,P<0.01),银手指负离子产生浓度与小窠和刺数量建立的全回归方程模型为:Y=31.492+0.020X1+0.009X2(其中,Y为负离子浓度,X1为小窠数量,X2为刺数量,R=0.943,P<0.01). 测定的32种仙人掌科植物中,实验组负离子浓度极显著大于空白对照组负离子浓度,说明仙人掌科植物具有向空气中释放负离子的能力,这与前人的研究结果较为一致.根据相关研究可知,空气中负离子大于1000 ion·cm-3时才具有保健功能[17],研究植物产生负离子浓度最高的黄金钮仅为324 ion·cm-3,相对于人体健康水平的最佳值,此值严重偏低.因此,在正常情况下,单株植物释放负离子的能力很弱,其引起的生态效应极为有限. 对实验组与对照组负离子浓度进行配对t检验,相关系数为0.867,相伴概率P值为0.000,小于极显著水平.说明仙人掌科植物释放负离子的能力与空气中负离子含量的背景值有关,可能是由于在自然条件下,空气负离子的成分也是植物所处环境微气候的重要组成,植物能吸收空气负离子促使植物光习性变化,进而引起光合作用等生理活动发生变化[18].同时,自然条件下,植物也能产生负离子[4,5],这种交互影响可能是仙人掌科6种植物实验组负离子浓度相对提高百分比为负值的原因之一. 测定的32种植物中,通过方差分析可知常态下不同研究植物产生负离子浓度存在极显著差异(P<0.01),且基于双因素方差分析的结果,植物种类对研究植物产生负离子起主导作用,LSD多重比较分析表明:496对不同植物组合常态下负离子产生浓度差异性比较中,仅11对植物组合常态下密闭玻璃箱内产生负离子浓度差异不显著(P>0.05),其余485对植物组合常态下密闭玻璃箱内产生负离子浓度具显著差异(P<0.05)或极显著差异(P<0.01).统计分析结果倾向支持研究的仙人掌科植物在自然状态下释放负离子的能力存在差异,但由于空气中负离子含量背景值的交互影响,消除空气中负离子含量的背景值进行测定可能更能说明问题. 通过逐步去刺处理实验,本研究表明随着小窠和刺数量的减少,常态下密闭玻璃箱内金琥和银手指负离子产生浓度逐渐降低,负离子释放量与刺呈显著正相关.有鉴于此,本研究认为,仙人掌科等具刺的植物常态下释放负离子可能的主要机理是:刺的尖端放电在叶片周围大气中产生低温等离子体,其中的高能电子和大气中以及叶片气孔蒸腾中发出的O2和H2O分子碰撞产生NAI.虽然许多研究结果表明叶形态结构的几何参数可能不是决定植物释放负离子能力的主要因素[4,5,15,16].但由本研究结果可知,不同仙人掌科植物释放负离子的能力不仅与植物光合作用、呼吸作用和蒸腾作用等有关系,刺作为尖端放电产生低温等离子体的部位和等离子体的释放通道,也与负离子的产生有较大关系. 本研究通过测定仙人掌科植物在常态下密闭环境中释放负离子的浓度,筛选出高效释放负离子仙人掌科植物,为今后进一步发掘室内植物释放负离子的潜力研究奠定基础.但综合最新进展,仙人掌科植物释放负离子的研究可以从以下方面进一步展开:(1)本研究应用的部分试验植物其常态下负离子释放量已有报道,与前人的研究比较,负离子产生浓度的数值有一定的差异,同种(或同品种)植物负离子产生浓度的差异,可能是不同实验条件下(如测定时间或外界气候因子不同)进行测定造成的,即受外界环境因素影响,仙人掌科植物负离子产生受外界因素影响,也受内因影响(种类不同等),还受刺的数量多少制约,因此,仙人掌科植物负离子产生机制值得进一步研究.(2)有研究表明植物释放负离子与是植物光合作用的光反应阶段有关,但光照强度与植物释放负离子的关系有待进一步研究.(3)植物释放负离子的研究是为了更好地创造良好的室内环境,已有研究表明,高压脉冲电场能高效促进仙人掌科植物释放负离子,且常态下产生负离子浓度高的植物高压脉冲电场刺激负离子浓度的倍增效应更大,但是室内植物释放负离子的最佳生态效应研究以及植物源负离子发生器在室内的应用研究有待挖掘. [1] KRUEGER A P, REED E J. Biological impact of small air ions[J]. Science, 1976,193(4259):1209-1213. [2] KRUEGER A P. The biological effects of air ions[J]. International Journal of Biometeorology, 1985,29(3):205-206. [3] NOYCE J O, HUGHES J F. Bactericidal effects of negative and positive ions generated in nitrogen on starved Pseudomonas veronii.JournalofElectrostatics, 2003,57(1):49-58. [4]TIKHONOVVP,TSVETKOVVD,LITVINOVAEG,etal.Generationofnegativeairionsbyplantsuponpulsedelectricalstimulationappliedtosoil[J].RussianJournalofPlantPhysiology, 2004,51(3):414-419. [5]WANGJ,LISH.Changesinnegativeairionsconcentrationunderdifferentlightintensitiesanddevelopmentofamodeltorelatelightintensitytodirectionalchange[J].JournalofEnvironmentalManagement, 2009,90(8):2746-2754. [6] 邓传远.常态下仙人掌科植物释放负离子的研究[C]//孟兆祯,陈晓丽.中国风景园林学会2013年论文集(下册),北京:中国建筑工业出版社,2013:909-911. [7] 吴仁烨,郑金贵,程祖锌,等.水稻植株释放负离子研究[J].福建农林大学学报:自然科学版,2014,43(5):512-517. [8] 吴仁烨,邓传远,杨志坚,等.脉冲电场作用对植物释放负离子的影响[J].应用生态学报,2015,26(2):419-424. [9] 辛桂亮,孟伟,夏青,等.影响沿阶草释放负离子的3种因素分析[J].黑龙江八一农垦大学学报,2014,26(2):1-7. [10] 李继育,苏印泉,李印颖,等.高压刺激对几种盆栽植物产生空气负离子的影响[J].西北林学院学报,2008,23(4):38-41. [11] 吴仁烨,邓传远,王彬,等.具备释放负离子功能室内植物的种质资源研究[J].中国农学通报,2011,27(8):91-97. [12] 吴仁烨,黄德冰,郭梨锦,等.具备释放负离子功能室内植物的种质资源研究Ⅱ.常态下室内植物负离子的释放[J].亚热带农业研究,2011,7(1):1-6. [13] 田国行,赵天榜.仙人掌科植物资源与利用[M].北京:科学出版社,2011. [14] 丁旭玲,张万超,黄龙飞,等.常态下仙人掌科植物负离子释放量与其刺尖数量的相关性研究[J].安徽农业大学学报,2015,42(2):263-267. [15] 杨运经,习岗,张社奇.脉冲电场介导的植物空气负离子发射的倍增效应及其意义[J].大学物理,2009,28(12):39-42. [16] 杨运经,习岗,刘锴,等.应用负高压脉冲技术提高植物空气净化能力的探讨[J].高电压技术,2011,37(1):190-196. [17] 邵海荣,贺庆棠.森林与空气负离子[J].世界林业研究,2000,13(5):19-23. [18]JOVANICBR,JOVANICSB.Theeffectofhighconcentrationofnegativeionsintheaironthechlorophyllcontentinplantleaves[J].WaterAirandSoilPollution, 2001,129(1):259-265. (责任编辑:吴显达) Comparison of negetive air ions levels produced by Cactaceous in natural state and quantitative relations between NAI and thorns ZHANG Wan-chao1, ZHENG Jin-gui2, HUANG Long-fei1, SHI Shun-feng1, WU Ren-ye2, DENG Chuan-yuan1 (1.College of Landscape Architecture, Fujian Agriculture and Forestry University; 2.Agricultural Product Quality Institute, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China) NAI levels produced by 32 Cactaceous species (including the taxa below species level and cultivated varieties) in the fabricated organic glass enclosure (800 mm×800 mm×800 mm) under normal state were determined and compared, and the relationship between the NAI levels produced byEchinocactusgrusoniiandMammillariagracilisvar.fragilisand the number of thorns was investigated by removing the thorns stepwisely. In this work most of the plant species examined were able to generate NAI and NAI levels produced by those species were low and varied considerably among species. The NAI levels produced by the tested species were correlated with NAI levels of background in the air. There was significant positive correlation between the NAI levels produced byEchinocactusgrusoniiandMammillariagracilisvar.fragilisand the number of thorns. negative air ions; cactaceous plants; normal state 2014-07-26 2014-12-29 国家科技支撑计划资助项目(2013BAD01B05);福建省自然科学基金资助项目(2012J05045). 张万超(1989-),男,硕士研究生.研究方向:园林植物应用与园林生态.Email:898088654@qq.com.通讯作者邓传远(1971-),男,硕士生导师,副教授.研究方向:园林植物功能与应用.Email:417570601@qq.com. S 326 A 1671-5470(2015)04-0402-06 10.13323/j.cnki.j.fafu(nat.sci.).2015.04.012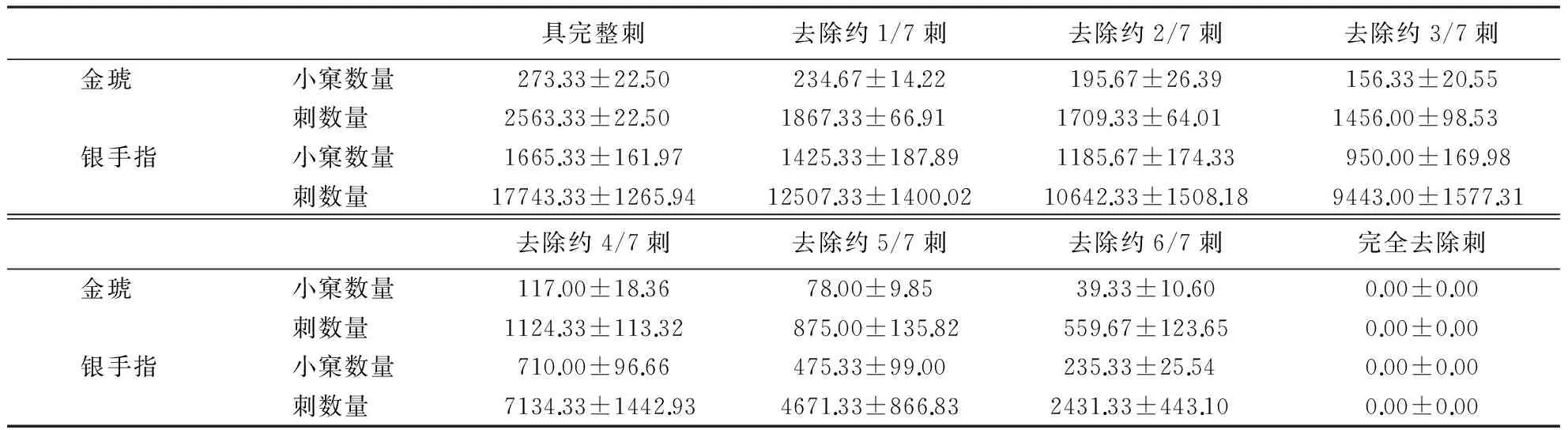
3 讨论与结论
