甜菜碱替代蛋氨酸对肉鸡生长、养分代谢及血清生化指标的影响
2015-04-18冷智贤白建勇周岩民
洑 琴, 冷智贤, 杨 雪, 白建勇, 温 超, 周岩民
(南京农业大学动物科技学院,江苏 南京 210095)
甜菜碱替代蛋氨酸对肉鸡生长、养分代谢及血清生化指标的影响
洑 琴, 冷智贤, 杨 雪, 白建勇, 温 超, 周岩民
(南京农业大学动物科技学院,江苏 南京 210095)
选取192只1日龄AA肉仔鸡随机分成4组,每组6个重复,每个重复8只鸡.对照组饲喂玉米—豆粕型基础日粮(前后期分别添加0.14%和0.08% DL-蛋氨酸),试验组分别以等量的甜菜碱替代基础日粮中DL-蛋氨酸添加量的25%、50%和100%,研究甜菜碱替代蛋氨酸对肉鸡生产性能、养分表观利用率、器官指数和血清生化指标的影响.结果表明:与对照组相比,甜菜碱替代蛋氨酸对肉鸡生产性能和器官指数无显著影响(P>0.05),但25%替代组42 d的肝脏指数显著低于50%替代组(P<0.05);25%、50%和100%替代组均可提高粗蛋白的表观利用率,分别提高6.90%(P>0.05)、11.47%(P<0.05)和3.04%(P>0.05),而对干物质、有机物和粗脂肪的表观利用率无显著影响(P>0.05);50%和100%替代组显著降低21 d的血清总蛋白含量和尿素氮浓度,提高42 d的甘油三酯浓度,100%替代组还显著降低21 d的球蛋白含量(P<0.05).结果提示,甜菜碱替代玉米—豆粕型日粮中的DL-蛋氨酸可提高粗蛋白的表观利用率,对肉鸡的生产性能无影响,以替代DL-蛋氨酸添加量的25%较合理.
甜菜碱; 蛋氨酸; 肉鸡; 生产性能; 养分表观利用率; 器官指数; 血清生化
蛋氨酸是家禽玉米—豆粕型饲料中的第一限制性氨基酸[1].蛋氨酸是合成机体蛋白质的必需氨基酸、半胱氨酸的前体物质和甲基转移的重要中间体[2].动物体内超过100个甲基化反应涉及到蛋氨酸,包括磷脂酰胆碱和肌酸等代谢产物的合成[3].在这些甲基化反应中,蛋氨酸必须先转化为S-腺苷蛋氨酸,再转化为高半胱氨酸,而高半胱氨酸需由甜菜碱或甲基四氢叶酸提供必需的甲基才能再转化为蛋氨酸[4].甜菜碱具有作为甲基供体参与蛋氨酸循环和作为渗透压调节剂以保护细胞及蛋白结构和功能的完整性等作用[5].甜菜碱有3个活性甲基团,其中一个甲基通过甜菜碱高半胱氨酸甲基转移酶途径直接参与蛋氨酸的再循环,而另两个甲基则通过5-甲基四氢叶酸间接地参与高半胱氨酸甲基化为蛋氨酸的过程[4,6-7].因此,理论上甜菜碱提供甲基的能力是蛋氨酸的3.7倍,可以为高半胱氨酸转化为蛋氨酸提供必要的甲基以代替蛋氨酸的甲基供体作用,从而可节约蛋氨酸,且与蛋氨酸相比具有成本优势.目前,甜菜碱有无水甜菜碱、甜菜碱盐酸盐和甜菜碱磷酸盐等形式.国内外关于甜菜碱节约蛋氨酸的研究较多,Sun et al[8]研究表明,日粮中25%的总蛋氨酸由甜菜碱盐酸盐(前期600 mg·kg-1,后期500 mg·kg-1)替代后不影响肉鸡的生产性能,且可提高胴体品质.Zhan et al[9]研究也发现,在蛋氨酸缺乏的肉鸡日粮中,添加无水甜菜碱与添加蛋氨酸对肉鸡的生产性能和胴体品质具有相同的作用.但McDevitt et al[10]研究表明,在蛋氨酸缺乏的日粮中添加不同水平的蛋氨酸,能显著提高肉鸡的生长速度和饲料转化率,而添加芬菜碱(含94.5%甜菜碱)则无显著效果,表明芬菜碱不能替代蛋氨酸.
甜菜碱替代蛋氨酸的研究多集中在肉鸡的生产性能和屠宰性能方面,而对肉鸡器官发育及养分利用方面的研究较少.因此,本试验以肉鸡为试验动物,研究在日粮中采用甜菜碱替代蛋氨酸对肉鸡生产性能、养分表观利用率、器官指数和血清生化指标的影响,旨在为甜菜碱在肉鸡生产中的合理应用提供参考.
1 材料与方法
1.1 材料
试验用甜菜碱为无水甜菜碱(商品形式,纯度为96%),由江苏省宜兴市天石饲料有限公司提供.蛋氨酸由安迪苏生命科学制品(上海)有限公司提供,纯度为99%.
1.2 试验设计与日粮配方
选取192只1日龄AA肉仔鸡随机分成4组,每组6个重复,每个重复8只鸡.对照组饲喂玉米—豆粕型基础日粮(前后期日粮中分别添加0.14%和0.08% DL-蛋氨酸),试验组分别以等量的甜菜碱替代基础日粮中所添加DL-蛋氨酸的25%、50%和100%.试验基础日粮配方及营养水平见表1,试验设计见表2,试验日粮均制成粉料.试验在南京市康欣禽业有限公司进行,为期42 d,其中1-21 d为试验前期,22-42 d为试验后期.
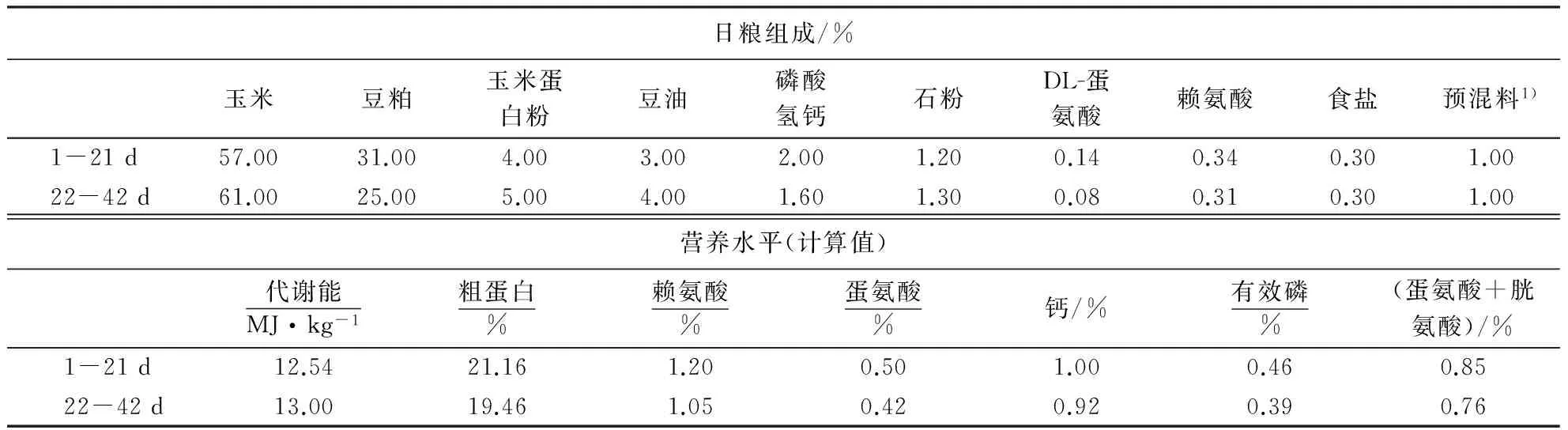
表1 基础日粮配方及营养水平(风干基础)
1)预混料由南京华牧动物科技研究所提供,为每千元日粮提供12000 IU维生素A、3000 IU维生素D3、30 IU维生素E、1.3 mg维生素K3、2.2 mg硫胺素、8 mg核黄素、40 mg烟酸、10 mg泛酸钙、4 mg吡哆醇、0.04 mg生物素、1 mg叶酸、0.013 mg维生素B12、400 mg氯化胆碱、80 mg铁、7.5 mg铜、110 mg锰、65 mg锌、1.1 mg碘、0.3 mg硒.
1.3 饲养管理
肉鸡在密闭鸡舍内笼养,自由采食和饮水,24 h光照,第1周室温控制在32-34 ℃,然后每周降低2-3 ℃,第42天的室温为20 ℃左右.免疫接种程序按常规进行.
1.4 样品采集及处理
于试验第21和42天,从各处理每重复中随机选1只公鸡进行采样,采样前空腹12 h.肉鸡称重后从颈动脉处放血,用干净离心管收集血液,待析出血清后,在4 ℃下离心10 min(3500 r·min-1),取血清分装,于-20 ℃下保存待测.待肉鸡死亡后立即解剖,分离心脏、肝脏、脾脏、胸腺和法氏囊,用滤纸擦干后称重.
于38 d采用内源指示剂法进行代谢试验,连续收粪3 d,每天一次,收集新鲜成形且无毛屑的粪样约50 g装入自封袋中,于-20 ℃下保存.收粪期间肉鸡自由采食和饮水.
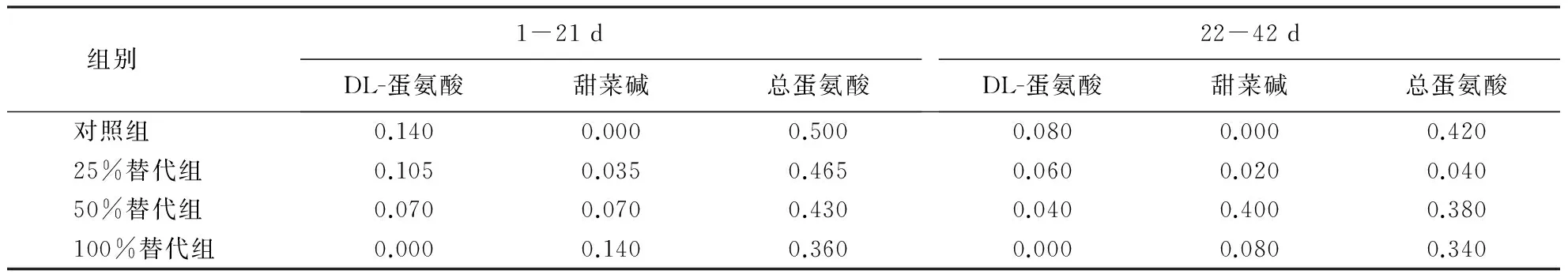
表2 试验设计
1.5 指标测定
1.5.1 生产性能 分别于试验第21和42天按重复对肉鸡进行空腹称重,并统计采食量,计算前后期平均日增重、平均日采食量和料重比.
1.5.2 养分表观利用率 粪样在室温下解冻后,将连续3 d收集的各重复粪样分别混匀,放入烘箱内于65 ℃干燥48 h,然后在室温下回潮24 h.回潮结束后用万能粉碎机粉碎饲料样和粪样,过40目筛,筛下物装入自封袋中待测.按文献[11]的方法测定饲料样和粪样中的干物质、有机物、蛋白质、粗脂肪和酸不溶灰分含量.按以下公式计算养分表观利用率:
1.5.3 器官指数 各器官重量除以活体重即得其器官指数.
1.5.4 血清生化指标 血清在室温下解冻后,用全自动生化分析仪(荷兰威图Wasson 1600)测定葡萄糖、总胆固醇、甘油三酯和尿素氮的浓度及总蛋白、白蛋白和球蛋白的含量,试剂盒购于北京北化康泰临床试剂有限公司.
1.6 数据处理
试验数据采用Excel软件进行初步处理,采用SPSS 16.0软件进行统计,采用单因素方差分析(One-way ANOVA, Duncan)进行差异显著性检验和多重比较,结果以平均值±标准误表示.
2 结果与分析
2.1 甜菜碱替代蛋氨酸对肉鸡生产性能的影响
从表3可见,甜菜碱替代蛋氨酸对肉鸡前后期生产性能无显著影响(P>0.05).
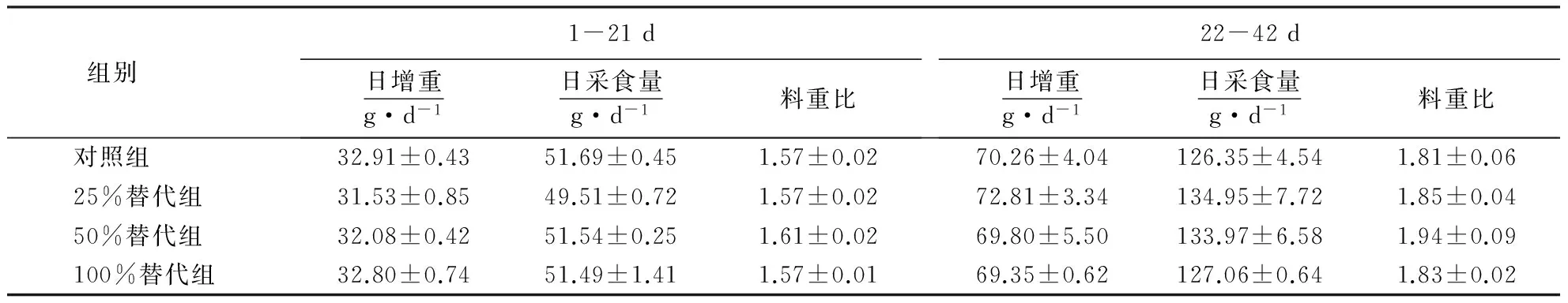
表3 甜菜碱替代蛋氨酸对肉鸡生产性能的影响
2.2 甜菜碱替代蛋氨酸对肉鸡养分表观利用率的影响
从表4可见:与对照组相比,25%、50%和100%替代组均可提高肉鸡的粗蛋白表观利用率,分别提高6.90%(P>0.05)、11.47%(P<0.05)和3.04%(P>0.05);50%和100%替代组均可提高有机物和粗脂肪的表观利用率,但不显著(P>0.05).

表4 甜菜碱替代蛋氨酸对肉鸡养分表观利用率的影响1)
1)同列数据后附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
2.3 甜菜碱替代蛋氨酸对肉鸡器官指数的影响
从表5可见:与对照组相比,甜菜碱替代蛋氨酸不影响肉鸡的器官指数(P>0.05),但25%替代组42 d的肝脏指数显著低于50%替代组(P<0.05).
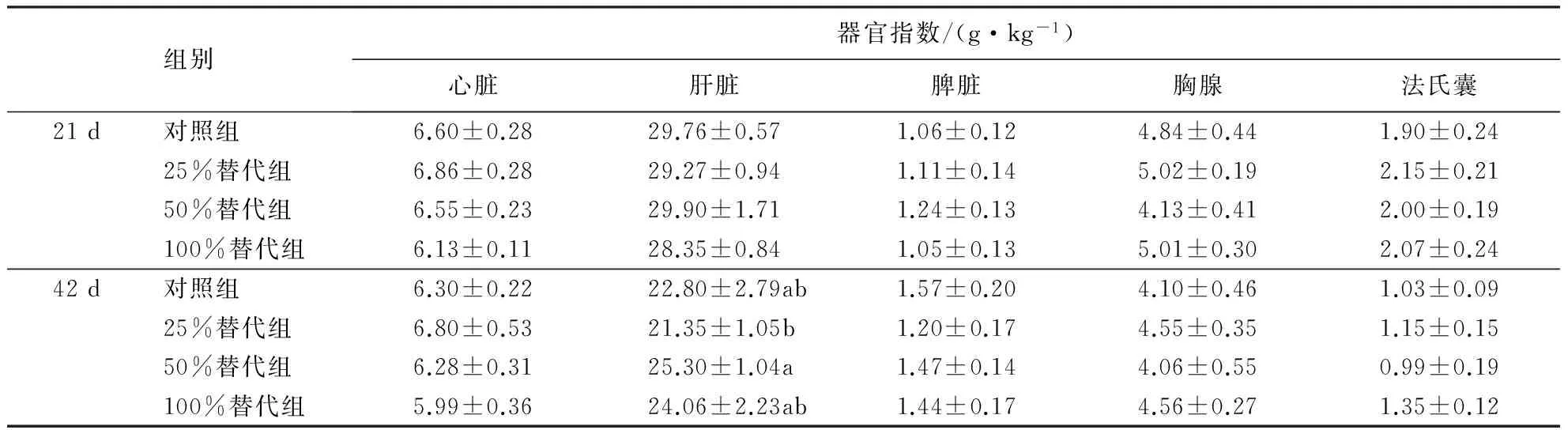
表5 甜菜碱替代蛋氨酸对肉鸡器官指数的影响1)
1)同列数据后附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
2.4 甜菜碱替代蛋氨酸对肉鸡血清生化指标的影响
从表6可见:与对照组相比,50%和100%替代组显著降低21 d的总蛋白含量和尿素氮浓度,提高42 d的甘油三酯浓度,100%替代组还显著降低21 d的球蛋白含量(P<0.05);而各替代组对血清其他生化指标均无显著影响(P>0.05).
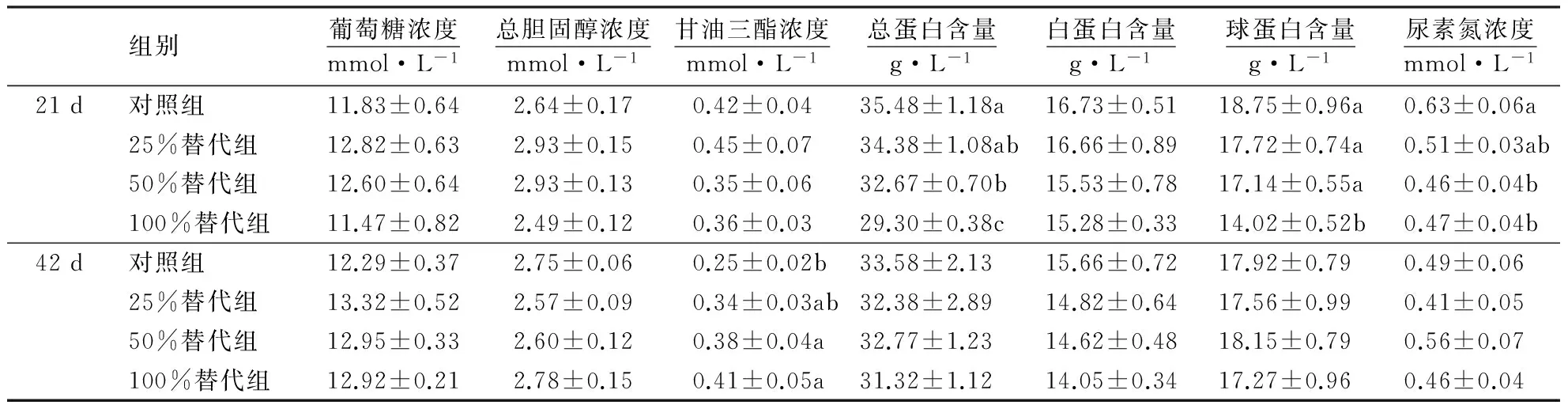
表6 甜菜碱替代蛋氨酸对肉鸡血清生化指标的影响1)
1)同列数据后附不同字母者表示差异显著(P<0.05),附相同字母者表示差异不显著(P>0.05).
3 讨论
3.1 甜菜碱替代蛋氨酸对肉鸡生产性能的影响
蛋氨酸是肉鸡日粮中的第一限制性氨基酸[1],日粮中蛋氨酸缺乏会显著降低肉鸡的生产性能[10,12].然而,在蛋氨酸缺乏的日粮中补充甜菜碱可提高肉鸡的生产性能和屠宰性能[13],其原因可能是甜菜碱参与甲基循环作用,保证动物代谢过程中甲基的生理需求,从而节省了用于提供甲基的蛋氨酸,使蛋氨酸更多地用于合成蛋白质,由此而提高生产性能[8,14].本试验中,甜菜碱替代蛋氨酸后获得了与对照组相似的生产性能,这与Attia et al[15]和Ei-husseiny et al[13]的研究结果一致.然而,Esteve-Garcia et al[12]和McDevitt et al[10]研究表明,在蛋氨酸缺乏的日粮中,添加甜菜碱对肉鸡的生产性能改善较小,即不能替代蛋氨酸.这些不一致的研究结果可能是由日粮中蛋氨酸、甜菜碱和胆碱水平的差异所致.蛋氨酸、甜菜碱和胆碱三者在满足各自特有的生理功能的基础上可以互相替代,但某些生化反应需要不同的甲基源,三者之间的关系十分复杂[16].日粮中蛋氨酸或含硫氨基酸严重缺乏时转甲基作用减弱,甜菜碱甲基化作用亦受限制[14],这或许可以解释Esteve-Garcia et al[12]的研究结果,因为其试验前期日粮中的蛋氨酸水平为0.32%,比美国国家科学研究委员会(NRC)在肉鸡饲养标准(1994年)中的推荐水平(0.5%)低36%.
3.2 甜菜碱替代蛋氨酸对肉鸡养分表观利用率的影响
甜菜碱除了作为机体重要的甲基供体外,另一个重要作用是作为渗透调节剂.甜菜碱的渗透保护性可以促进肠细胞的生长和存活,从而提高细胞活性,潜在地影响养分消化率[17].孙华[18]研究发现,甜菜碱替代25%总蛋氨酸后,肉鸡能量、蛋白质和脂肪的表观代谢率分别提高0.44%、4.03%和1.45%.本试验结果表明,甜菜碱替代组提高了肉鸡粗蛋白的表观利用率,其中50%替代组显著提高.这可能是由于:(1)肠细胞调控水、离子、养分以及其他大分子物质在血浆和肠液之间的交换,因此养分消化、吸收的过程必须有渗透压的保护,而甜菜碱是一种重要的渗透调节剂,能调节肠道上皮细胞内的渗透压.这种渗透性保护能够维持肠道细胞内水的平衡和细胞体积,从而促进消化酶分泌[19-20];(2)在体内高渗环境中,上皮细胞将停止增殖,开始凋亡,而此时甜菜碱可以促进细胞增殖,并可以防止细胞凋亡[21],从而使肠上皮面积增大,增加养分吸收的表面积.由此可推测,因甜菜碱的渗透保护促进了消化酶的分泌和肠上皮细胞的增殖,保护了肠道内环境稳态而提高了养分利用率.100%替代组的粗蛋白表观利用率略低于50%替代组,这可能与日粮中蛋氨酸水平较低有关.50%替代组提高了粗蛋白的表观利用率,但未能改善肉鸡的生产性能,这可能与干物质、有机物和粗脂肪的表观利用率未能显著提高有关,具体原因尚待进一步研究.
3.3 甜菜碱替代蛋氨酸对肉鸡器官指数的影响
肉鸡内脏器官的正常发育是机体各项生理功能正常发挥的基础,而器官指数是反映机体代谢强弱的重要指标[22].胸腺、脾脏和法氏囊是机体主要的免疫器官,参与机体的体液免疫和细胞免疫,免疫器官指数直接反映机体器官发育和免疫功能的强弱[23].本试验中,甜菜碱替代蛋氨酸对肉鸡的器官指数没有显著影响,仅50%替代组42 d的肝脏指数显著高于25%替代组,表明甜菜碱替代蛋氨酸对肉鸡的器官发育没有影响,与生产性能的数据一致,但随着替代水平的提高,肝脏代谢可能增强,原因可能与甜菜碱有关.因为肝脏是甜菜碱代谢的主要场所,添加甜菜碱促使肝脏细胞数量增加,体积增大,从而使肝脏的重量增加[24].安立龙等[24]也报道了添加甜菜碱提高了热应激肉鸡的肝脏重量.
3.4 甜菜碱替代蛋氨酸对肉鸡血清生化指标的影响
血清蛋白含量和尿素氮浓度是反映肉鸡机体蛋白质代谢水平和免疫机能的常用指标.血清总蛋白和白蛋白含量是反映动物营养状况的指标之一,良好的营养状况可使血清蛋白维持在一个较高水平.球蛋白则与体液免疫有关.尿素氮是蛋白质代谢后产生的废物,其浓度说明氨基酸合成蛋白质的效率.本试验中,随着甜菜碱替代蛋氨酸水平的提高,21 d血清中的尿素氮浓度下降,提示甜菜碱替代蛋氨酸可提高氨基酸合成蛋白质的效率;而21 d血清中的总蛋白含量并没有提高,反而下降,这可能与日粮中蛋氨酸缺乏有关.Attia et al[15]报道,随着日粮中蛋氨酸水平的降低,血清总蛋白、白蛋白和球蛋白含量也随之下降.孙华[18]研究也发现,日粮中的蛋氨酸缺乏降低了21 d肉鸡血清中的总蛋白和球蛋白含量.甜菜碱替代蛋氨酸对42 d血清中的蛋白质代谢指标无显著影响,提示甜菜碱替代蛋氨酸可能对肉鸡前期蛋白质代谢的影响大于后期,可能的原因是肉鸡前期对蛋氨酸的需要量大于后期[14].甘油三酯在血清中的浓度一定程度上反映了脂肪合成强度.42 d血清中的甘油三酯浓度提高,且50%和100%替代组显著提高,这与Rama Rao et al[25]和张文超等[26]的研究结果类似.可能是甜菜碱提高了肝脏中的甘油三酯向血液的转运,从而增加血液中的甘油三酯浓度[26],这也间接说明肝脏代谢增强,与肝脏指数的数据一致.
4 结论
甜菜碱替代肉鸡玉米—豆粕型日粮中的DL-蛋氨酸可提高粗蛋白的表观利用率,对肉鸡的生产性能无影响,以替代DL-蛋氨酸添加量的25%较合理.
[1] 瞿明仁,晏向华,黎观红,等.肉鸡蛋氨酸营养研究进展[J].饲料研究,1999(12):12-14.
[2] 周顺伍.动物生物化学[M].3版.北京:中国农业出版社,2003.
[3] LARBIER M, LECLERCQ B. Nutrition and Feeding of Poultry [M]. Paris: Institut National de la Recherche Agronomique, 1992.
[4] FINKELSTEIN J D, MARTIN J J. Methionine metabolism in mammals. Distribution of homocysteine between competing pathways [J]. Journal of Biological Chemistry, 1984,259(15):9508-9513.
[5] CRAIG S A. Betaine in human nutrition [J]. The American Journal of Clinical Nutrition, 2004,80(3):539-549.
[6] KIDD M T, FERKET P R, GARLICH J D. Nutritional and osmoregulatory functions of betaine [J]. World′s Poultry Science Journal, 1997,53(2):125-139.
[7] SNOSWELL A M, XUE G P. Methyl group metabolism in sheep [J]. Comparative Biochemistry and Physiology Part B: Comparative Biochemistry, 1987,88(2):383-394.
[8] SUN H, YANG W R, YANG Z B, et al. Effects of betaine supplementation to methionine deficient diet on growth performance and carcass characteristics of broilers [J]. American Journal of Animal and Veterinary Sciences, 2008,3(3):78-84.
[9] ZHAN X A, LI J X, XU Z R, et al. Effects of methionine and betaine supplementation on growth performance, carcase composition and metabolism of lipids in male broilers [J]. British Poultry Science, 2006,47(5):576-580.
[10] MCDEVITT R M, MACK S, WALLIS I R. Can betaine partially replace or enhance the effect of methionine by improving broiler growth and carcase characteristics? [J]. British Poultry Science, 2000,41(4):473-480.
[11] 张丽英.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社,2007.
[12] ESTEVE-GARCIA E, MACK S. The effect of DL-methionine and betaine on growth performance and carcass characteristics in broilers [J]. Animal Feed Science and Technology, 2000,87(1):85-93.
[13] EI-HUSSEINY O M, ABO-EL-ELLA M A, ABD-ELSAMEE M O, et al. Response of broilers performance to dietary betaine and folic acid at different methionine levels [J]. International Journal of Poultry Science, 2007,6(7):515-523.
[14] WANG Y Z, XU Z R, FENG J. The effect of betaine and dl-methionine on growth performance and carcass characteristics in meat ducks [J]. Animal Feed Science and Technology, 2004,116:151-159.
[15] ATTIA Y A, HASSAN R A, SHEHATTA M H, et al. Growth, carcass quality and serum constituents of slow growing chicks as affected by betaine addition to diets containing 2. Different levels of choline [J]. International Journal of Poultry Science, 2005,4(11):856-865.
[16] 沈同.生物化学 [M].2版.北京:人民教育出版社,1980.
[17] 孙华,吕世鹏.甜菜碱的渗透调节功能及其在养殖业上的应用[J].中国饲料添加剂,2008(8):1-4.
[18] 孙华.甜菜碱代替不同水平蛋氨酸对肉鸡生长发育及养分利用的影响[D].泰安:山东农业大学,2009.
[19] KETTUNEN H, PEURANEN S, TIIHONEN K. Betaine aids in the osmoregulation of duodenal epithelium of broiler chicks, and affects the movement of water across the small intestinal epitheliuminvitro[J]. Comparative Biochemistry and Physiology, 2001,129(2):595-603.
[20] MAHMOUDNIA N, MADANI Y. Effect of betaine on performance and carcass composition of broiler chicken in warm weather—A review [J]. International Journal of Agricultural Science, 2012,2(8):675-683.
[21] ALFIERI R R, CAVAZZONI A, PETRONINI P G, et al. Compatible osmolytes modulate the responses of porcine endothelial cells to hypertonicity and protect them from apoptosis [J]. Journal of Physiology, 2002,540:499-508.
[22] 杨凤.动物营养学[M].2版.北京:中国农业出版社,2000.
[23] 程郁昕,张金亮,邱晨伟,等.AA肉鸡生长期免疫器官生长规律的探讨[J].畜牧与兽医,2006,38(4):44-46.
[24] 安立龙,效梅,黄志毅,等.不同剂量甜菜碱对热应激肉鸡组织器官发育的影响[J].家畜生态学报,2005,26(3):40-46.
[25] RAMA RAO S V, RAJU M V L N, PANDA A K, et al. Effect of supplementing betaine on performance, carcass traits and immune responses in broiler chicken fed diets containing different concentrations of methionine [J]. Asian-Australia Journal Animal Science, 2011,24(5):662-669.
[26] 张文超,梁桂英,阳会军,等.饲料中添加甜菜碱对军曹鱼生长、体营养成分和血清生化指标的影响[J].南方水产科学,2012,8(3):1-9.
(责任编辑:施晓棠)
Effects of DL-methionine replacement with betaine on growth performance,apparent nutrients utilization and serum profile of broilers
FU Qin, LENG Zhi-xian, YANG Xue, BAI Jian-yong, WEN Chao, ZHOU Yan-min
(College of Animal Science and Technology, Nanjing Agricultural University, Nanjing, Jiangsu 210095, China)
This study was aimed to investigate the effects of DL-methionine (DL-Met) replacement with betaine on growth performance, apparent nutrients utilization, organ indexes and serum profile in broilers. A total of 192 1-day-old Arbor Acres chicks were randomly divided into 4 groups with 6 replicates of 8 birds, receiving a control basal diet containing 0.14% and 0.08% DL-Met during 1-21 and 22-42 d, respectively, and the test diets in which the DL-Met in the basal diet was replaced by equivalent betaine at 25%, 50% and 100%, respectively. Compared with control, broilers had similar growth performance and organ indexes in betaine inclusion groups (P>0.05), but liver index was lower in 25% betaine replacement than that of 50% betaine replacement (P<0.05). Compared with control, broilers had higher apparent utilization of crude protein in betaine inclusion groups, which increased 6.90% (P>0.05), 11.47% (P<0.05) and 3.04% (P>0.05) respectively. No differences were observed in the apparent utilization of dry matter, organic matter and ether extract among groups. A higher betaine replacement (50% and 100%) reduced the content of 21 d serum total protein and urea nitrogen, but increased 42 d triglyceride content (P<0.05). In addition, the complete replacement by betaine reduced 21 d globulin content (P<0.05). It was suggested that the replacement of DL-Met in corn-soybean meal diet by betaine resulted in increased apparent utilization of crude protein and similar growth performance. It is more reasonable to replace 25% DL-Met with betaine in corn-soybean meal diet.
betaine; methionine; broiler; growth performance; apparent nutrients utilization; organ indexes; serum profile
2014-07-26
2014-10-11
江苏省产学研联合创新资金前瞻性联合研究项目(BY2014128-03).
洑琴(1988-),女,硕士研究生.研究方向:动物营养与饲料科学.Email:fuqin1988@163.com.通讯作者周岩民(1963-),男,教授,博士生导师.研究方向:动物营养与饲料科学.Email:zhouym6308@163.com.
S831.5
A
1671-5470(2015)04-0396-06
10.13323/j.cnki.j.fafu(nat.sci.).2015.04.011
