Real-time PCR方法检测高脂饲喂小鼠肝脏CYP2A5的表达
2015-04-18张秀英李广亮
齐 悦,张秀英,徐 尚,李广亮
Real-time PCR方法检测高脂饲喂小鼠肝脏CYP2A5的表达
齐 悦,张秀英,徐 尚,李广亮
(东北农业大学动物医学学院,黑龙江哈尔滨150030)
为了建立非酒精性脂肪肝(NAFLD)模型小鼠肝组织中CYP2A5表达的实时荧光定量PCR(real-time fluores⁃cence quantitative PCR,qRT-PCR)方法。高脂饮食诱导小鼠至8周,采用qRT-PCR方法检测小鼠肝脏中CYP2A5的表达水平,同时评价该方法的特异性。建立了小鼠肝组织中CYP2A5的SYBR Green实时荧光定量PCR检测方法,结果显示,该方法的溶解曲线为单峰,同时核酸电泳显示一条特异性条带。检测结果表明,高脂诱导的NAFLD小鼠肝组织中CYP2A5的表达水平极明显高于正常对照组(P<0.01)。表明该实时荧光定量PCR方法,特异性好、灵敏度强,为进一步研究小鼠CYP2A5的表达提供了试验基础。
CYP2A5;实时荧光定量PCR;NAFLD
非酒精性脂肪性肝病(NAFLD)是一种无过量饮酒史,肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征。随着人类生活水平的提高,NAFLD的发病率逐年增加,已成为一种危害人类健康的常见慢性肝脏疾病[1]。细胞色素P450(Cytochrome P450)属于亚铁血红素单加氧酶超家族,是主要的一相代谢酶类,其介导的外源化合物代谢是肝脏解毒系统中重要的一部分。CYP2A5是鼠类CYP450酶系中的重要成员之一,与人类CYP2A6同源,在
蛋白质序列和底物特异性上,与CYP2A6、CYP2A13高度相似,并且有相同的代谢底物,包括香豆素、尼古丁、可替宁、睾丸素、烟草类致癌物及亚硝胺类等。机体内CYP2A5的表达变化对药物代谢及外源性化合物的毒性有重要的影响[2]。本研究通过Real-Time PCR技术,对正常组、模型组小鼠肝组织中CYP2A5基因表达情况进行对比分析,目的是探讨高脂诱导的NAFLD对CYP2A5表达的影响,为进一步揭示NAFLD发病机制、指导临床合理用药、新药研发、疾病控制等方面提供基础。
1 材料与方法
1.1 实验动物四周龄ICR鼠30只,购自于中国农业科学院哈尔滨兽医研究所实验动物中心,随机分为两组,正常对照组小鼠饲喂基础饲料,NAFLD组小鼠饲喂高脂饲料,在基础饲料(68.5%)中加入15%猪油1%胆固醇0.5%胆盐15%糊精,高脂饲料的配方由前期试验确定[3]。
1.2 主要试剂和仪器TRIZol提取液(Invitrogen公司);一步法cDNA第一链反转录试剂盒(海基生物科技有限公司);SYBR Premix Ex TaqTM、DNA Marker DL-2 000宝生物工程(大连)有限公司;台式高速冷冻离心机(德国Sigma公司产品);S1000 Thermal Cyclery型PCR仪(美国Bio-RAD公司产品);NanoDrop2000核酸蛋白分光光度计,美国Thermo公司产品;ABI 7500荧光定量PCR(ABI公司,美国);自动凝胶成像分析系统,北京赛智创业科技有限公司产品。
1.3 引物设计及合成根据GenBank上CYP2A5和GAPDH基因核酸序列,利用Primer5.0和Oligo 6.0,在保守区分别设计一对特异性引物,序列如表1所示。引物由上海英骏生物技术有限公司合成。
1.4 RNA提取及cDNA合成取0.1g左右的肝组织放入匀浆器中,加入1mLTRIZol匀浆,静置10min;加入0.2mL氯仿剧烈震荡15 s,室温静置10min、离心取上清;加入等体积(约0.5mL)异丙醇沉淀RNA;75%乙醇洗涤沉淀,晾干后加入0.1mLDEPC水溶解RNA。用紫外分光光度计分析RNA浓度和纯度,A260/A280在1.8~2.0之间。琼脂糖凝胶电泳检测RNA完整性。cDNA的合成参照试剂盒说明书进行。1.5 SYBRGreen实时荧光定量PCR条件优化采用SYBR GreenⅠ染料法,对CYP2A5及内参基因GAPDH的荧光定量PCR条件进行优化,按照退火温度55℃~65℃,引物浓度从0.4~1.0μmol/L进行20μL体系扩增,以扩增曲线平滑完整、得到最小的Ct值及最大的荧光值(Rn),溶解曲线产生特异性单峰为指标,同时通过琼脂糖凝胶电泳分析荧光定量PCR产物特异性,以确定最佳扩增条件。经优化之后的反应体系为:SYBRR Premix Ex TaqTMⅡ(2×)10μL,上下游引物各0.8μL(10μmol/L),ROX Reference Dye(50)0.4μL,模板1μL,用灭菌的去离子水补足体系至20μL。快速PCR反应条件:第一步95℃预变性30 s;第二步95℃变性5 s、60℃34 s、共40个循环。

表1 Rea l-time RT-PCR检测中的引物序列
各个样品的GADPH和CYP2A5基因分别在不同孔中进行扩增,根据各个样品PCR反应的Ct值进行相对定量。每份样品目的基因CYP2A5的表达强度用其对应的内参基因GAPDH的量进行矫正,即ΔCt为目的基因相对于内参基因的表达强度,ΔCt=Ct(CYP2A5基因)-Ct(GAPDH基因)。CYP2A5基因在NAFLD肝组织中相对于正常组织的表达差异倍数用2-ΔΔCt计算表示,而-ΔΔCt=-(ΔCt NAFLD肝组织-ΔCt正常肝组织)。
1.6 统计学分析所有数据都用均值±标准差(mean±SD)的形式表示。用SPASS 17.0软件进行多个样本间单因素方差分析,以P<0.05为差异有统计学意义,P<0.01为差异有极显著统计学意义。
2 结果
2.1 总RNA质量鉴定提取的总RNA经1.5%琼脂糖凝胶电泳分析,28s和18s RNA的电泳条带清晰完整,且含量接近于2∶1,说明提取的RNA纯度高完整性好,没有发生降解。NanoDrop2000核酸蛋白分光光度计检测,如图1所示,吸光光谱的曲线平滑,在260 nm波长处出现单峰,A260/A280的比值介于1.8~2.0之间。

图1 NanoDrop2000检测总RNA吸光曲线
2.2 实时荧光定量PCR条件优化Real-time PCR产物琼脂糖电泳图显示(图2、图3),在0.8μL(10 μmol/L)引物、60℃退火温度下,CYP2A5和GAPDH两基因均能获得较好的特异性和灵敏度,两种基因在同一条件下能获得较好的特异性和灵敏度。
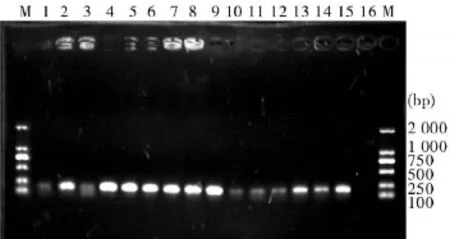
图2 CYP2A5 Rea l-Time PCR条件优化
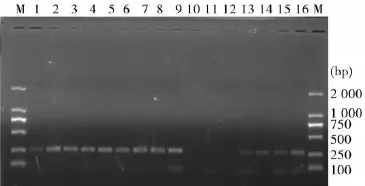
图3 GAPDH Real-Time PCR条件优化
2.3 CYP2A5和GAPDH两基因扩增曲线及溶解曲线CYP2A5和GAPDH两基因的扩增曲线基本平行,扩增效率一致,可以用2-ΔΔCt方法计算分析。两基因的溶解曲线如图4、图5所示,两者均为单峰,提示扩增产物特异性较好。
2.4 高脂诱导的NAFLD小鼠肝脏中CYP2A5 mRNA的相对表达如表2所示,与正常组小鼠相比,高脂饮食诱导的NAFLD小鼠肝脏组织中CYP2A5的相对表达水平明显升高,差异极显著(P<0.01)。
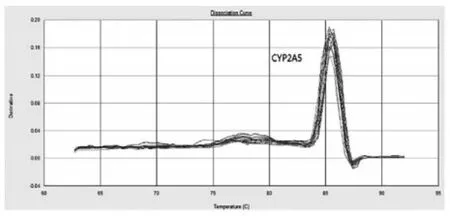
图4 实时荧光定量PCR CYP2A5基因溶解曲线

图5 实时荧光定量PCR GAPDH基因溶解曲线

表2 高脂组和正常组小鼠肝脏中CYP2A5的相对表达量
3 讨论
非酒精性脂肪性肝病(NAFLD)被认为是代谢综合征在肝脏的表现,通过促进肝脏脂肪变性、细胞损伤和炎症反应,最终导致非酒精性脂肪性肝炎(NASH)。核转录因子NF-E2相关因子2(Nrf2)是体内调节氧化应激的关键靶点,其可以通过促进多种抗氧化酶和II相解毒酶的表达,发挥重要的抗氧化作用[4]。本试验前期研究发现,高脂饲料可诱导小鼠发生NAFLD,模型小鼠Nrf2的表达量增加,Nrf2缺失会加重脂质的沉积和氧化应激,加速NAFLD的形成。
细胞色素P450超家族中,CYP2A5的调节作用不同于大多数CYP酶类,可被一些结构不同的化学物质高度诱导。所有条件下CYP2A5诱导作用不是化学物质本身的作用[5],而是这些化学物质引起的肝毒性或肝组织损伤作用的结果,在炎症和肝硬化区域相邻的肝细胞CYP2A5为增量调节。这与本试验结果相互印证,NAFLD发生时,机体由活性氧ROS产生损伤或内质网应激,血红素降低,胆红素升高,可诱导CYP2A5的表达。CYP2A5活性的增强可能是保护细胞反应[6]。
CYP2A5是Nrf2的一个高度敏感的靶基因,Nrf2可能部分或全部的调控着CYP2A5的表达[7]。即使是在特殊物质的诱导下,如吡唑,通过hnRNPA1调控CYP2A5的转录后表达,也可能涉及Nrf2的作用[8]。CYP2A5在血红素平衡中起重要作用,不仅可作为血红素螯合蛋白,而且可催化胆红素。当线粒体受到过量血红素、胆红素或血红素中间体威胁时,Nrf2可维持内质网和线粒体中CYP2A5的组成型表达[9]。本试验中NAFLD小鼠CYP2A5表达水平显著升高,可能与Nrf2的调节密不可分。
本试验采用前期建立的方法,通过给小鼠饲喂高脂饲料建立小鼠非酒精性脂肪肝模型,组织病理学检查及生化检查证明模型鼠的肝脏发生脂肪变性[10]。用RT-PCR法检测发现,与正常饮食小鼠相比,高脂诱导的NAFLD小鼠肝组织中CYP2A5的相对表达水平显著升高。同时本研究建立了一种Real-time PCR方法检测小鼠肝组织中CYP2A5的表达水平,该方法特异性好,灵敏度强,为今后研究CYP2A5表达通路及NAFLD发病机制提供了良好的试验基础。
[1]李娟,叶菲.非酒精性脂肪性肝病发病机制的研究进展[J].国际药学研究杂志,2011,38(5):341-344.
[2]Zhou X,Zhuo X L,Xie F,et al.Role of CYP2A5 in the Clear⁃ance of Nicotine and Cotinine:Insights from Studies on a CYP2A5-null Mouse Model[J].Journal of Pharmacology and Ex⁃perimental Therapeutics,2010,332:578-587.
[3]李晓冲,徐尚,张秀英,等.C57BL/6J小鼠非酒精性脂肪肝模型的建立[J].中国兽医杂志,2013,49(1):6-8.
[4]倪阵,闻勤生,赵曙光,等.Nrf2敲除对高脂饮食诱导小鼠肝脏氧化应激和胰岛素抵抗的影响[J].山西医科大学学报,2013,44(3):169-173.
[5]Gilmore W J,Hartmann G,Piquette-Miller M.Effects of lipopoly⁃saccharide-stimulated inflammation and pyrazole-mediated hepa⁃tocellular injury onmouse hepatic CYP2A5 expression[J].Toxicol⁃ogy,2003(184):211-226.
[6]Correia M A,Sinclair PR,De Matteis F.Cytochrome P450 regu⁃lation:the interplay between its heme and apoprotein moieties in synthesis,assembly,repair,and disposal[J].Drug Metab Rev,2011,43(1):1-26.
[7]LämsäV,Levonen A L,Leinonen H,et al.Cytochrome P4502A5 Constitutive Expression and Induction by Heavy Metals Is Depen⁃dent on Redox-Sensitive Transcription Factor Nrf2 in Liver[J]. Chem Res Toxicol,2010,23(5):977-985.
[8]Nichols K D,Kirby G M.Microarray analysis of hepatic gene ex⁃pression in pyrazole-mediated hepatotoxicity:Identification of po⁃tential stimuliof Cyp2a5 induction[J].Biochem Pharmacol,2008,75(2):538-551.
[9]Horowitz M P,Greenamyre J T.Mitochondrial iron metabolism and its role in neurodegeneration[J].J Alzheimers Dis,2010,20 Suppl 2:S551-S568.
[10]曹玉珍,张秀英.高脂饲料诱发C57BL/6J小鼠非酒精性脂肪肝相关指标的动态观察[J].东北农业大学学报,2011,42(3):98-104.
Real-time fluorescence quantitative PCR assay for detection of high-fat feedingmurine liver tissue CYP2A5 expression
QIYue,ZHANG Xiu-ying,XU Shang,LIGuang-liang
(College of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
In order to establish real-time fluorescence quantitative PCRmethod for detection liver CYP2A5 expression of non⁃alcoholic fatty liver disease(NAFLD)mousemodel of NAFLD was induced with high fat diet for eightweeks.The relative expres⁃sion level ofmouse CYP2A5 in liver tissue was detected by qRT-PCR.The sensitivity and specificity of thismethod were evaluat⁃ed.The real-time fluorescence quantitative PCR method for detection liver CYP2A5 expression of NAFLD was established.The melting curve showed single peak and the amplified products were electrophoresed and a single productwas observed.Compared to the controlmice,the CYP2A5 relative expression was significantly increased in NAFLDmice liver tissue(P<0.01).Thus a stan⁃dardmethod of qRT-PCR can be used for the detection ofmouse CYP2A5 expression due to its good specificity and sensitivity.
CYP2A5;real-time fluorescence quantitative PCR;NAFLD
ZHANG Xiu-ying
R 575.5
A
0529-6005(2015)12-0003-03
2014-10-27
国家自然科学基金(31172369)
齐悦(1990-),女,硕士生,研究方向为兽医药理学与毒理学,E-mail:yue7yue@hotmail.com
张秀英,E-mail:zhangxiuying@neau.edu.cn
