影像引导宫颈癌三维腔内放疗的临床初步观察
2015-04-18徐晓婷张汝婷徐玥靓秦颂兵周菊英
龚 唯,徐晓婷,李 莉,张汝婷,倪 婕,徐玥靓,秦颂兵,周菊英
苏州大学附属第一医院放疗科,江苏 苏州 215006
影像引导宫颈癌三维腔内放疗的临床初步观察
龚 唯,徐晓婷,李 莉,张汝婷,倪 婕,徐玥靓,秦颂兵,周菊英
苏州大学附属第一医院放疗科,江苏 苏州 215006
背景与目的:放射治疗是宫颈癌的主要治疗方法。通过分析苏州大学附属第一医院放疗科收治的31例初治宫颈癌患者三维腔内放疗的剂量体积直方图(dose-volume histogram,DVH)剂量分布和临床结果,观察影像引导宫颈癌三维后装放疗患者的近期疗效及放射反应。方法:选取2013年5月—2014年12月在苏州大学附属第一医院放疗科行根治性放疗的31例初治宫颈癌患者,FIGO期为Ⅱa~Ⅳ期。每例患者接受4~6次CT引导下的三维后装放疗,单次高危临床靶区(high risk-clinical target volume,HR-CTV)给予400~600 cGy处方剂量,31例患者共计153次施源器置入,采用192Ir高剂量率后装治疗机实施腔内放疗。分析内外照射的HRCTV D90、膀胱D2cc、乙状结肠D2cc、直肠D0.1cc和直肠D2cc,采用EQD2进行剂量计算。按照RTOG/EORTC放射反应评分标准和RECIST 1.1评价标准分析放射反应和近期疗效。结果:膀胱、直肠、乙状结肠均无3级及以上急性或慢性放射反应。2例患者发生后期直肠出血(2级),经止血和灌肠等对症处理后症状改善。放疗后1~3个月完全缓解率(complete remission,CR)为93.55%(29/31),1年局部控制率(local control rate,LCR)为93.55%(29/31),1年无进展生存率(progression-free survival,PFS)为90.32%(28/31)。结论:CT引导的三维腔内放疗联合外照射治疗局部晚期宫颈癌,定位精确,靶区剂量充足,危及器官的受照剂量可见、可控、可信,提高了患者的治疗耐受性,避免了重度放射反应的发生,大大提高了患者治疗后的生活质量,值得推广应用。
宫颈癌;影像引导;三维后装放疗;近期疗效;放射反应
放射治疗是宫颈癌的主要治疗方法,后装放疗则是未手术的宫颈癌根治治疗中不可或缺的部分。与二维腔内放疗相比,以CT/MRI图像为基础的宫颈癌三维后装放疗为宫颈癌的近距离治疗提供了更精准的剂量分布,并可明确评估直肠、膀胱等邻近危及器官的受照剂量[1]。本研究通过分析苏州大学附属第一医院放疗科收治的31例初治宫颈癌患者三维腔内放疗的剂量体积直方图(dose-volume histogram,DVH)剂量分布和临床结果,初步探讨影像引导宫颈癌后装放疗的剂量和临床优势,促进该新技术在宫颈癌治疗中的推广使用。
1 资料和方法
1.1 一般资料
选择2013年5月—2014年12月在苏州大学附属第一医院放疗科接受根治性放化疗的初治宫颈癌患者共31例。FIGO 2009分期:Ⅱa期4例,Ⅱb期16例,Ⅲa期3例,Ⅲb期4例,Ⅳ期4例。病理类型:鳞癌26例,腺癌2例,低分化癌3例。
1.2 放射治疗
体外照射参照宫颈癌2015版NCCN指南[2],全盆腔适形或调强放疗30~45 Gy/15~25 F后,根据每位患者治疗前及放疗期间宫旁肿瘤及淋巴结消退情况,个体化制定宫旁野加量计划。外照射总量达45~58 Gy/25~29 F。
影像引导三维后装放疗:宫旁野加量期间,每周行后装治疗1次;加量照射结束后,每周2次后装治疗。每例患者共计行4~6次后装放疗,高危临床靶区 (high risk-clinical target volume,HR-CTV)处方剂量达24~36 Gy。
操作方法:真空垫固定体位后,患者取截石位,尿道内置入导尿管,排空膀胱。在特制窥阴器下观察宫颈和阴道情况,置入CT/MRI专用塑料施源器,加直肠挡板,纱布填塞阴道,妥善固定施源器,取出特制窥阴器。平车搬运患者至大孔径CT检查床(购自荷兰Philips公司),经导尿管注入100 mL 0.9%的氯化钠溶液,行盆腔CT扫描,范围从髂前上棘至股骨上段,层厚3 mm,如有髂总淋巴结或腹主动脉旁淋巴结转移,扫描范围延伸到T10水平以上(图1、2)。
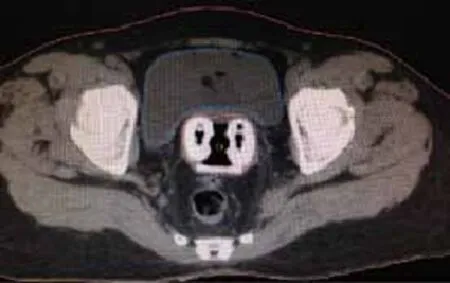
图 1 患者施源器及直肠挡板固定方法-横断面Fig. 1 Fixed method of applicator and rectal baff l e-cross section
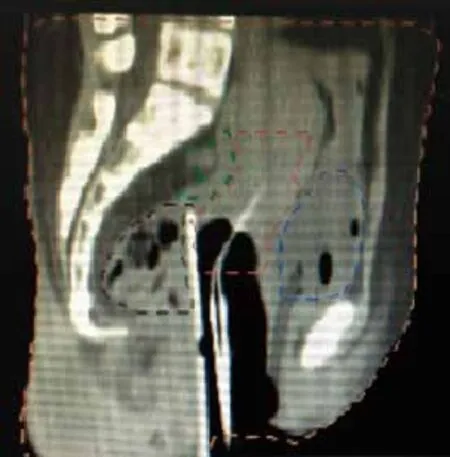
图 2 患者施源器及直肠挡板固定方法-矢状面Fig. 2 Fixed method of applicator and rectal baff l e-vertical plane
靶区勾画:将C T图像经网络传输至Oncentra后装治疗计划系统,勾画靶区[大体肿瘤靶区(gross tumor volume,GTV)、HR-CTV]和危及器官(膀胱、直肠、乙状结肠)。按照欧洲放射肿瘤协会推荐的标准[3-6]勾画靶区。肿瘤靶区GTV:参照初治时盆腔增强CT或MRI显示的肿块以及每次后装治疗前的妇科体检。HRCTV:全部宫颈+后装治疗前认定的肿瘤扩展区,包括宫旁、穹窿和宫体。在CT图像上逐层勾画膀胱、直肠和乙状结肠。
腔内放疗计划制定及治疗:给予单次HRCTV处方剂量400~600 cGy,通过重建施源器、逆向调强的方法,制定计划,计划评估由一名物理师和一名副主任医师同时完成,要求D90≥90%处方剂量,同时膀胱、直肠、乙状结肠D0.1cc、D2cc均尽量小于450 cGy/f。同时,保持导尿管通畅,排空膀胱。治疗前,再次经导尿管注入100 mL 0.9%的氯化钠溶液,施源器连接192Ir高剂量率后装治疗机实施腔内放疗。
1.3 其他辅助治疗
Ⅱb期以上患者接受同步放化疗,放疗同期给予“顺铂40 mg/m2或紫杉醇40 mg/m2”,每例患者治疗周期内共行4~6次同步化疗。同期放化疗完成后复查盆腔MRI和血SCC、CA125等指标,根据检验结果评估疗效,控制不满意的患者继续给予2~3个周期静脉化疗。
1.4 疗效评估与随访
分析三维后装治疗计划的DVH,记录HRCTV D90、膀胱D2cc、乙状结肠D2cc、直肠D0.1cc和直肠D2cc,按照宫颈肿瘤组织α/β=10、危及器官α/β=3,进行内、外照射EQD2剂量计算。
放化疗期间患者每周检查血常规和治疗反应等;治疗完成后1个月行第1次全面复查,以后每3个月复查1次,内容包括妇科检查、盆腔MRI(或CT)和腹部B超等。疗程期间及复查时详细询问患者的膀胱、直肠和消化道不良反应并记录,按照RTOG/EORTC评分标准进行急性、后期放射反应评估。仔细对比、测量患者治疗前后盆腔MRI(或CT)图像中肿瘤大小及变化,根据RECIST 1.1评价标准[7]分析近期疗效,根据随访结果计算局部控制率(local control rate,LCR)。
1.5 统计学处理
采用SPSS 19.0软件分析数据,靶区和正常组织剂量采用计数分析,计数资料用描述,放射反应及近期疗效资料采用频数分析。
2 结 果
2.1 三维腔内放疗情况
31例患者均完成全程外照射+三维后装放疗,所有患者总的治疗天数均小于55 d,平均治疗天数为52 d,每位患者完成三维后装放疗4~6次,共计153次施源器置入。HR-CTV D90、膀胱D2cc、乙状结肠D2cc、直肠D0.1cc和直肠D2cc的EQD2分别为(76.13±6.20)、(67.44±9.09)、(49.76±8.88)、(75.09±9.62)和(64.01±10.14)Gy(表1、2)。

表 1 31例宫颈癌患者三维后装计划评估指标Tab. 1 Evaluation index of the 3D brachytherapy plan with 31 cervical cancer patients

表 2 31例宫颈癌患者总的EQD2Tab. 2 The total EQD2 of 31 cervical cancer patients
2.2 疗效与随访
随访方式为返院复诊和电话随访,随访率为100%,随访时间为3~19个月,中位随访时间14个月。根据RTOG/EORTC放射反应评分标准,31例接受三维后装放疗的宫颈癌患者,3个月内膀胱放射反应的发生率为:0级25例,1级4例,2级2例,无3级及以上膀胱急性反应。直肠放射反应的发生率为:0级14例,1级13例,2级4例,无3级及以上直肠急性反应。乙状结肠放射反应的发生率为:0级10例,1级14例,2级7例,无3级及以上乙状结肠急性反应。在3个月后的随访中,2例患者发生后期直肠出血(2级),经止血和灌肠等对症处理后症状改善;无后期膀胱和乙状结肠放射反应。放疗后1~3个月完全缓解率(complete remission,CR)为93.55%(29/31),1年LCR为93.55%(29/31), 1年无进展生存率(progression-free survival,PFS)为90.32%(28/31)。
3 讨 论
放射治疗是宫颈癌治疗的主要方法。子宫位于盆腔中部,通过宫旁组织和韧带与盆壁相连,前后毗邻膀胱和直肠,根治性杀灭肿瘤组织的放疗剂量会大大增加膀胱和直肠等邻近正常器官的放射损伤,因此,腔内近距离放疗成为宫颈癌根治性治疗中不可或缺的部分。早期的宫颈癌腔内放疗主要是二维技术,以点剂量和面剂量评估为主。21世纪以来,随着影像学和计算机的发展,以CT或MRI为基础的三维近距离放疗在宫颈癌治疗中的应用取得了良好的临床效果,在保证了肿瘤精确剂量分布的同时,更具备安全的危及器官控制水平。
美国放射肿瘤学会[8]及欧洲放射肿瘤协会[3-6]均提出了在MRI图像引导下的宫颈癌三维腔内放射治疗方法及剂量评估,并逐渐成为宫颈癌后装治疗的指南。2007年,Kyung等[9]提出了以CT图像为基础的宫颈癌三维腔内放疗,从设备、经济和时间上综合考虑,更适合多数的临床机构作为参考。选择CT作为影像学基础,可以较准确地勾画出膀胱、直肠和乙状结肠,但对于子宫、宫颈及病灶的勾画,仍需参照治疗前的盆腔MRI或增强CT,以及经验丰富医师的妇科检查。
靶区和危及器官的剂量评估主要参照欧洲放射肿瘤协会推荐的评估参数,包括D90、危及器官D2cc和内外照射DVH累计计算的EQD2等。在实际应用中,D90易于转换为EQD2,且较为稳定。有研究指出,HR-CTV D90和危及器官的D2cc是临床较为稳定、重复性好的评估参数[10-11]。Mazeron等[11]通过分析225例图像引导近距离腔内放疗的宫颈癌患者的LCR与预后因素提出,总的治疗时间是宫颈癌LCR的独立预后因素。本研究的所有患者总的治疗天数均小于55 d,平均治疗天数为52 d,对后续的疗效分析没有干扰。
三维腔内放疗的主要优势在于较好的LCR和可控的不良反应。安菊生等[12]对18例局部晚期宫颈癌给予常规放疗联合三维腔内放疗,分析两种放疗相加的DVH参数和疗效关系,中位随访26个月,无严重放射反应,无局部复发病例,并建议直肠D2cc<75 Gy。叶伟军等[13]采用CT引导下加速超分割后装治疗局部晚期宫颈癌,同样未发现3级以上放疗相关合并症,3年LCR达86.96%,3年总生存率(overall survival,OS)达89.13%。本研究中位随访时间为14个月,1例局部未控,2例远处转移,其中1例死亡。1年PFS达90.32%。Harter等[14]的多中心研究发现,3D后装治疗下膀胱、直肠和乙状结肠D2cc分别为60~70、33~61和44~58 Gy,较2D减少了一半的不良反应,并提高了LCR,尤其适用于局部晚期宫颈癌患者。本研究对31例接受三维后装放疗的宫颈癌患者随访显示,3个月内的CR为93.55%(29/31),急性期无1例发生3级及以上放射反应,3个月后2例患者发生后期直肠出血(2级)。膀胱、直肠和乙状结肠D2cc的EQD2分别为(67.44±9.09)、(64.01±10.14)和(49.76±8.88)Gy,与文献报道一致。Kim等[15]分析22例CT图像引导的三维近距离治疗宫颈癌患者得出,乙状结肠、直肠和小肠接受高量照射的概率依次为41%、32%和27%,应特别关注近端直肠和乙状结肠,这些区域更易出现D2cc高剂量。Georg等[16]通过分析纤维结肠镜下直肠表现及临床观察指出,直肠D0.1cc与直肠黏膜毛细血管扩张相关,直肠黏膜和临床发展变化遵循明确的剂量体积效应。在本研究中,31例患者三维后装治疗计划的直肠D0.1cc的EQD2为(75.09±9.62)Gy,符合文献中剂量体积规律,因患者未行肠镜检查,相关黏膜改变仍有待进一步研究。Kang等[17]研究发现,CT引导下宫颈癌近距离放疗明显降低了晚期直肠出血率(13% vs 2%)。在本研究的后期随访中,仅2例(6.45%)患者出现晚期直肠出血,与文献报道一致。
综上所述,以CT为基础的宫颈癌三维后装放疗有较好的靶区覆盖率,且危及器官剂量均在安全可控范围内,进一步提高了LCR,降低了放射不良反应发生率,值得临床推广应用。
[1] 晏俊芳, 于 浪, 孙玉亮, 等. 以CT图像为基础的宫颈癌三维腔内放疗 [J]. 中华放射肿瘤学杂志, 2014, 23(5): 377-381.
[2] 周 晖, 卢淮武, 彭永排, 等. 2015 年NCCN 宫颈癌临床实践指南[J]. 中国实用妇科与产科杂志, 2015, 31(3): 185-191.
[3] HAIE-MEDER C, PÖTTER R, VAN LIMBERGEN E, et al. Recommendations from gynaecological (GYN) GECESTRO working group (Ⅰ): concepts and terms in 3D imagebased 3D treatment planning in cervix cancer brachytherapy with emphasis on MRI assessment of GTV and CTV [J]. Radiother Oncol, 2005, 74(3): 235-245.
[4] PÖTTER R, HAIE-MEDER C, VAN LIMBERGEN E, et al. Recommendations from gynaecological (GYN) GEC ESTRO working group (Ⅱ): concepts and terms in 3D image-based treatment planning in cervix cancer brachytherapy-3D dose vo1ume parameters and aspects of 3D image-based anatomy,radiation physics, radiobiology [J]. Radiother Oncol, 2006,78(1): 67-77.
[5] HELLEBUST T P, KIRISITS C, BERGER-D, et al. Recommendations from gynaecological (GYN) GEC-ESTRO working group: considerations and pitfalls in commissioning and applicator reconstruction in 3D image-based treatment planning of cervix cancer brachytherapy [J]. Radiother Oncol, 2010, 96(2): 153-160.
[6] DIMOPOULOS J C, PETROW P, TANDERUP K, et al. Recommendations from gynaecological (GYN) GEC ESTRO working group (Ⅳ): Basic principles and parameters for MR imaging within the frame of image based adaptive cervix cancer brachytherapy[J]. Radiother Oncol, 2012, 103(1): 113-122.
[7] EISENHAUERA E A, THERASSEB P, BOGAERTSC J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1) [J]. Eur J Cancer, 2009,45(2): 228-247.
[8] NAG S, CARDENES H, CHANG S, et al. Image-guided brachytherapy working group proposed guidelines for imagebased intracavitary brachytherapy for cervical carcinoma:report from image-guided brachytherapy working group [J]. Int J Radiat Oncol Biol Phys, 2004, 60(4): 1160-l172.
[9] KYUNG H S, TAE H K, JUNG K C, et al. CT-guided intracavitary radiotherapy for cervical cancer:comparison of conventional point A plan with cinical target volume-based three-dimensional plan using dose-volume parameters [J]. Int J Radiat Oncol Biol Phys, 2006, 64(1): 197-204.
[10] HELLEBUST T P, TANDERUP K, LERVAG C, et al. Dosimetric impact of interobserver variability in MRI-based delineation for cervical cancer brachytherapy [J]. Radiother Oncol, 2013, 107(1): 13-19.
[11] MAZERON R, CASTELNAU-MARCHAND P, DUMAS I, et al. Impact of treatment time and dose escalation on local control in locally advanced cervical cancer treated by chemoradiation and image-guided pulsed-dose rate adaptive brachytherapy [J]. Radiother Oncol, 2015, 114(2): 257-263.
[12] 安菊生, 黄曼妮, 徐英杰, 等. 宫颈癌常规放疗联合腔内三维放疗的初步研究 [J]. 中华放射肿瘤学杂志, 2014,23(5): 373-376.
[13] 叶伟军, 曹新平, 欧阳翼. 局部晚期宫颈癌三维CT引导下加速超分割后装治疗临床观察 [J]. 中华肿瘤防治杂志,2014, 21(8): 626-629.
[14] HARTER V, CHARRA B C, DELANNES M, et al. Impact of 3D image-based PDR brachytherapy on outcome of patients treated for cervix carcinoma in France: results of the French STIC prospective study[J]. Radiother Oncol, 2012, 103(3): 305-313.
[15] KIM R Y, SHEN S, DUAN J. Image-based three-dimensional treatment planning of intracavitary brachytherapy for cancer of the cervix:dose-volume histograms of the bladder, rectum,sigmoid colon, and small bowel [J]. Brachytherapy, 2007,6(3): 187-194.
[16] GEORG P, KIRISITS C, GOLDNER G, et al. Correlation of dose-volume parameters, endoscopic and clinical rectal side effects in cervix cancer patients treated with definitive radiotherapy including MRI-based brachytherapy[J]. Radiother Oncol, 2009, 91(2): 173-180.
[17] KANG H C, SHIN K H, PARK S Y, et al. 3D CT-based highdose-rate brachytherapy for cervical cancer: clinical impact on late rectal bleeding and local control [J]. Radiother Oncol,2010, 97(3): 507-513.
Clinical preliminary observation on image-guided brachytherapy for cervical cancer
GONG Wei,XU Xiaoting, LI Li, ZHANG Ruting, NI Jie, XU Yueliang, QIN Songbing, ZHOU Juying (Department of radiotherapy, the First Aff i liated Hospital of Soochow University, Suzhou 215006, Jiangsu, China)
XU Xiaoting E-mail: szting110@163.com
Background and purpose: The radiation therapy is the main treatment of cervical cancer. In order to investigate the eff i cacy and toxicity of the 3D image-guided brachytherapy for cervical cancer, we analyzed dose-volume histogram (DVH) dose distribution and clinical data from 31 cases of cervical cancer treated with three dimensional brachytherapy. Methods: From May. 2013 to Dec. 2014, 31 cervical cancer cases with FIGO stageⅡa-Ⅳ received comprehensive treatment in our department. High risk-clinical target volume (HR-CTV) was 400-600 cGy per fraction, and totally 4-6 fractions for each patient. A total of 152 times 3D-CT guided brachytherapy was performed with192Ir high-dose-rate afterloader. We calculated the doses with EQD2 and analyzed the data on HRCTV D90, bladder D2cc, sigmoid D2cc, rectum D0.1cc and rectum D2cc of both the external-beam radiotherapy and CT-guided brachytherapy. The efficacy and toxicity were evaluated by RTOG/EORTC and RECIST (version 1.1)guideline. Results: There was no third degree reaction occurring on bladder, rectum or sigmoid. Two patients developed second degree chronic rectal bleeding 3 months after the completion of radiotherapy which were well controlled by medications. The tumor complete remission rate (CR) was 93.55% (29/31) 1-3 months after the treatment. Local control rate (LCR) rate was 93.55% (29/31) one year after the treatment, whereas disease-free survival rate (DFS) was 90.32%(28/31). Conclusion: The 3D CT-guided brachytherapy combined with external radiation for locally advanced cervicalcancer showed positioning accuracy with an adequate dose distribution to the target area. The treatment made the OR dose visible, controllable and credible. It improved the treatment of patients with increased tolerance and avoided the severe radiation reactions. Thus, the combination therapy may greatly improve the quality of life for patients, and ought to be promoted.
Cervical cancer; Image-guided; 3D brachytherapy; Eff i cacy; Toxicity
10.3969/j.issn.1007-3969.2015.11.011
R737.33
A
1007-3639(2015)11-0906-05
2015-04-10
2015-06-23)
国家自然科学基金(81302384)。
徐晓婷 E-mail:szting110@163.com
