肿瘤出芽计数在预测T1期结直肠癌淋巴结转移中的应用价值
2015-04-18章琼燕赵胜男翁微微盛伟琪
章琼燕,赵胜男,王 磊,黄 丹,翁微微,盛伟琪
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 20032
肿瘤出芽计数在预测T1期结直肠癌淋巴结转移中的应用价值
章琼燕,赵胜男,王 磊,黄 丹,翁微微,盛伟琪
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 20032
盛伟琪,复旦大学附属肿瘤医院病理科主任医师,硕士生导师。中国抗癌协会肿瘤病理专业委员会青年委员,中国抗癌协会淋巴瘤专业委员会青年委员,上海市抗癌协会肿瘤病理专业委员会副主任委员兼秘书长。1992年毕业于原上海医科大学医学系获医学学士学位,2001年获复旦大学研究生院硕士学位,同年获得日本产业医科大学博士学位。1992年至今就职于复旦大学附属肿瘤医院病理科,从事肿瘤外科病理的诊断和研究,尤其是胃肠道肿瘤和恶性淋巴瘤的诊断、鉴别诊断及其相关研究。1999—2001年在日本产业医科大学第一病理部作为访问学者进行肿瘤分子和遗传学研究的学习和工作。曾在Annals of Oncology、Journal of Pathology、American Journal of Clinical Pathology、Human Pathology、Cancer Genetics and Cytogenetics和Applied Immunohistochemistry & Molecular Morphology等杂志发表论文数十篇。承担和参与多项国家自然科学基金项目和上海市科委研究项目。

背景与目的:肿瘤出芽是结直肠癌的不良预后因素。本研究使用10个高倍镜视野计数的方法评价肿瘤出芽,并分析其在预测T1期结直肠癌淋巴结转移中的临床应用价值。方法:通过计数307例T1期结直肠癌10个高倍镜视野下肿瘤出芽个数,参比临床病理特征,建立T1期结直肠癌淋巴结转移的风险分析公式,并在14例新病例中对该公式进行验证。结果:多因素分析结果显示,肿瘤分化水平、脉管侵犯和肿瘤出芽个数与T1期结直肠癌淋巴结转移显著相关。统计分析得出的淋巴结转移的风险分析公式为:Z=1.571×(脉管状态:侵犯为1;无侵犯为0)+2.661×(肿瘤分化:高级别为1;低级别为0)+0.024×(肿瘤出芽个数)-3.885,概率=1/1+e-Z。在14例新病例中得到了验证。结论:通过计数10个高倍镜视野下的肿瘤出芽个数,可以精确地评估淋巴结转移风险,从而协助临床作出合理的决策。
肿瘤出芽;淋巴结转移;结直肠癌;风险分析公式
结直肠癌是消化系统最常见的肿瘤,全球每年有超过120万的新发病例,60万人死于该疾病[1]。肠镜检查能够发现较小的早期病变,通过早期干预治疗可获得较好预后。早期结直肠癌是指肿瘤局限于黏膜层或者黏膜下层的病变。这部分患者可选择肿瘤局部切除[2],如内镜下黏膜切除术、内镜下黏膜下层剥除术及经肛门内镜微创手术等,都可完整切除早期病变。文献报道的限于黏膜层的病变几乎不发生淋巴结转移,而黏膜下层浸润的T1期肠癌发生淋巴结转移的比例为6.8%~17.8%[3-5]。目前,临床缺乏预测肿瘤局部切除后淋巴结转移的有效手段。如何准确评判肿瘤局部切除术后的淋巴结转移风险是一个关系患者后续治疗方案选择的难题。有研究发现,Ⅱ期结直肠癌中肿瘤出芽与淋巴结转移及预后显著相关[6-7]。然而,在早期结直肠癌中,肿瘤出芽能否预测肿瘤转移尚无深入研究。
肿瘤出芽是指在肿瘤的浸润前沿散在分布于间质中单个或者小于5个的小簇肿瘤细胞。研究发现肿瘤出芽是肠癌细胞发生上皮间质转化的特征性标志,是一个独立的不良预后因素,与肿瘤的复发和转移密切相关[8-13]。对于肿瘤出芽的评判方法目前没有统一的标准,不同研究采用不同的方法计数肿瘤出芽,计量方法包括:定性、定量、或者半定量法;计量范围包括:最密集区计数、肿瘤浸润前沿计数或整个肿瘤组织平均计数[6,8,14-16]。
在本研究中,我们使用10个高倍镜视野的方法计数肿瘤出芽,通过建立淋巴结转移的风险分析公式,客观评估淋巴结转移的概率,探索其在临床应用中的价值。
1 资料和方法
1.1 临床资料
本研究经复旦大学附属肿瘤医院临床研究伦理委员会批准。收集2008年1月—2014年4月在复旦大学附属肿瘤医院接受根治性手术治疗的T1期结直肠癌患者307例。另选取2014年8月后在我院手术治疗的T1期结直肠癌患者14例作为验证组。研究排除Lynch综合征、炎性反应性肠病和同期或曾患有进展期结直肠癌的病例。
1.2 研究方法
本研究从临床病史和病理报告中收集患者的年龄、性别、肿瘤部位、肿瘤大小和淋巴结转移情况等。由具有胃肠病理学专长的病理科医师复习所有病理切片,评估肿瘤出芽和相关病理特征。
肿瘤出芽的评价方法:低倍镜下(×100)浏览每个病例的所有HE染色切片,在肿瘤浸润的前沿寻找出芽最密集的区域,在该区域计数10个高倍镜视野(×400)下总的出芽个数。如果在低倍镜下没有发现明显的出芽区域,则随机选取10个高倍镜视野来计数出芽个数。
其他病理特征包括:肿瘤分化水平(低级别或高级别)、脉管侵犯(淋巴管或者血管)、黏膜肌状态(可评估或不可评估)、黏膜下浸润深度(根据Kudo分类分为SM1、SM2和SM3[17])、生长类型(浸润型或膨胀型)及是否合并背景腺瘤。
1.3 统计学处理
本研究采用Mann-Whitney U/Kruskal-Wallis检验方法来分析肿瘤出芽个数和病理特征之间的关系。使用χ2检验、Fisher精确检验、t检验、Mann-Whitney U检验和Logistic回归等方法来分析组织病理特征和淋巴结转移之间的关系。所有数据均采用SPSS 19.0软件包进行统计学分析。采用双侧检验的方法。P<0.05为差异有统计学意义。
2 结 果
2.1 临床特征
在307例患者中,男性159例,女性148例,男女比例1.1∶1.0。年龄27~86岁(中位年龄为60岁),平均59.8岁。肿瘤直径6~93 mm,平均20 mm。病变分别位于右半结肠(39例)、左半结肠(64例)和直肠(204例)。平均每例的淋巴结数目为13枚。
2.2 病理特征
所有病例在10个高倍镜视野下肿瘤出芽个数为0~138个,平均12个(图1)。分析肿瘤出芽个数和组织病理学特征的关系,发现肿瘤出芽个数与肿瘤分化水平、黏膜下浸润深度、脉管侵犯、肿瘤生长类型、黏膜肌状态和合并背景腺瘤显著相关(表1)。
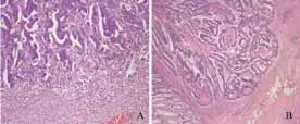
图 1 结直肠癌生长类型Fig. 1 The growth type of colorectal cancer
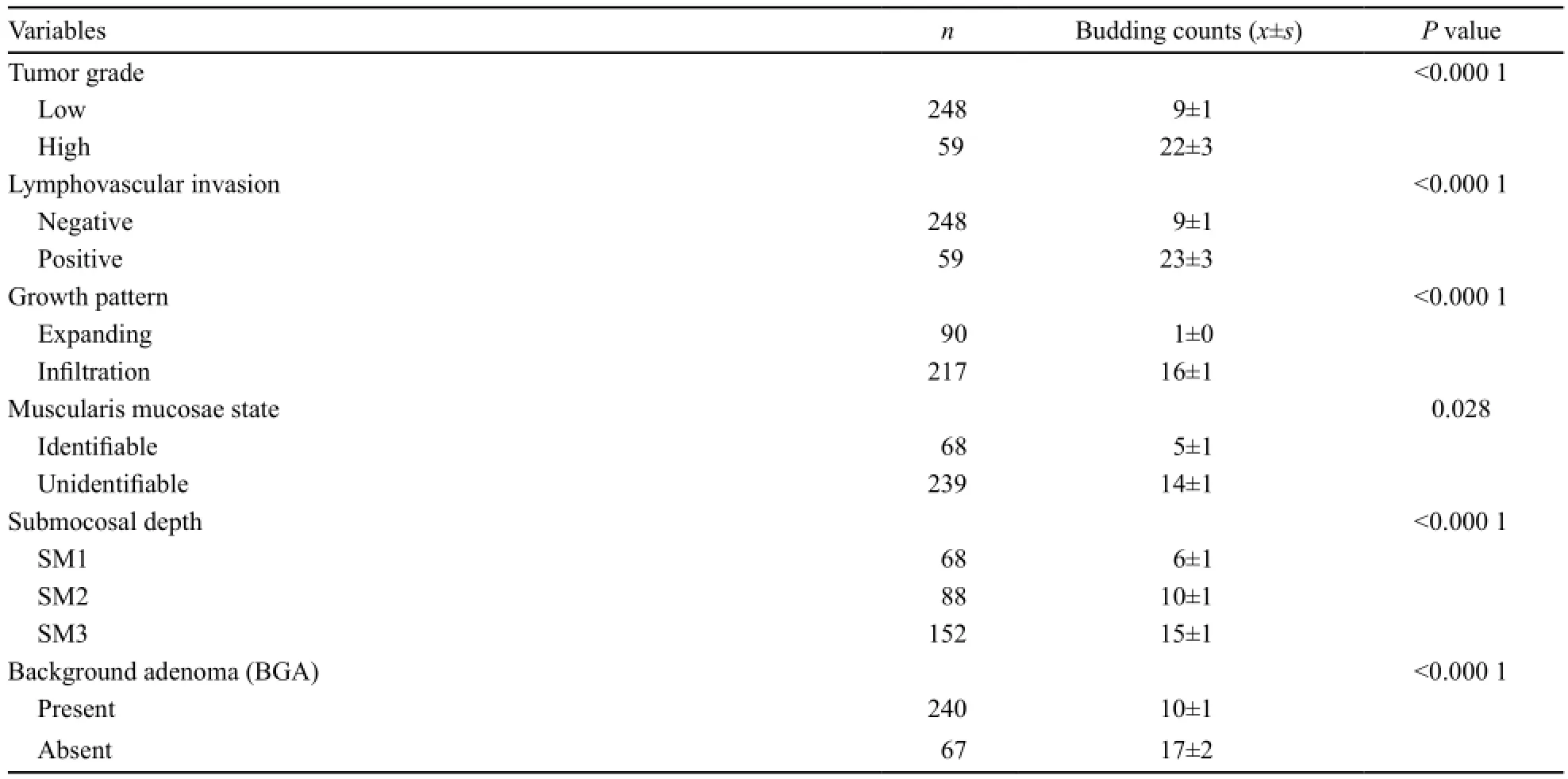
表 1 肿瘤出芽与T1期结直肠癌临床病理特征的联系Tab. 1 Correlation of tumor budding with histopathological features in T1colorectal cancer
2.3 淋巴结转移的危险因素分析
统计分析显示,13%的病例(40/137)出现了淋巴结转移。单因素分析显示,肿瘤分化水平、脉管侵犯和肿瘤出芽与淋巴结转移显著相关(表2)。多因素Logistic回归分析显示,肿瘤分化水平(HR=4.811,95%CI:3.943~5.870)、脉管侵犯(HR=14.315,95%CI:11.665~17.568)和10个高倍镜计数的肿瘤出芽个数(HR=1.025,95%CI:1.018~1.031)与淋巴结转移显著相关(表2)。
2.4 淋巴结转移风险分析公式的建立
在相同的肿瘤分化水平和脉管状态下,肿瘤出芽个数越多,淋巴结转移的概率越大。根据Logistic回归分析的结果,我们创建了一个淋巴结转移的风险分析公式:Z=1.571×(脉管状态:侵犯为1;无侵犯为0)+2.661×(肿瘤分化水平:高级别为1;低级别为0)+0.024×(肿瘤出芽个数)-3.885,概率=1/1+e-Z。
2.5 公式的验证
14例验证病例的临床病理特征见表3,通过淋巴结转移风险分析公式计算出相应的淋巴结转移风险概率。3例淋巴结阳性的病例公式计算出淋巴结转移风险概率分别为0.615、0.302和0.349。11例淋巴结阴性的病例公式计算出的风险概率为0.020~0.023。
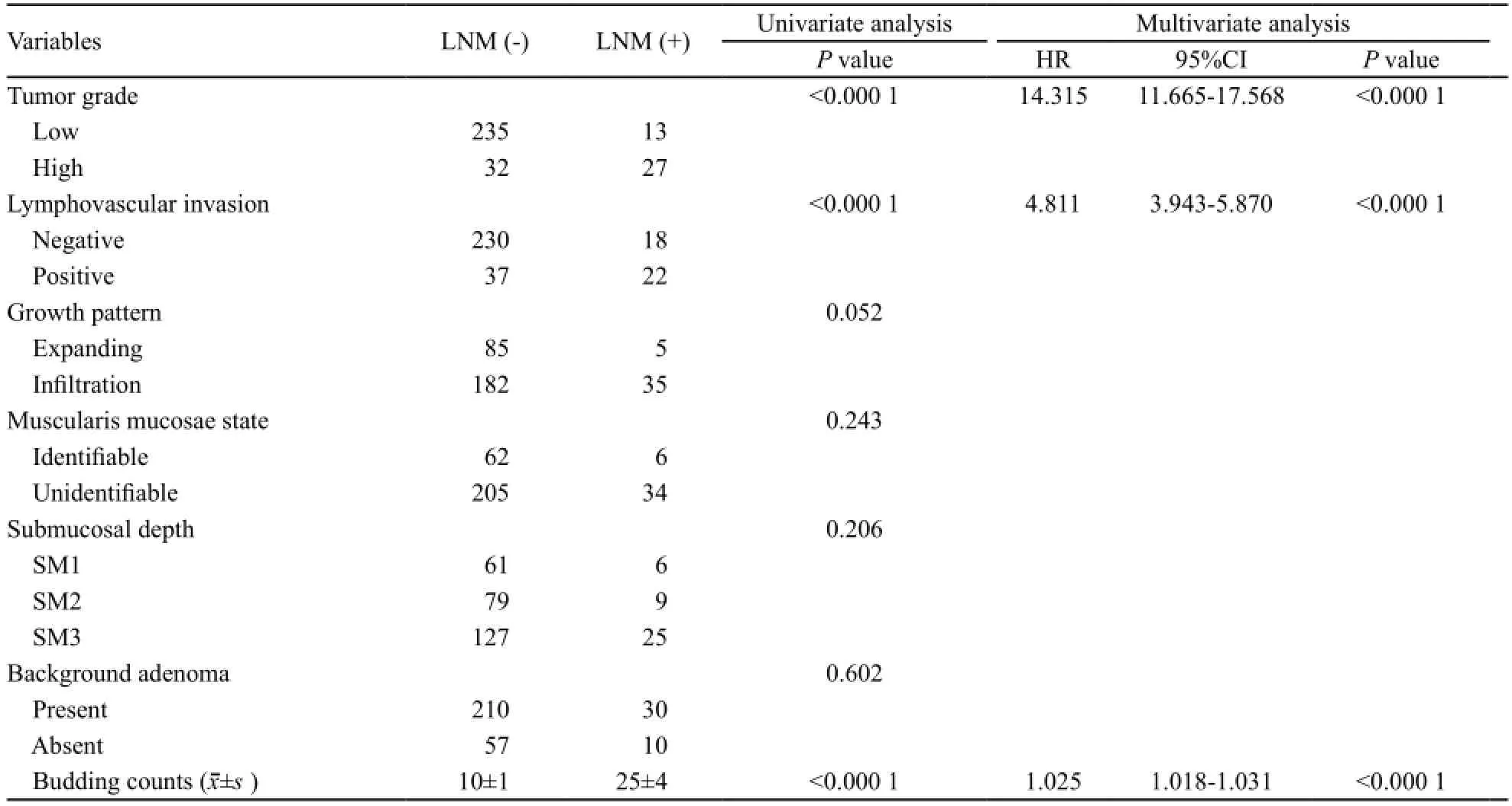
表 2 T1期结直肠癌淋巴结转移的临床病理单因素和多因素分析Tab. 2 Univariate and multivariate analysis of clinicopathological factors for T1colorectal cancer lymph node metastasis
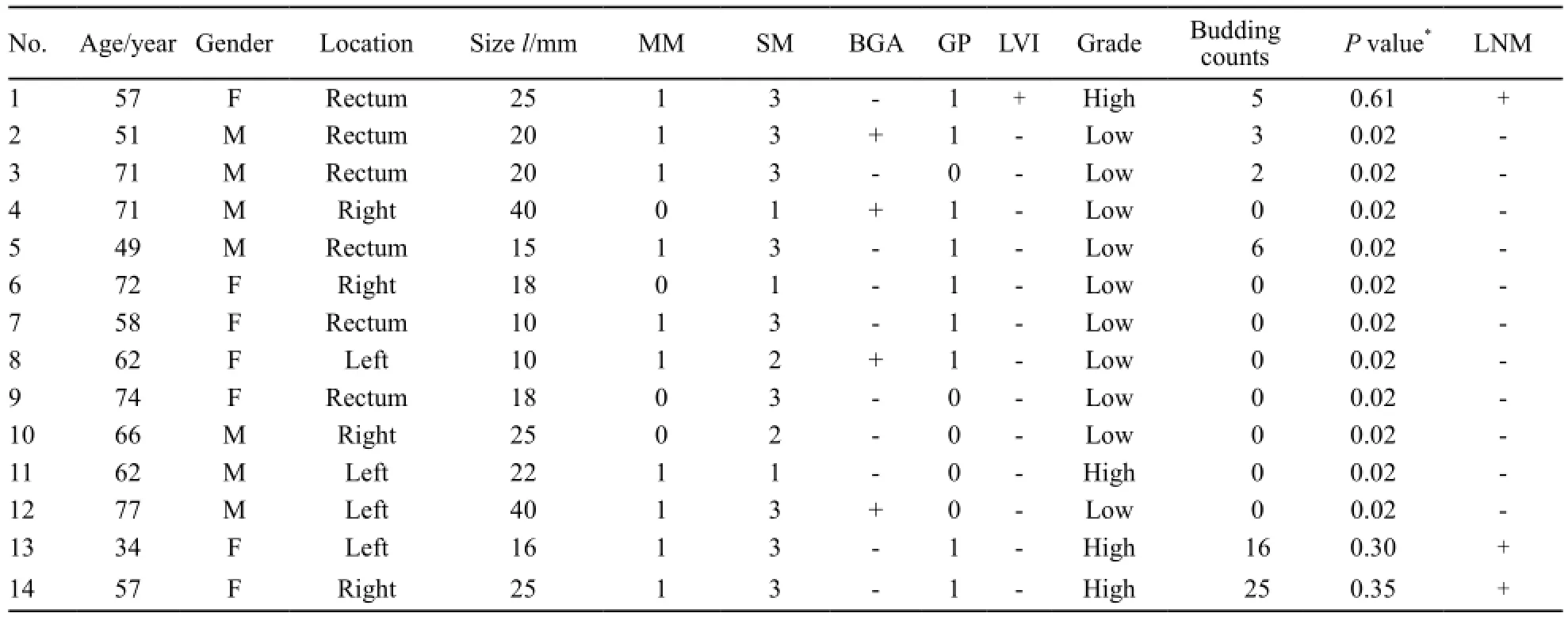
表 3 验证组T1期结直肠癌淋巴结转移情况对比分析Tab. 3 Clinicopathological details of the validation group of the 14 cases of T1colorectal cancer
3 讨 论
T1期结直肠癌淋巴结转移概率较低,患者可以通过损伤相对较小的内镜下切除治疗获得根治。但是,一部分患者可能有淋巴结转移的风险,本研究中T1期结直肠癌淋巴结转移率为13%,与既往文献报道的淋巴结转移率(10%)相似[3-5]。内镜下局部切除后如何精确评估淋巴结状态始终是临床关注的问题。但是,评估转移风险的病理标准尚未确立[18-19]。除了脉管侵犯和肿瘤分化水平这两个已被广泛接受的病理特征,肿瘤出芽已引起越来越多研究者的注意。一系列研究表明,肿瘤出芽与淋巴结侵犯、远处转移、肿瘤局部复发和较短的生存时间等显著相关[8-13]。本研究通过对307例T1期结直肠癌患者进行回顾性分析,发现肿瘤出芽和淋巴结转移显著相关,肿瘤出芽是预测淋巴结转移的一个重要影响因素。因此,我们通过单因素和多因素回顾性分析发现肿瘤出芽同样是T1期结直肠癌淋巴结转移的高危因素,可作为淋巴结转移风险评估客观指标之一,继而为临床后续治疗方案的选择提供参考。
病理切片中肿瘤出芽的判读缺少标准化的评价方法[6,8,14-16],不同的研究采用的计数方法各不相同。其中使用最广泛的是由Ueno等[10]提出的计数方法:在×20的物镜下(放大倍数为×200)计数出芽最密集区域的肿瘤出芽个数,根据阈值判断有否有肿瘤出芽。最近,Horcic等[6]比较了7种不同计数方法在105例Ⅱ期肠癌患者中的应用价值,结果显示,10个高倍镜视野计数肿瘤出芽的方法具有较好的准确性和可重复性,观察者之间一致性程度较高,并且独立于T分期和脉管侵犯而与临床结局显著相关,因此建议使用该方法计数肿瘤出芽。Karamitopoulou等[16]的研究也推荐使用10个高倍镜视野计数的方法。我们的研究方法与Ueno等[10]的计数法类似,通过低倍镜下初筛直接计数出芽最密集区10个高倍镜视野肿瘤出芽的具体个数。该计数方法一方面可避免肿瘤内肿瘤出芽分布异质性引起的选择偏倚[20],另一方面又可直接反映所选择的区域肿瘤出芽个数减少统计偏差。因此,这种10个高倍镜视野肿瘤出芽计数方法具有较好的准确性和可重复性。
在结直肠癌研究中综合各项危险因素构建风险分析公式,可以更加准确客观地评估不良事件的风险。Macias-Garcia等[21]通过对97例T1期结直肠癌患者的研究发现肿瘤浸润性生长、无淋巴细胞浸润、肿瘤分化差、无蒂的形态与淋巴结转移相关,并在此基础上构建了一个风险分析模型来评估淋巴结状态。此外,Masaki等[13,22]在T1和T2期结直肠癌中发现肿瘤出芽与淋巴结转移相关,构建了肿瘤出芽单因素的淋巴结转移风险分析公式。在后续验证病例中该公式可对淋巴结转移进行预测,但是由于公式仅包含肿瘤出芽一个变量,不能反映其他因素对淋巴结转移风险的影响。我们的研究不仅对肿瘤出芽与淋巴结转移的关系进行分析,而且在多因素分析的基础上建立多个变量的淋巴结转移风险分析公式,相关变量依据影响力进行权重,依据算式,可计算出淋巴结转移的概率。在后续14例新病例的验证中,公式计算的淋巴结转移概率与实际淋巴结转移情况相吻合,提示该公式具有一定的临床应用前景。
综上所述,在T1期结直肠癌中肿瘤出芽作为一个可量化的组织学指标,与临床病理特征密切相关。单因素和多因素分析显示,10个高倍镜视野下的肿瘤出芽个数与T1期结直肠癌淋巴结转移显著相关。本研究演算出的淋巴结转移风险分析公式能有效地预测淋巴结转移,可协助临床评估T1期结直肠癌患者淋巴结转移的风险。
[1] FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010, 127(12): 2893-2917.
[2] MORSON B C, WHITEWAY J E, JONES E A, et al. Histopathology and prognosis of malignant colorectal polyps treated by endoscopic polypectomy[J]. Gut, 1984, 25(5):437-444.
[3] OKA S, TANAKA S, NAKADOI K, et al. Risk analysis of submucosal invasive rectal carcinomas for lymph node metastasis to expand indication criteria for endoscopic resection[J]. Dig Endosc, 2013, 25 (Suppl 2): 21-25.
[4] SUH J H, HAN K S, KIM B C, et al. Predictors for lymph node metastasis in T1colorectal cancer[J]. Endoscopy, 2012,44(6): 590-595.
[5] TATEISHI Y, NAKANISHI Y, TANIGUCHI H, et al. Pathological prognostic factors predicting lymp node metastasis in submucosal invasive (T1) colorectal carcinoma[J]. Mod Pathol, 2010, 23(8): 1068-1072.
[6] HORCIC M, KOELZER V H, KARAMITOPOULOU E, et al. Tumor budding score based on 10 high-power fields is a promising basis for a standardized prognostic scoring system in stage Ⅱ colorectal cancer[J]. Hum Pathol, 2013, 44(5): 697-705.
[7] LAI Y H, WU L C, LI P S, et al. Tumour budding is a reproducible index for risk stratification of patients with stageⅡ colon cancer[J]. Colorectal Dis, 2014, 16(4): 259-264.
[8] UENO H, MURPHY J, JASS J R, et al. Tumour ‘budding’as an index to estimate the potential of aggressiveness in rectal cancer[J]. Histopathology, 2002, 40(2): 127-132.
[9] WATANABE T, ITABASHI M, SHIMADA Y, et al. Japanese Society for Cancer of the Colon and Rectum (JSCCR)guidelines 2010 for the treatment of colorectal cancer[J]. Int J Clin Oncol, 2012, 17(1): 1-29.
[10] UENO H, MOCHIZUKI H, HASHIGUCHI Y, et al. Risk factors for an adverse outcome in early invasive colorectal carcinoma[J]. Gastroenterology, 2004, 127(2): 385-394.
[11] BETGE J, KORNPRAT P, POLLHEIMER M J, et al. Tumor budding is an independent predictor of outcome in AJCC/ UICC stage Ⅱ colorectal cancer[J]. Ann Surg Oncol, 2012,19(12): 3706-3712.
[12] WANG L M, KEVANS D, MULCAHY H, et al. Tumor budding is a strong and reproducible prognostic marker in T3N0colorectal cancer[J]. Am J Surg Pathol, 2009, 33(1): 134-141.
[13] MASAKI T, MATSUOKA H, SUGIYAMA M, et al. Actual number of tumor budding as a new tool for the individualization of treatment of T1colorectal carcinomas[J]. J Gastroenterol Hepatol, 2006, 21(7): 1115-1121.
[14] PUPPA G, SENORE C, SHEAHAN K, et al. Diagnostic reproducibility of tumour budding in colorectal cancer: a multicentre, multinational study using virtual microscopy[J]. Histopathology, 2012, 61(4): 562-575.
[15] ROGERS A C, GIBBONS D, HANLY A M, et al. Prognostic significance of tumor budding in rectal cancer biopsies before neoadjuvant therapy[J]. Mod Pathol, 2014, 27(1): 156-162.
[16] KARAMITOPOULOU E, ZLOBEC I, KOLZER V, et al. Proposal for a 10-high-power-fields scoring method for the assessment of tumor budding in colorectal cancer[J]. Mod Pathol, 2013, 26(2): 295-301.
[17] IKEMATSU H, YODA Y, MATSUDA T, et al. Long-term outcomes after resection for submucosal invasive colorectal cancers[J]. Gastroenterology, 2013, 144(3): 551-559.
[18] KOGLER P, KAFKA-RITSCH R, OFNER D, et al. Is limited surgery justified in the treatment of T1colorectal cancer?[J]. Surg Endosc, 2013, 27(3): 817-825.
[19] MITROVIC B, SCHAEFFER D F, RIDDELL R H, et al. Tumor budding in colorectal carcinoma: time to take notice[J]. Mod Pathol, 2012, 25(10): 1315-1325.
[20] ZLOBEC I, LUGLI A. Epithelial mesenchymal transition and tumor budding in aggressive colorectal cancer: tumor budding as oncotarget[J]. Oncotarget, 2010, 1(7): 651-661.
[21] MACIAS-GARCIA F, CELEIRO-MUNOZ C,LESQUEREUX-MARTINEZ L, et al. A clinical model for predicting lymph node metastasis in submucosal invasive(T1) colorectal cancer[J]. Int J Colorectal Dis, 2015, 30(6): 761-768.
[22] MASAKI T, MATSUOKA H, SUGIYAMA M, et al. Tumor budding and evidence-based treatment of T2rectal carcinomas[J]. J Surg Oncol, 2005, 92(1): 59-63.
The clinical significance of tumor budding in predicting lymph node metastasis of T1 colorectal cancer
ZHANG Qiongyan, ZHAO Shengnan, WANG Lei, HUANG Dan, WENG Weiwei, SHENG Weiqi(Department of Pathology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
SHENG Weiqi E-mail: shengweiqi@163.com
Background and purpose: Tumor budding is a poor prognostic factor in colorectal cancer. In this study, we studied the tumor budding by counting the actual number in 10 high power fields and evaluated itsclinical application in predicting lymph node metastasis of T1colorectal cancer. Methods: Tissue specimens from 307 patients with histologically conf i rmed T1colorectal cancer were enrolled. The clinicopathological characteristics including tumor budding were evaluated for their predictive value in lymph node metastasis. A formula was created to calculate the risk score for prediction of lymph node metastasis which was validated by 14 new cases. Results: In the multivariate analysis, it showed that tumor grade, lymphovascular invasion and the number of tumor budding were signif i cantly associated with lymph node metastasis. The probability of lymph node metastasis was calculated using the following equations: Z=1.571×(lymphovascular state: invasion, 1; no invasion, 0)+2.661×(tumor grade: high grade,1; low grade, 0)+0.024×(budding counts)-3.885; Probability=1/1+e-Z. The high scores were correlated with the lymph node metastasis in the validations. Conclusion: We can accurately assess the risk of lymph node metastasis by counting the number of tumor budding in 10 high power fields. Therefore tumor budding could potentially assist treatment decision making in T1colorectal cancer patients with high-risk lymph node metastasis.
Tumor budding; Lymph node metastasis; Colorectal cancer; Risk score
10.3969/j.issn.1007-3969.2015.11.005
R735.3
A
1007-3639(2015)11-0865-06
2015-05-08)
盛伟琪 E-mail:shengweiqi@163.com
