一种霉菌产的人参皂苷酶水解Rb1和Rb2皂苷糖基的机理
2015-04-15张天杨刘春莹鱼红闪金凤燮大连工业大学生物工程学院辽宁大连116034
张天杨,刘春莹,鱼红闪,金凤燮(大连工业大学生物工程学院,辽宁大连 116034 )
一种霉菌产的人参皂苷酶水解Rb1和Rb2皂苷糖基的机理
张天杨,刘春莹,鱼红闪,金凤燮
(大连工业大学生物工程学院,辽宁大连116034 )
摘要:利用TLC法确定了一种霉菌产的特异人参皂苷酶水解Rb1和Rb2人参皂苷糖基的机理。结果表明,水解人参皂苷Rb1和Rb2的糖基种类和位置不同。水解Rb1皂苷时,先水解其20-O-β-(1→6) -葡萄糖苷键生成Rd,再依次水解Rd上2个3-O-β-(1→2) -葡萄糖苷键生成F2及终产物C-K;但在水解Rb2时,先水解其3-O-β-(1→2) -葡萄糖苷键生成C—O,再依次水解3-O-β-(1→2) -葡萄糖苷键和20-O-α-(1→6) -阿拉伯糖苷键生成C-Y和C-K。
关键词:特异人参皂苷酶;人参皂苷Rb1、Rb2;薄层层析法
0 引言
人参皂苷是人参的主要活性成分之一。天然存在的人参皂苷不一定是人参的最佳药效成分,需经肠道菌将其转化成活性更佳的成分,但这种转化受个体体质的限制明显[1]。本课题组多年致力于研究人参皂苷的生物转化,已发现并报道了多种人参皂苷酶[2-4]。本论文旨在通过研究人参皂苷Rb1和Rb2在人参皂苷酶作用下的水解机理,为今后人参皂苷的定向转化奠定一定的理论基础。
1 材料与方法
1.1材料与仪器
人参皂苷标准品Rb1、Rb2、Rd、C-O、F2、C-Y、C-K,本实验室提供;霉菌产人参皂苷酶,本实验室提供;薄层层析板Silica gel 60-F254;高效液相色谱仪。
1.2方法
1.2.1酶的提纯
将该种霉菌发酵所产的粗酶,通过DE-52离子交换树脂分离纯化后,将酶活力高的组分在非变性聚丙烯酰胺凝胶电泳(PAGE)中进一步纯化。分离胶质量分数10%,电压120 V,考马氏亮蓝染色。对照染色后的胶,将在未染色的凝胶上该酶带的位置割下,捣碎溶于0.02 mol磷酸缓冲液(pH 6.7),离心除去不溶性沉淀,获得的酶利用SDS-PAGE法确定电泳单点,再用高效液相色谱法确定是否单峰,确定为纯酶。
利用Waters 2695高效液相色谱分析仪,Waters 2996二极管阵列检测器及Empower色谱工作站检测蛋白;色谱柱,日本TOSOH TSK(Φ7.8 mm ×300 mm)流动相为0.02 mol/L(pH 6.7)磷酸缓冲液(含0.05%叠氮化钠)。进样量,100 μL;柱温,35℃;体积流量1.0 mL/min;检测波长,280 nm。
用SDS-PAGE法测定该酶的相对分子质量。
1.2.2底物的配制
称取110 mg的人参皂苷Rb1,溶于5 mL的已灭菌过的0.02 mol、pH 5.0的NaAc-HAc缓冲液,配制成20 mmol/L的Rb1底物溶液。同样方法配制Rb2底物溶液。
1.2.3酶反应
将2 mL底物与等体积的纯酶溶液混合,置于45℃条件下摇床反应,按不同时间,取200 μL酶反应液,并向其中加入等体积的水饱和正丁醇,终止酶反应,将反应物、产物转入正丁醇层。经薄层层析显色后,用Bandscan软件测定反应物和产物斑点比例,确定酶反应转化率(产物含量)。
1.2.4人参皂苷的检测方法
薄层层析法:反应液的正丁醇层(皂苷组分),在硅胶板上点样,层析缸中展开,展开剂V(氯仿)∶V(甲醇)∶V(水)=7∶2.5∶0.5(下层) ;展开后喷10%硫酸溶液,加热显色;确定酶反应转化率。
高效液相色谱法:将Rb1和Rb2反应液(水饱和正丁醇层)蒸干,称取1 mg溶于色谱甲醇,再经0.45 μm滤膜过滤,准备进样。色谱柱,Knauer C18(5 μm,Φ250 mm×3 mm)。流动相:乙腈(A) -水(B) ;流动相比例: 0~20 min,20% A等度; 20~31 min,20%~32% A线性梯度; 31~40 min,32%~43% A线性梯度; 40~70 min,43%~100%A线性梯度;进样量,30 μL;柱温,35℃,体积流量; 0.6 mL/min;检测波长,203 nm。
2 结果与讨论
2.1酶的提纯
经SDS-PAGE法初步检测,得到单一条带;经酶蛋白高效液相色谱测定,得到单一峰,说明该酶为纯酶,相对分子质量为74 ku。
2.2Rb1水解机理
薄层层析显色结果如图1所示。由图1可以看出,Rb1几乎全部被水解,主要产物为Rd、F2和C-K等,与实验室前期的研究结果一致。经Bandscan软件测定,3种物质质量分数分别为52%、21.7%和26.3%。由此可知,酶水解Rb1的反应式如图2所示。由图2可推断出,人参皂苷Rb1在特异人参皂苷酶的作用下糖基水解的机制为:首先水解Rb1上的20-O-β-(1→6) -葡萄糖苷键生成Rd,再水解Rd上3-O-β-(1→2) -葡萄糖苷键生成人参皂苷F2,接着水解F2上的3-O-β-(1→2) -葡萄糖苷键生成C-K。
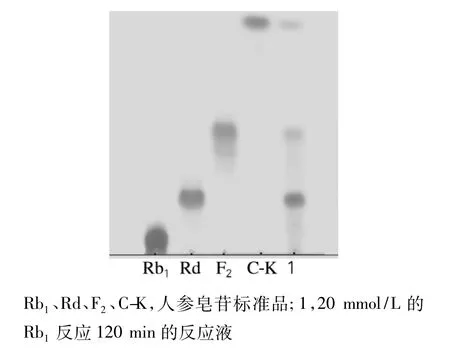
图1 特异人参皂苷酶水解Rb1的TLC图Fig.1 TLC of Rb1hydrolyzed by special ginsenosidase

图2 特异人参皂苷酶水解Rb1的反应式Fig.2 Reaction formula of Rb1hydrolysis by special ginsenosidase
2.3Rb2水解机理
薄层层析显色结果如图3所示。由图3可以看出,反应物中主要含有未反应的Rb2、产物C-O、C-Y和少量的C-K;经Bandscan软件测定,它们质量分数分别为39.8%、27.47%、29.55%和3.18%。
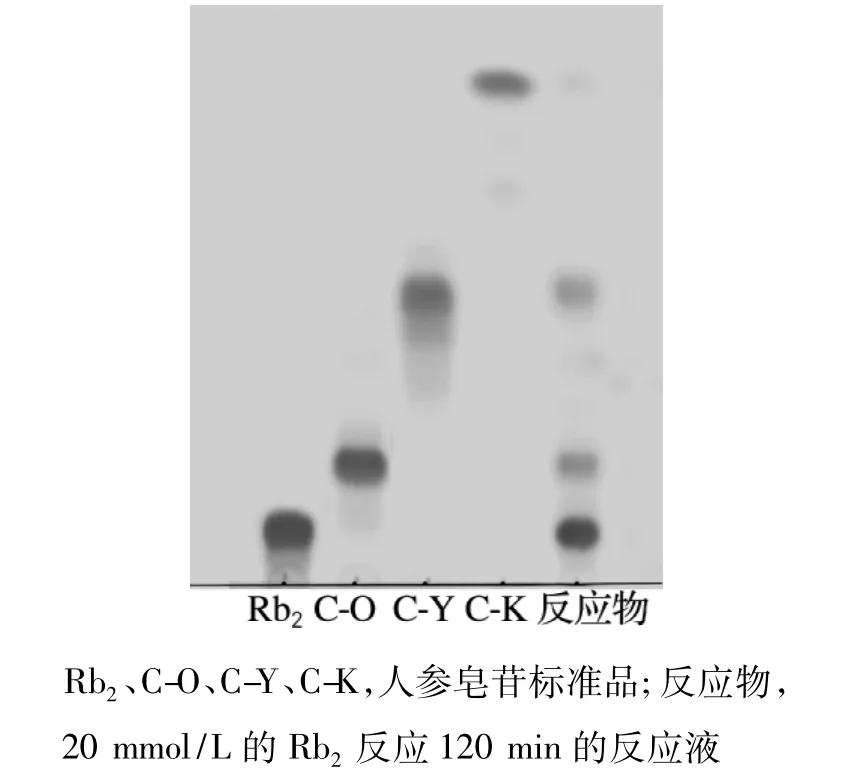
图3 特异人参皂苷酶水解Rb2的TLC图Fig.3 TLC of Rb2hydrolyzed by special ginsenosidase
利用高效液相色谱进行检测,结果如图4所示。从图4可以看出,反应物中主要含有未反应的Rb2、产物C-O、C-Y和少量的C-K;其Rb2、C-O、C-Y、C-K峰面积比与TLC结果相似。由此可见,人参皂苷Rb2在特异人参皂苷酶的作用下,其糖基水解的机制为:首先水解Rb2上的3-O-β-(1→2) -葡萄糖苷键生成C-O,再水解C-O的3-O-β-(1→2) -葡萄糖苷键生成C-Y,接着进一步水解C-Y上的20-O-α-(1→6) -阿拉伯糖苷键生成CK。其反应过程如图5所示。
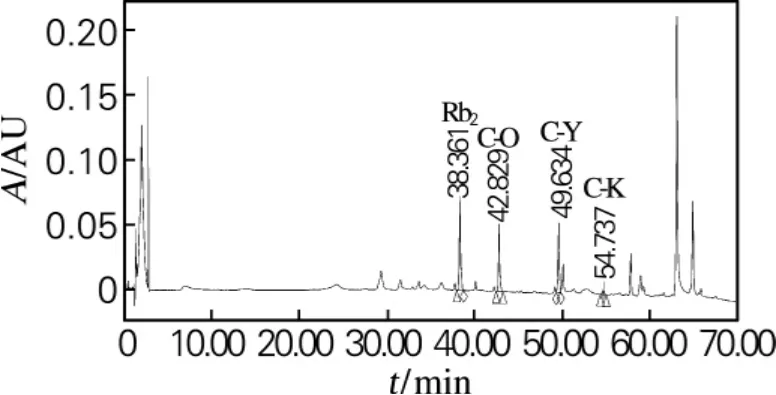
图4 Rb2水解产物的HPLC图Fig.4 HPLC of Rb2hydrolysis products
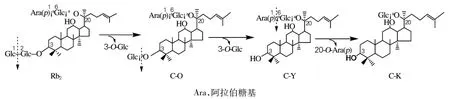
图5 特异人参皂苷酶水解Rb2的反应式Fig.5 Reaction formula of Rb2hydrolysis by special ginsenosidase
3 结论
特异人参皂苷酶水解Rb1和Rb2最终生成C-K途径不同,水解Rb1时先水解20-O-糖基,水解Rb2时先水解3-O-糖基;但是该酶能水解Rb1和Rb2的多种糖基,属于人参皂苷酶I型。
参考文献:
[1]李翠翠,庄子瑜,刘廷强,等.转化人参二醇类皂苷为C-K的特异人参皂苷糖苷酶的纯化及性质[J].大连工业大学学报,2010,29(1) :11-14.(LI Cui-cui,ZHUANG Zi-yu,LIU Ting-qiang,et al.Purification and characterization of the special ginsenosidase transforming protopanaxadiol ginsenosides into ginsenoside C-K[J].Journal of Dalian Polytechnic University,2010,29(1) :11-14.)
[2]金赞敏,鱼红闪,金凤燮.人参皂甙-α-鼠李糖苷酶分离提纯及其酶性质[J].大连轻工业学院学报,2003,22(2) :103-106.(JIN Zan-min,YU Hong-shan,JIN Feng-xie.Purification and characterization of ginsenoside-α-rhanmosidase [J].Journal of Dalian Institute of Light Industry,2003,22(2) :103-106.)
[3]YU Hongshan,ZHANG Chunzhi,LU Mingchun,et al.Purification and characterization of new special ginsenosidase hydrolyzing multi-glycisides of protopanaxadiol ginsenosides,ginsenosidase typeⅠ[J].Chemical and Pharmaceutical Bulletin,2007,55(2) :231-235.
[4]YU Hongshan,JIN Fengxie,WANG Dongming,et al.Kinetics of a cloned special ginsenosidase hydrolyzing 3-O-glucoside of multi-protopanaxadiol-type ginsenosides,named ginsenosidase typeⅢ[J].Journal of Microbiology and Biotechnology,2012,22(3) :343-351.
Hydrolysis of glycosides in Rb1and Rb2by ginsenosidase from a mold strain
ZHANG Tianyang,LIU Chunying,YU Hongshan,JIN Fengxie
(School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China )
Abstract:The hydrolysis mechanisms of Rb1and Rb2by ginsenosidase from a mold strain were determined by TLC.The results showed that enzyme hydrolysis were related with the glycosides types and position on ginsenoside Rb1and Rb2.When hydrolyzing Rb1,the enzyme firstly hydrolyzed 20-O-β-(1→6) -glucopyranoside bond of Rb1to Rd,then hydrolyzed 3-O-β-(1→2) -glucopyranoside of Rd to F2,final to C-K.But the enzyme hydrolyzed 3-O-β-(1→2) -glucopyranoside of Rb2to C-O,then to C-Y,finally hydrolyzed 20-O-α-(1→6) -arabinoside of C-Y to C-K when hydrolyzing Rb2.
Key words:biotransformation; special ginsenosidase; ginsenoside Rb1and Rb2;TLC
作者简介:张天杨(1987-),女,硕士研究生;通信作者:金凤燮(1945-),男,教授.
基金项目:“重大新药创制”科技重大专项(2012ZX09503001-003).
收稿日期:2014-04-10.
文章编号:1674-1404(2015) 03-0160-03
中图分类号:TS201.2; Q946.83
文献标志码:A
