医疗器械软件标准体系建设探讨
2015-04-15彭亮郑佳余新华
彭亮,郑佳,余新华
1.国家食品药品监督管理总局医疗器械技术审评中心, 北京 100044;2.中国食品药品检定研究院(国家食品药品监督管理总局医疗器械标准管理中心), 北京 100050
医疗器械软件标准体系建设探讨
彭亮1,郑佳2,余新华2
1.国家食品药品监督管理总局医疗器械技术审评中心, 北京 100044;2.中国食品药品检定研究院(国家食品药品监督管理总局医疗器械标准管理中心), 北京 100050
基于我国软件工程标准的划分方法,结合IEC医疗器械软件相关标准的调研及其标准划分方法,本文提出了我国医疗器械软件标准体系建设的基本原则和工作建议。我国医疗器械软件标准可以从监管用途和适用范围两个维度进行分类,技术机构可以采取分阶段逐步推进的方式进行筹建,标准实施需要考虑我国国情和监管体制。
医疗器械软件;软件标准;标准体系建设
医疗器械软件包括本身预期作为医疗器械的软件(独立软件)和作为医疗器械内部组成部分的软件(软件组件)。随着科学技术日新月异的发展,医疗器械软件发展迅猛,发挥的作用越来越强,但其质量问题也不容忽视,是当前医疗器械监管的热点之一。
目前,国际上医疗器械软件的标准体系尚不建全,也无专设的标准化技术委员会。我国仅转化了4份国际标准,其等同转化版本为YY/T 0664-2008、YY/T 0708-2009、YY 0637-2008和YY 0721-2009[1-4],未建立医疗器械软件的标准体系,也未成立相应的标准化技术委员会或工作组。如何开展医疗器械软件标准体系的建设工作,为医疗器械软件的监管提供技术依据,实现医疗器械软件的有效监管,是当前医疗器械软件监管工作的重要课题之一。
本文结合我国软件工程标准体系和IEC(国际电工委员会)医疗器械软件相关标准情况,基于前期软件标准的调研来探讨我国医疗器械软件标准体系的建设工作。
1 我国软件工程标准体系情况
依据GB/T 15538-1995《软件工程标准分类法》[5],我国软件工程标准以“标准划分”和“软件工程划分”两个维度进行分类。
1.1 标准划分维度
用于描述标准的作用,分为以下4种情况:
(1)过程标准:用于规范产品开发或提供服务的系列活动,包括方法、技术和度量等标准。
(2)产品标准:用于规范阶段性成果的内容和格式,包括软件开发和维护过程文档要求等标准。
(3)行业标准:用于规范软件工程行业的自身要求,包括职业、认证等标准。
(4)记法标准:用于规范软件工程行业交流的方法,包括术语、语言等标准。
1.2 软件工程划分维度
用于描述与标准相关的软件工程特性,分为以下2种情况:
(1)任务功能:可细分为产品工程功能(包括需求分析、设计、编码、产品支持等标准)、验证与确认功能(包括评审、测试等标准)、技术管理功能(包括过程管理、产品管理和资源管理等标准)。
(2)软件生存周期:可细分为概念、需求、设计、实现、测试、制造、安装、运行和废止九个阶段的标准。
以上软件工程标准划分方法系统且全面,但较为复杂,由于医疗器械软件的特殊性,有些术语并不符合医疗器械的用语习惯,因此,我国医疗器械软件标准体系可以借鉴其主要划分维度和名称,但不适合直接全面照搬。
2 IEC医疗器械软件相关标准及体系情况
2.1 IEC医疗器械软件相关标准
目前,IEC已发布的和正在制定的医疗器械软件相关标准或技术报告主要有:
(1)IEC 62304:2006。该标准由IEC/TC62A负责制定,已等同转化为YY/T 0664-2008《医疗器械软件 软件生存周期过程》[1],用于规范医疗器械软件的生存周期过程,适用于医疗器械软件的开发和维护。目前该标准正处于修订阶段,主要修订包括安全性级别的判定中引入了风险概率因素、增加了关于遗留软件的要求、补充了对过程评估模型(MediSPICE)的介绍等[6]。
(2)IEC 60601-1-4:2000。该标准由IEC/TC62A负责制定,已等同转化为YY/T 0708-2009《医用电气设备 第1-4部分:安全通用要求 并列标准 可编程医用电气系统》[2],是IEC 60601-1的并列标准,用于规范可编程医用电气系统的安全要求,适用于软件组件的开发设计过程。目前该标准已被IEC 60601-1第3.1版整合为第14章,不再作为独立标准。
(3)IEC 62366:2007[7]。该标准由IEC/TC62A负责制定,用于规范制造商分析、识别、设计、验证和确认可用性的过程,以保证医疗器械使用的安全性。我国已开展对该标准的研究并正在转化之中,尚未发布实施。
(4)IEC 82304-1[8]。该标准由IEC/TC62A负责起草,尚未发布实施,基于IEC 62304、IEC 62366规范了独立健康软件的确认工作,用于规范独立健康软件的产品安全。
(5)IEC TR 80002-1:2009[9]。该技术报告由IEC/ TC62A负责制定,是医疗器械软件实施ISO 14971风险管理的指南。我国已开展对该技术报告的研究并正在转化之中,尚未发布实施。
(6)IEC 80001-1:2010[10]。该标准由IEC/TC62A负责制定,用于规范医疗器械网络安全性,定义了相关的角色、职责和活动,用以保证医疗器械的安全性、有效性和数据安全性。我国尚未转化该标准。
(7)IEC 62083:2000。该标准由IEC/TC62C负责制定,已等同转化为YY 0637-2008《医用电气设备 放射治疗计划系统的安全要求》[3],用于规范放射治疗计划系统软件方面的安全要求。我国目前正在转化该标准的最新版。
(8)IEC 62274:2005。该标准由IEC/TC62C负责制定,已等同转化为YY 0721-2009《医用电气设备 放射治疗记录与验证系统的安全》[4],用于规范放射治疗记录与验证系统软件方面的安全要求。
除了上述标准之外,IEC还有一些医疗器械软件标准正在制定或已经发布,由于篇幅所限不再逐一介绍。此外,IEC拟计划制定一批新的医疗器械软件标准,需要我国持续跟踪进展情况并积极实质性参与相应的标准化工作。
2.2 IEC医疗器械软件标准体系情况
尽管IEC医疗器械软件相关标准主要由IEC/TC62A负责制定,但是由于负责起草的工作组不同,各标准的适用范围和要求存在交叉,因此需要梳理各标准之间的相互联系和差异,以便更好地使用这些标准。下面以IEC 62304为例进行分析:
(1)IEC 62304和IEC 60601-1-4同为生存周期过程标准,主要差别在于:① IEC 62304适用于独立软件和软件组件,而IEC 60601-1-4仅限于软件组件;② IEC 62304适用于软件开发和维护过程,而IEC 60601-1-4仅限于软件开发设计过程;③ IEC 62304将风险等级分为三级,而IEC 60601-1-4未划分风险等级,只是强调风险不同相应工作也不同;④ IEC 62304可以独立使用,而IEC 60601-1-4是IEC 60601-1的并列标准,不能单独使用。
(2)IEC 62304和IEC 82304-1联系紧密,IEC 62304是IEC 82304-1的基础,IEC 82304-1是IEC 62304的补充,二者相辅相成,主要差别在于:① IEC 62304是过程标准,而IEC 82304-1是产品安全标准;② IEC 62304适用于医疗器械软件,而IEC 82304-1适用于独立健康软件(包括医用独立软件和非医用独立软件);③ IEC 62304适用于软件开发和维护过程,而IEC 82304-1仅限于软件确认。
(3)IEC 62304和IEC TR 80002-1也联系紧密,IEC 62304要求根据医疗器械软件的安全性级别开展相匹配的风险管理工作,而IEC TR 80002-1是开展医疗器械软件风险管理的通用指南,二者结合可以使医疗器械软件的风险管理工作更具操作性,主要差别在于IEC 62304还包括其他软件生存周期过程。
综上所述,IEC虽然制定和发布了一些医疗器械软件相关标准,但仍然不能覆盖医疗器械软件的全部方面,需要在现有标准的基础上不断提出制修订计划,逐步建立和健全医疗器械软件标准体系。同时,IEC目前对医疗器械软件标准体系并未进行统一规划,但各标准大体上是按照监管用途和适用范围来划分的。我国医疗器械软件标准绝大多数转化自IEC标准,故软件标准划分方法基本上可以直接参照IEC的情况,但要考虑监管要求的差异。例如我国把GB/T 25000.51-2010《软件工程 软件产品质量要求与评价(SQuaRE) 商业现货(COTS)软件产品的质量要求与测试细则》[11]作为独立软件的产品性能标准,该标准虽然等同转化IEC 25051:2006,但不是医疗器械行业标准,国外并无相应要求。
3 我国医疗器械软件标准体系建设探讨
围绕着医疗器械软件标准服务于医疗器械软件监管的要求,医疗器械软件标准体系的建设工作需要重点考虑解决以下3个方面的问题。
3.1 标准框架
主要是确定医疗器械软件标准的划分方法和整体框架,为医疗器械软件标准的制修订规划提供依据。参考我国软件工程标准的划分方法,基于IEC医疗器械软件相关标准的隐含划分方法,我国医疗器械软件标准可以按照监管用途和适用范围两个维度进行划分(表1)。
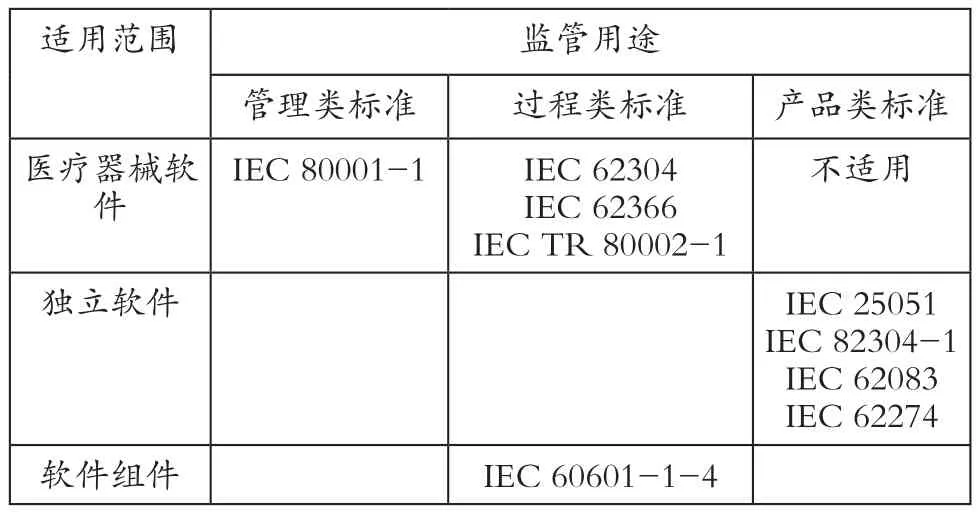
表1 我国医疗器械软件标准划分方法
按照监管用途可划分为管理类标准、过程类标准和产品类标准。其中过程类标准可用于质量管理体系考核,如生存周期(IEC 62304、IEC 60601-1-4)、可用性(IEC 62366)和风险管理(IEC TR 80002-1)等标准;产品类标准可用于产品检测与注册,如通用产品性能(IEC 25051)、通用产品安全(IEC 82304-1)和专用产品安全(IEC 62083、IEC 62274)等标准;管理类标准可用于支持法规制定,如术语定义、网络安全(IEC 80001-1)等标准。
按照适用范围可划分为医疗器械软件类标准、独立软件类标准和软件组件类标准。其中医疗器械软件类标准包括适用于医疗器械软件的标准,如IEC 62304、IEC 62366、IEC TR 80002-1和IEC 80001-1等标准;独立软件类标准包括仅适用于医疗器械独立软件的标准,如IEC 25051、IEC 82304-1、IEC 62083和IEC 62274等标准;软件组件类包括仅适用于医疗器械软件组件的标准,如IEC 60601-1-4等标准。
根据表1可以规划今后我国医疗器械软件标准制修订的计划。例如,管理类标准需要考虑制定关于医疗器械软件术语定义的标准,以便统一医疗器械行业的软件术语。考虑到医疗器械联网使用日益普遍,管理类标准可以考虑转化IEC 80001-1等标准。考虑到IEC 25051不是医疗器械行业标准,有些要求并不符合医疗器械软件的监管要求,同时IEC 82304-1已明确定位为产品安全标准,并非产品性能标准,因此产品类标准可以考虑制定医疗器械独立软件的产品性能标准。
3.2 技术机构筹建
主要是确定开展医疗器械软件标准化工作的主体。医疗器械软件标准化技术机构的筹建可以统筹规划、协调推动我国医疗器械软件的标准化工作,有利于统一医疗器械行业的认识和要求,有利于促进医疗器械软件的监管工作。具体筹建工作可以采取由小到大分阶段逐步推进的方式。
首先成立医疗器械软件标准化工作组,其组成包括体系考核、检测和审评等相关人员,跟踪并参与IEC医疗器械软件相关标准化工作,负责通用的医疗器械软件标准和管理类标准的制修订工作。
然后在工作组的基础上根据《全国专业标准化技术委员会管理规定》[12]成立医疗器械软件标准化技术委员会,其组成包括体系考核、检测、审评、研发、用户等相关人员,积极参与并协调IEC医疗器械软件相关标准化工作,统一全面负责我国医疗器械软件标准的制修订工作。
随着经验的不断积累和工作的不断推进,在医疗器械软件标准化技术委员会下,基于现有医疗器械标准化技术委员会的情况和表1的划分方法成立若干个专业工作组,分别负责相应专业领域的医疗器械软件标准化工作,例如过程类标准可由质量管理工作组负责,软件组件类和产品类专用标准可由各专业工作组(基于现有医疗器械标准化技术委员会)负责。这样既可以突出专业特点,又可以点面结合,能够切实做好相关专业领域的医疗器械软件标准化工作。
3.3 标准实施
主要是根据我国国情和监管体制,确定医疗器械软件标准的实施方案。医疗器械软件标准除规范医疗器械软件的安全和性能外,服务于医疗器械软件监管也是其重要作用之一,如果医疗器械软件标准不具有操作性或可操作性较差,就没有达到标准制修订的预期目的。
例如,YY/T 0664-2008虽已转化多年,但由于监管资源和条件所限并未真正实施,而YY/T 0708-2009由于我国检测机构与国外认证机构的职能不同也较难落实。考虑到我国国情和监管情况,这些标准的实施难以一步到位,可以分阶段分类别逐步开展。
因此,医疗器械软件标准的实施需要结合我国国情和监管体制,在制修订过程中要考虑其实施问题,需要明确实施主体、监管主体和实施方法。对于条件和时机成熟的国际标准应尽快转化并实施,对于条件和时机不太成熟的国际标准可以考虑先转化再逐步实施,而对于条件和时机不成熟的国际标准可持续跟踪研究而暂不转化。
总之,医疗器械软件标准体系的建设是一个系统性工作,不仅要考虑医疗器械软件国际标准的现状与发展趋势以及我国国情与监管体制,而且还要考虑医疗器械软件标准的划分与框架、技术机构建设和具体实施问题,这样才能建立健全符合我国监管要求、服务于行业发展的医疗器械软件标准体系。
[1] YY/T 0664-2008,医疗器械软件 软件生存周期过程[S].
[2] YY/T 0708-2009,医用电气设备 第1-4部分:安全通用要求并列标准 可编程医用电气系统[S].
[3] YY 0637-2008,医用电气设备 放射治疗计划系统的安全要求[S].
[4] YY 0721-2009,医用电气设备 放射治疗记录与验证系统的安全[S].
[5] GB/T 15538-1995,软件工程标准分类法[S].
[6] IEC 62304 Ed 2.0,Medical device software–Software life cycle processes(CD)[S].
[7] IEC 62366:2007,Medical devices-Application of usability engineering to medical devices[S].
[8] IEC 82304-1,Health Software–Part 1:General requirements for product safety (3WD)[S].
[9] IEC TR 80002-1:2009,Medical device software-Part 1:Guidance on the application of ISO 14971 to medical device software[S].
[10] IEC 80001-1:2010,Application of risk management for IT-networks incorporating medical devices–Part 1:Roles, responsibilities and activities[S].
[11] GB/T 25000.51-2010,软件工程 软件产品质量要求与评价(SquaRE)商业现货(COTS)软件产品的质量要求与测试细则[S].
[12] 国家标准化管理委员会.关于印发《全国专业标准化技术委员会管理规定》的通知[OL].http://www.sac.gov.cn/bgs/ zxtz/201012/t20101214_59019.htm
Discussion on Construction of a Medical Device Software Standard System
PENG Liang1, ZHENG Jia2, YU Xin-hua2
1. Center for Medical Device Evaluation of CFDA, Beijing 100044, China; 2. National Institutes for Food and Drug Control (Center for Medical Device Standardization Administration of CFDA), Beijing 100050, China
In combination with the investigation of the relevant IEC medical device software standards and the analysis of its classi fi cation method of medical device software standards, the basic principles and work suggestion were proposed in this paper for construction of a standard system for the medical device software based on the classification method of software engineering standards in China. The medical device software standards in China can be classi fi ed according to the regulatory purpose and application scope. The standard system of the medical device software can be established stage by stage by the standardization institution. Additionally, the national conditions and supervisory system in China should be taken into consideration in its implementation.
medical device software; software standard; standard system construction
R197.39
A
10.3969/j.issn.1674-1633.2015.03.017
1674-1633(2015)03-0059-04
2014-07-21
国家技术支撑计划课题(2012BAI22B00)。
邮箱:yuxinhua@nifdc.org.cn
