基于CT共轨系统的鼻咽癌调强放疗中解剖结构变化的研究
2015-04-15夏邦传徐子海廖福锡周燕华朱超华
夏邦传,徐子海,廖福锡,周燕华,朱超华
中国人民解放军第三〇三医院放疗科,广西 南宁 530021
基于CT共轨系统的鼻咽癌调强放疗中解剖结构变化的研究
夏邦传,徐子海,廖福锡,周燕华,朱超华
中国人民解放军第三〇三医院放疗科,广西 南宁 530021
目的通过对CT共轨系统获得的CT图像进行分析,量化鼻咽癌患者调强放疗分次治疗过程中的解剖结构变化,如原发肿瘤或淋巴结肿块的缩小、水肿区及整体体重的变化等,以期为临床治疗计划的重新设计提供依据。方法选取16例经病理诊断为鼻咽癌,原发病灶或肿大淋巴结最大直径≥4 cm,接受调强放疗的患者;所有患者于整个治疗期间在CT共轨系统上接受每周3次,各次治疗体位相同的日常验证CT;在每层图像上重新手动勾画大体肿瘤靶区(GTV)和正常组织,分析所有患者分次治疗过程中解剖结构的变化。结果GTV在整个治疗期间以平均0.22 cm3/d的速率发生退缩,与原体积相比平均每天退缩2.06%;最后一次治疗结束时,GTV对比原病灶平均缩小了68.12%。腮腺体积也以平均0.10 cm3/d的速率发生退缩。结论在鼻咽癌调强放疗分次治疗期间,患者的解剖结构会发生明显的变化,GTV及危及器官体积、位置的变化在治疗3~4周后尤为明显,可能会导致高度适形治疗计划中各组织实际受照剂量与原治疗计划产生较大偏差。临床上应注重寻求调强放疗分次治疗过程中的解剖结构变化的规律,以利于开展自适应放疗,最大程度地提高治疗增益比。
CT共轨系统;鼻咽癌;调强放疗;解剖结构变化;自适应放疗
0 前言
调强放疗技术具备显著的物理剂量学优势,已广泛应用于鼻咽癌的治疗,是鼻咽癌的标准治疗方法[1]。调强放疗是否能够在保护好周围正常组织和器官的基础上切实提高肿瘤局控率是临床关注的重点问题,其中肿瘤靶区在整个放疗过程中是否能够得到足够且准确的剂量是关键[2]。
近年来建立在图像引导基础上的调强放疗计划设计已取得了长足的进步。高度适形治疗计划可在最大程度上保证肿瘤覆盖率的同时给正常组织的保护留下足够的剂量空间,但治疗计划在实施之初就存在着一些理论上可能会导致剂量偏差的因素。这些因素除了原始的肿瘤靶区及正常组织勾画的不确定性外,还包括整个放疗过程中(6~7周)的摆位误差以及器官体积和位置的变化[3]。
有些鼻咽癌患者在整个调强放疗过程中会发生明显的解剖结构变化,包括原发肿瘤或淋巴结肿块的缩小、水肿区及整体体重的变化等[4]。当前对这些变化的测量都只是定性分析,如对放疗过程中大体肿瘤靶区(GTV)的消退情况及位置变化的研究一般只基于放疗前、中、后3次总的疾病特征检查结果[5],而这些检查结果对于评价持续数周的调强放疗过程中发生的肿瘤及正常组织的解剖结构变化是远远不够的。
放疗过程中解剖结构变化具有重要的临床意义,如随着时间的推移,患者体重的持续下降将导致固定装置松动从而造成日常摆位的不精确,进而可能造成肿瘤靶区的欠量或正常组织的过量照射[6]。目前,放疗计划基本都是基于治疗前的定位CT图像来设计,通常由外放一定范围形成的潜在亚临床靶区(CTV),加上可以预见的摆位误差及器官分次运动的范围形成计划靶区(PTV)。然而,上述外放范围通常没有考虑到随后6~7周治疗过程中解剖结构的变化情况[7]。CT共轨系统可以使患者在治疗体位下多次获得组织位置及解剖结构的信息,最大程度地减少不同体位造成的摆位误差[8]。本研究基于CT共轨系统,重点关注放疗过程中组织解剖结构中心位置及体积的变化。
1 材料和方法
1.1 病例选择
随机选择16例于2011年5月~2013年10月在我科进行调强放疗的鼻咽癌患者。所有患者均经病理组织证实,GTV包括原发灶及颈部CT下可视的最大直径≥4 cm的肿大淋巴结。所有患者可以接受同步放化疗,但不能接受新辅助化疗。
1.2 治疗方法
按照调强放疗标准处理过程,患者均采用仰卧位,经头颈肩热塑网膜固定,进行CT增强扫描定位,扫描范围为从颅顶至锁骨下3 cm,扫描层厚为3 mm,将获得的定位CT图像传至Oncentra MasterPlan3.3治疗计划系统进行治疗计划设计。PGTVnx处方剂量为74 Gy/33 F,PGTVnd为70 Gy/33 F,PTV1为62 Gy/33 F,PTV2为56 Gy/33 F[9]。
所有患者都在CT共轨系统下进行调强放疗,在同一治疗体位下获得日常验证CT图像。经患者本人同意,一旦开始治疗,则每周进行3次验证CT扫描,经整个治疗过程共获得18~21次的验证CT图像。设置每周一、三、五进行扫描,扫描条件同原定位CT扫描,每次扫描过程约2~3 min。CT扫描造成的额外剂量相对于患者的治疗剂量可以忽略不计。
1.3 统计分析
将每次治疗获得的验证CT图像导入治疗计划系统。每层CT图像上的GTV和正常组织(双侧腮腺、脊髓、脑干、下颌骨)均经同一医师手动勾画。GTV及腮腺体积的计算由治疗计划系统自带的计算软件完成。采用SPSS 19.0软件包进行统计分析,均数比较采用配对t检验,相关性研究采用Spearman秩相关。
2 结果
2.1 病人临床特征
所有患者都接受了调强放疗,并按要求完成了验证CT扫描,其中12例接受了同步化疗。原计划每例患者将接受共18~21次的验证CT扫描,实际中位值为17次(范围为12~18次)。次数缺失的原因包括设备本身故障、日程安排表、患者拒绝等,大部分次数缺失发生在治疗接近结束时,分析可能是患者此时想尽量减少摆位时间,以避免放疗后期的副反应。
2.2 GTV分次变化
GTV在整个放疗过程中发生退缩,平均速率为0.22 cm3/d(范围为0.02~0.86 cm3/d);与原体积相比,按百分比计算,GTV平均每天退缩2.06%(范围为1.35%/d~2.58%/d)。GTV分次变化图,见图1。图1(a)显示的是原发肿瘤体积的变化情况,图1(b)显示的是肿大淋巴结体积的变化情况,可以看出,当肿瘤及淋巴结较大时其体积变化较大;两图斜率大致相同,意味着原发肿瘤和肿大淋巴结(作为GTV治疗)以相近的速率退缩。最后一次治疗结束时,GTV对比原病灶平均缩小了68.12%(范围为44.41%~85.31%)。需注意的是不同医生在勾画小体积的肿瘤或淋巴结的GTV时可能会有差异[10]。
肿瘤体积退缩速率与在定位CT上确定的原体积大小密切相关,见图2(Spearman相关系数为0.862,P<0.001)。原体积大小是肿瘤退缩速率的决定因素,较小靶区也符合其线性变化趋势。
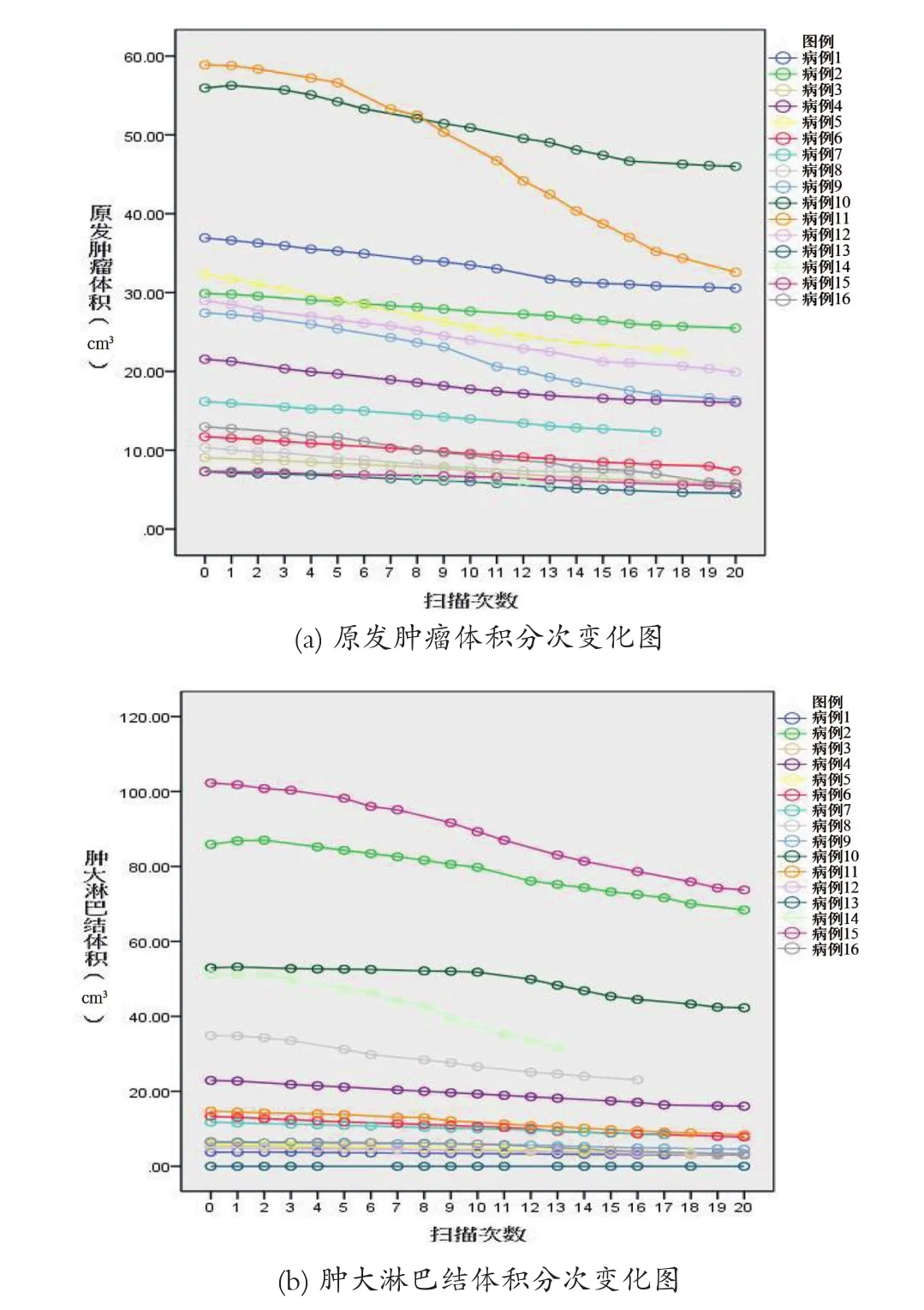
图1 GTV分次变化图
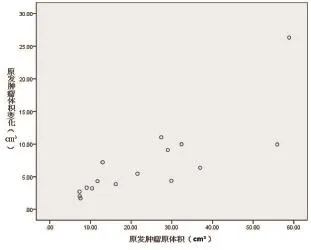
图2 肿瘤原体积大小与退缩速率的关系图
2.3 正常组织体积变化
在放疗期间,腮腺体积退缩明显。图3显示的是腮腺绝对体积的分次变化情况(在数据分析中,将两侧腮腺作为两个独立的器官分别进行研究)。腮腺体积以平均0.10 cm3/d的速率发生退缩(范围为0.02~0.22 cm3/d)。

图3 腮腺体积分次变化图
3 讨论
本研究利用鼻咽癌调强放疗分次治疗过程中获取的一系列验证CT图像来确定解剖结构随时间产生的三维变化率,以找出肿瘤及危及器官体积的变化规律。GTV随时间的退缩变化率与原体积大小密切相关,这种变化并不仅局限于肿瘤本身,腮腺体积也随时间发生了有规律的退缩。
目前,为了维持原发肿瘤局控率同时减少正常组织的损伤,人们对调强放疗等高度适形放疗技术的兴趣越来越高[11]。在应用调强放疗技术时,本研究发现,解剖结构的变化随时间的推移有潜在影响剂量分布的可能,这意味着与原治疗计划相比,多数剂量将会被投射至偏离原解剖结构的位置;此外,研究还发现腮腺的内移与整个治疗过程中患者体重的减轻显著相关,这表明显著的体重变化可能是腮腺发生较大内移的一个重要指标,可量化腮腺的偏移量从而为治疗计划的重新设计提供依据[12-13]。
本研究数据可为临床治疗计划的重新设计提供参考,如肿瘤的退缩速率与原肿瘤体积密切相关,当肿瘤体积超过一定范围时就需在疗程中重新设计计划;腮腺内移与患者体重减轻密切相关,可确定一个阈值,当体重减轻超过该阈值时就需重新设计计划;如果上述变化随时间的推移导致CTV覆盖率降低或正常组织受照剂量升高,那么在整个治疗过程中制定自适应放疗计划就很有必要了。
此外,我们还发现体积变化在统计学上有明显趋势,这可能是多因素如水肿、炎症或者其他反应等造成的;还有1个可能的原因是在非增强的平扫CT图像上手动勾画解剖结构固有的不准确性。对于后者,可能的解决方案是都利用增强CT图像进行勾画,但是反复利用造影剂在临床上是不适合大规模推广的。在探讨随时间推移产生的解剖结构变化对剂量的影响时,不同观察者间的轮廓勾画存在一定的差异,如果在自适应放疗中应用手动勾画轮廓,那么不同观察者间的差异应予以考虑[14]。本研究中因所有解剖结构都是由同一医生勾画,故观察者间的差异可以忽略。
4 结论
本研究定量分析了16例接受调强放疗的鼻咽癌患者GTV和正常组织的体积变化,在整个治疗过程中都可测量到解剖结构的改变。患者外轮廓的几何变化、靶区形状和位置的变化都可能导致治疗的非最优化,特别是对于高度适形的治疗技术如调强放疗,这些变化将导致靶区剂量不足或部分危及器官的受量增加,因此有必要在疗程中重新设计治疗计划[15]。临床上应注重寻求调强放疗分次治疗过程中的解剖结构变化的规律,以利于开展自适应放疗,最大程度地提高治疗增益比[16]。
[1] Kam MK,Teo PM,Chau RM,et al.Treatment of nasopharyngeal carcinoma with intensity-modulated radiotherapy: the Hong Kong experience[J].Int J Radiat Oncol Biol Phys,2004,60:1440-1450.
[2] Elz'bieta SK,Edmund N,Ilona B,et al.Changes in lateral dimensions of irradiated volume and their impact on the accuracy of dose delivery during radiotherapy for head and neck cancer[J].Radither Oncol,2006,79:304-309.
[3] 罗京伟,傅卫华,阎蒂,等.头颈部癌调强放疗过程中腮腺及靶区体积变化的临床分析[J].中华放射肿瘤学杂志,2006,(2):129-132.
[4] 易俊林,高黎,黄晓东,等.416例鼻咽癌调强放疗远期生存与影响因素分析[J].中华放射肿瘤学杂志,2012,21(3):196-200.
[5] 曹建忠,罗京伟,徐国镇,等.鼻咽癌调强放疗中靶区和正常器官变化规律及临床意义探讨[J].中华放射肿瘤学杂志,2007, 16(2):81-85.
[6] 杭霞瑜,刘海,李益坤,等.鼻咽癌螺旋断层放疗与常规调强放疗的剂量学分析[J].中国医疗设备,2013,28(12):15-18.
[7] 张达光,蒋胜鹏,李智华,等.鼻咽癌调强放疗中解剖结构改变及剂量分布变化的研究[J].中国医学物理学杂志,2013,30(4): 4239-4242.
[8] Court L,Rosen I,Mohan R,et al.Evaluation of mechanical precision and alignment uncertainties for an integrated CT/ LINAC system[J].Med Phys,2003,30:1198-1210.
[9] 殷蔚伯,余子豪,徐国镇,等.肿瘤放射治疗学[M].4版.北京:中国协和大学出版社,2007:175-182.
[10] Al-Qaisieh B,Ash D,Bottomley DM,et al.Impact of prostate volume evaluation by different observers on CT-based post implant dosimetry[J].Radither Oncol,2002,62:267-273.
[11] 于金明,殷蔚伯,李宝生.肿瘤精确放射治疗学[M].1版.济南:山东科学技术出版社,2004:24-25.
[12] Eisbruch A,Ten Haken RK,Kim HM,et al.Dose, volume, and function relationships in parotid salivary glands following conformal and intensity-modulated irradiation of head and neck cancer[J].Int J Radiat Oncol Biol Phys,1999,45:577-587.
[13] Dawson LA,Anzai Y,Marsh L,et al.Patterns of local regional recurrence following parotid-sparing conformal and segmental intensity-modulated radiotherapy for head and neck cancer[J].Int J Radiat Oncol Biol Phys,2000,46:1117-1126.
[14] Zhou SM,Bentel GC,Lee CG,et al.Differences in gross target volumes on contrast vs. noncontrast CT scans utilized for conformal radiation therapy treatment planning for prostate carcinoma[J].Int J Radiat Oncol Biol Phys,1998,42:73-78.
[15] Kuriyama K,Onishi H,Sano N,et al.A new irradiation unit constructed of self-moving gantry-CT and LINAC[J].Int J Radiat Oncol Biol Phys,2003,55:428-435.
[16] Yan D,Vicini F,Wong J,et al.Adaptive radiation therapy[J].Phys Med Biol,1997,42(1):123-132.
Study on Anatomic Changes During IMRT for NPC Based on the CT-on-Rail System
XIA Bang-chuan, XU Zi-hai, LIAO Fu-xi, ZHOU Yan-hua, ZHU Chao-hua
Department of Radiation Oncology, The 303rdHospital of PLA, Nanning Guangxi 530021, China
ObjectiveThis paper was intended to quantify the anatomic changes in NPC (Nasopharyngeal Carcinoma) patients during their IMRT (Intensity Modulation Radiated Therapy) through analysis of CT images acquired by the CT-on-rail system, including shrinkage of the primary tumor, lymphatic nodal masses as well as changes in the edema area and weight, so as to provide the basis for re-design of clinical treatment plans.MethodsSixteen pathologically-con fi rmed NPC patients whose primary lesions or lymphatic nodes were ≥4 cm in maximal diameter were enrolled in this pilot study. All the eligible patients were treated with IMRT and the CT-on-rail system thrice a week during the entire course of IMRT, which allowed for veri fi cation of CT images in patients with the same position in each radiotherapy session. Both gross tumor volumes (GTV) and normal tissues were manually contoured on every axial slice. Results Shrinkage of GTV occurred at the mean speed of 0.22 cm3/d throughout the course of IMRT, which meant 2.06% shrinkage per day in comparison with the original volumes. On the last day of treatment, the GTV averagely shrunk 68.12% of the original one; while, the volume of parotid glands also degraded at the mean speed of 0.10 cm3/d.ConclusionPatients with NPC may experience anatomic changes throughout the course of IMRT. Changes in GTV as well as the volume and position of the a ff ected organ became even more obvious especially in 3 to 4 weeks post-treatment and could result in large deviation between the actual radiation dose used in adaptive radiotherapy for each organ and that in the initial treatment plan. The regularity of anatomic changes during IMRT should be taken into account, which was convenient to deploy the adaptive radiotherapy and maximize the therapeutic ratio.
computerized-tomography-on-rail system; nasopharyngeal carcinoma; intensity modulation radiated therapy; anatomic changes; adaptive radiotherapy
TP391.41
A
10.3969/j.issn.1674-1633.2015.03.004
1674-1633(2015)03-0017-04
2014-11-23
广西卫生厅自筹基金课题(Z2013535)。
作者邮箱:xiabangchuan@tom.com
