镉在烟草中的积累分配及其对烟草生长的影响
2015-04-15刘海伟王树声
贺 远,刘海伟,石 屹,鹿 莹,常 帅,王树声*
(1.农业部烟草生物学与加工重点实验室,中国农业科学院烟草研究所,青岛266101;2.中国农业科学院研究生院,北京 100081)
镉在烟草中的积累分配及其对烟草生长的影响
贺远1,2,刘海伟1,石屹1,鹿莹1,2,常帅1,2,王树声1*
(1.农业部烟草生物学与加工重点实验室,中国农业科学院烟草研究所,青岛266101;2.中国农业科学院研究生院,北京 100081)
摘要:为了探明镉在烟草中的积累分配规律,采用盆栽试验,调查了不同镉浓度处理下烟草全生育期的生长及镉在烟草中的分配积累规律。结果表明,随着镉浓度的提高,同一时期烟草叶片的干物质量显著降低(p<0.01),茎部干物质量先升高后降低,根部干物质量在生长前期(30 d和45 d)逐渐降低,生长后期(60 d和75 d)先升高而后降低。各添加镉处理后,叶片镉含量均显著高于茎和根部,而对照镉含量根>茎>叶。烟叶中的镉含量表现为:下部叶>>中部叶>上部叶。烟草镉积累速率随着镉浓度的增加而升高,烟草各部位的镉积累规律为:快速积累—快速降低—缓慢积累。
关键词:烟草;镉;干物质量;积累速率
在过去的几十年里,重金属的毒性和生物有效性受到了极大的关注。农业土壤中的重金属污染是一个世界性的环境问题[1]。植物对重金属的吸收和积累,导致了植物组织各种形态及生理生化变化[2]。镉是土壤毒性最强且研究最多的重金属污染物之一[3]。镉是一种非必需元素,可以通过食物链对动物和人类产生毒害[4]。土壤中的镉主要来源于天然形成和人为造成,包括灌溉、施肥、大气沉降以及矿山开采、城镇和工业污水废物排放和再利用等[5-7]。在我国,随着现代工农业的发展,镉污染已经成为食品安全的一大隐患,截止到2010年,至少有1.33×104 hm2的农田已受到不同程度的镉污染[8-10]。
烟草是我国重要的基本农作物之一,具有十分重要的社会和经济作用。烟草是富集镉的植物,并且更易在叶片中积累[11-13]。作为一种非必需、潜在毒性强、高污染性的金属离子,镉易被烟草吸收,并通过烟气进入人体[14]。到目前为止,人们对镉在烟草中的积累和吸收速率的全生育期系统研究还比较少。因此,本研究以栽培面积较广的烟草品种K326为试验材料,采用盆栽的方法探讨不同镉浓度处理烤烟移栽后全生育期的生长变化,为揭示烟草中镉的分布和吸收速率特点,生产中获得安全、优质的烟叶提供理论依据。
1 材料与方法
1.1供试材料
烟草品种K326由中国烟草种质资源库提供。试验所用的土壤取自山东省诸城市,土壤质地为棕壤,其基础养分含量为:有效氮97.29 mg/kg,有效磷8.84 mg/kg,有效钾216.98 mg/kg,有机质1.50%,pH值为7.06。土壤经过消毒处理后,过筛,然后喷施不同浓度的醋酸镉溶液,溶液以分析纯醋酸镉[(CH3COO)2Cd·3H2O,分析纯]配制[0(CK),0.6,1.2,2.4和4.8 mg/kg]。混匀后的土壤在温室中老化2个月后备用。
1.2烟草幼苗培养与移栽
烟草种子经浸泡、灭菌、消毒后于28 ℃黑暗条件下催芽,发芽后移入石英砂培养基中在人工气候箱中培养至6叶1心期,选取大小一致的烟苗,用去离子水冲洗干净后移至塑料盆中,每盆装土15 kg,装土时配施基肥。5个不同镉浓度梯度各设置12盆重复,以供4个时期取样,每个时期取样3株。
1.3测试项目与方法
干物质量的测定:取样后分部位,于105 ℃杀青,75 ℃烘干至恒重。重金属含量的测定:采用微波消解,ICP-MS测定Cd含量[15]。
1.4数据处理与分析
数据采用SPSS 13.0进行统计分析。
2 结果
2.1烟草不同部位干物质量变化
从表1可以看出,不同浓度镉处理下烟草不同部位干物质量在同一时期均表现为:叶>茎>根。在同一时间内随着镉浓度的提高,烟草叶片的干物质量呈现降低的趋势,处理间的差异达到极显著水平(p<0.01)。烟草茎秆的干物质重量在同一时期随着镉处理浓度的增加而呈先升高后降低的趋势,0.6mg/kg镉处理下烟草茎秆的干物质量略高于对照,而后干物质量随着镉处理浓度的增加急剧降低。同一时期处理间的差异达到了极显著水平(p<0.01)。烟草根部的干物质量在生长前期(30 d和45 d)镉处理和对照处理条件下,呈现逐步降低的趋势;在生长后期(60 d和75 d),呈现先略微升高而后急剧降低的趋势;处理间的差异除移栽后的60 d达到显著水平外,其他时期Cd浓度处理间烟草根部的干物质量差异均达到极显著水平。
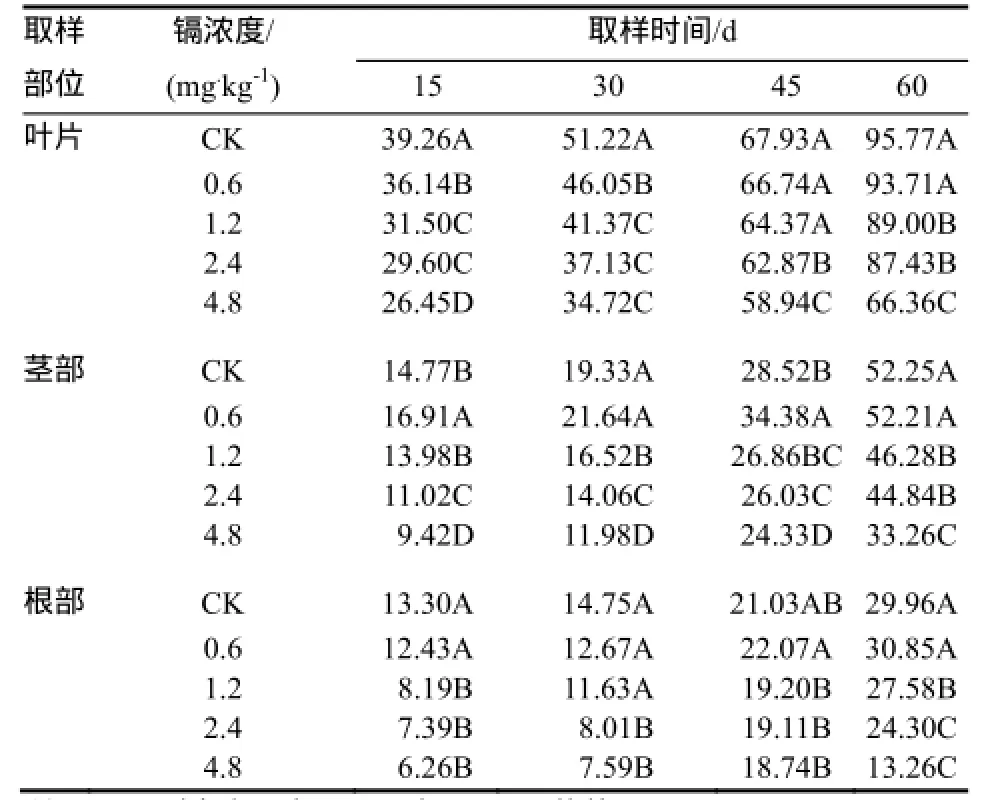
表1 不同镉浓度下烟草植株各部分干物质量g/株Table1 Biomass of different part of tobacco plant with different concentration of Cd at different periods
在同一时期,烟草整株的干物质量随着镉处理浓度的增加而降低,处理间的差异达到极显著水平(p<0.01);同一镉浓度处理下,随着生育期的后移烟草植株的干物质量均呈现增加的趋势。
2.2不同叶位烟叶干物质量变化
在烟草生长的后期,烟草的叶片依据其生长生理以及采摘的需要大致分为上中下3部分,为了更好的显示在烟草生长的后期镉对烟草不同叶位的叶片干物质量的影响,本研究在移栽后60 d和75 d将烟叶依据叶位的不同分为3部位,其干物质量随镉浓度的变化如表2所示。
在移栽后60 d时:上部叶干物质量仅在4.8 mg/kg高镉浓度处理下显著低于对照,其他处理与对照无显著差异。各镉处理中部叶和下部叶干物质量与对照均无显著差异。
在移栽后75 d时:中低镉浓度(0.6、1.2、2.4 mg/kg)处理,上部叶干物质量显著高于对照和高镉浓度(4.8 mg/kg)处理;而且高镉浓度(4.8 mg/kg)处理,上部叶干物质量显著低于对照。中部叶和下部叶干物质量基本上随镉处理浓度的增加而降低。
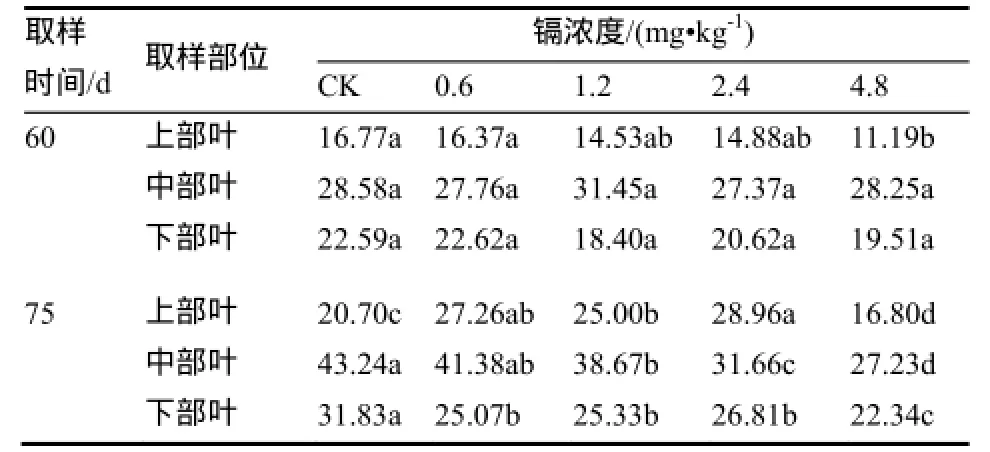
表 2 不同镉浓度处理下各叶位叶片干物质量 g/株Table 2 Leaf biomass at different positions of tobacco with different concentration of Cd.
2.3不同时期Cd含量变化
从图1中可以看出,不同镉添加水平下叶片镉含量明显高于茎和根部。随着镉浓度的升高,烟草不同部位的镉含量在不同时期变化趋势并不一致。但叶片和茎均在移栽后30 d镉含量最高,而根部则在高浓度(4.8 mg/kg)处理下随着生育期的后移一直升高,在移栽后75 d才急剧降低。
从图1还可以看出,在移栽后30 d,随着镉处理浓度的增加,烟草叶片和茎部的镉含量呈现逐步增加的趋势,而根部的镉含量则呈现升高—后降低—再升高的趋势,处理间差异显著;在移栽后45 d,茎部的镉含量呈现升高—后降低—再升高的趋势,处理间差异显著;在镉含量为2.4 mg/kg时,烟草根部的镉含量显著低于1.2 mg/kg处理(p<0.05);在移栽后60 d和75 d,随着镉浓度的升高,叶片、茎和根部的镉含量均呈现逐渐升高的趋势,且处理间差异达到显著水平(p<0.05)。
2.4不同叶位烟叶镉含量的变化
如图2所示,不同叶位的叶片镉含量随着镉浓度处理的升高而增加,在同一镉浓度处理下,随着时期的后移呈现降低的趋势。不同叶位烟叶镉含量表现为:下部叶>中部叶>上部叶。
上部叶片在镉浓度为2.4 mg/kg时,随着生育期的后移,镉含量呈现先显著降低再升高的趋势;在其他镉浓度处理下,上部叶片的镉含量均随着生育期的后移逐渐降低。在同一时期,上部叶片镉含量表现为随着镉浓度处理的提高而升高。
中部叶片在对照和低镉浓度处理下的规律并不明显,但是在高镉浓度处理下,随着生育期的后移中部叶片极显著的降低。下部叶片的镉含量在各个时期,随着镉处理浓度的增加均极显著上升。而在同一镉浓度处理下,下部叶片的镉含量随生育时期的变化规律不明显。
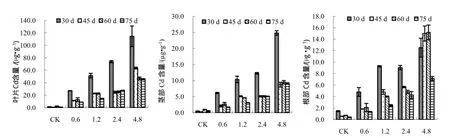
图1 不同镉浓度处理下烟草植株Cd含量变化Fig.1 Concentrations of Cd in 3 parts of tobacco plants with different Cd concentration at different periods
2.5不同部位镉积累速率的变化
从图3可以看出,移栽后30 d内烟草各部位镉积累速率均为正值,且镉积累速率随着镉处理浓度的提高而增大。在移栽后30 ~45 d内各部位镉积累速率均为负值,镉在烟草体内呈现外排的趋势。在移栽后45~60d烟草各部位的镉积累速率再次上升,其中4.8 mg/kg镉浓度处理下烟草的茎和根部的镉积累速率显著高于其他处理。
移栽后60~75 d,高浓度镉处理下,烟草叶片和茎部的镉积累速率显著高于对照;但是根部的镉积累速率表现为4.8 mg/kg镉浓度处理极显著低于其它处理。
从图3中还看出,在对照和低浓度镉(0.6 和1.2 mg/kg)处理下,烟草各部位镉的积累速率均呈现先降低再升高最后略微降低的变化趋势,但在2.4 mg/kg镉浓度处理下,烟草叶片和茎部位镉的积累速率在后期依然有所升高。根部的镉积累速率在2.4 mg/kg镉浓度处理下,呈现先升高后急剧降低的变化趋势,说明高浓度镉浓度处理下,烟草生长后期镉迁移到叶片和颈部的量增加。
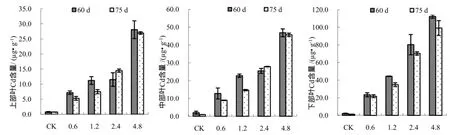
图2 不同镉浓度处理下各部位烟叶中镉含量变化Fig.2 Cd Concentrationsin 3 leaf positions of tobacco with different Cd concentration at different periods.

图3 不同镉浓度处理下各烟株部位中镉的积累速率Fig.3 Accumulation rate of Cd by 3 parts of tobacco plants with different Cd concentration at different periods.
3 讨论
镉并非烟草生长的必需元素,但却易于被烟草吸收。镉胁迫明显抑制烤烟的生长,且随浓度增加抑制程度加重。有研究表明,镉胁迫对作物生长发育造成严重的伤害,能够显著的降低作物的生物量[16-17]。本研究指出,在同一时期,烟草整株的干物质量随着镉处理浓度的增加而降低;同一镉浓度处理下,随着生育期的后移烟草植株的干物质量均增加,这与吴玉萍等[18]的研究结果一致。本研究结果显示,随着镉浓度的提高,叶片的干物质量在低浓度镉处理时比对照有所增加,在高浓度时均显著降低。
镉在烟株地上和地下部的分配模式在不同作物中存在较大差异。Wagner等[19]通过水培试验发现,普通烟草主要将镉储存在叶片和根部。袁祖丽[20]通过盆栽试验发现,当土壤中镉的添加量为3~6mg/kg时,根中镉的含量要略高于叶片中镉的含量,随着镉污染程度的继续增加,叶片中的镉含量才高于根。Clark等[21]通过盆栽试验研究了16个烟草品种在不同污染条件下镉的分配情况,发现在未添加外源镉的情况下,叶、茎和根中镉的含量分别为0.7、0.3和0.21mg/kg,当向土壤添加 0.25mg/kg镉后,镉含量分别增至86.9、14.5和21.2mg/kg。此与本试验的结果一致。本研究表明,添加镉处理,叶片镉含量显著高于茎和根部,表现为叶片和根部同时富集的现象。而对照镉含量为:根>茎>叶,虽然这一结论与Clark的研究不尽相同,但是这一现象在其他作物上得到证明[22-24],这些作物同样对镉有一定的富集现象。说明在环境中镉含量较低的情况下,烟草植株中的镉较多的集中在根部,而当环境中的镉含量升高以后,烟草全株对镉的吸收量增加,且较多的富集在叶片中研究表明镉在烟株不同叶位间的含量表现为下部叶>中、上部叶[25-27]。Frank[26-27]检测发现,加拿大安大略湖附近1971—1985年间烤烟下部叶中镉含量均高于中、上部叶。本研究结果表明,在烟草生长的前期,镉处理对烟草不同叶位的镉含量差异影响不大,随着时期的后移,镉含量表现为下部叶>>中部叶>上部叶,差异显著,说明镉主要被积累在下部叶片中,这与前人的研究一致。
Wang等[28]发现,玉米幼苗体内镉质量分数在10-6~10-5mol/L镉胁迫15 d内持续增加,而将玉米幼苗置于10-4mol/L镉浓度下其地上部和根系镉质量分数均随镉胁迫时间的延长呈先增后降的趋势。Barazani等[29]对细香葱的研究结果显示,细香葱在镉处理28 d内体内镉质量分数持续增加。而本研究结果显示,镉在烟草生长的前期,烟草具有较高的镉积累速率,但在生长的中期会外排镉,在生长的后期还会有较低的镉积累速率,但是叶片的镉积累速率依然较高,这与其他作物的研究不同。
有研究指出,植物对重金属胁迫的耐受性主要源自于植物本身产生螯合物质与之结合或通过各种途径将镉排出体外[30-32]。Dieter等[33]研究表明,在添加镉处理一定时间后,石竹叶表面上有许多微小的晶体,这是镉引起特定的盐腺以溶质的形式排出镉,而其根部表层细胞亦具有很高的镉含量。Choi等[34]研究指出,暴露在镉胁迫下的烟草幼苗能通过叶片表面的纤毛和腺体高效的向外排出含的镉晶体。本研究发现在烟草生长的中期,烟草各部位的镉呈现显著的外排现象,具体原因还有待进一步的研究。
4 结论
镉对烟草生长有显著影响,随着镉浓度的提高,烟草植株各部位的干物质重极显著降低,其生长受到明显的抑制。镉处理烟草叶片镉含量显著高于茎和根部,而对照镉含量为:根>茎>叶。在烟草采收前,烟叶中的镉含量表现为:下部叶>中部叶>上部叶。烟草镉积累速率随着镉浓度的提高而提高,由于烟草植株干物质量的增加,对镉的含量存在一定的稀释作用,烟草植株镉含量急剧降低但随着后期干物质量的稳定,镉含量又趋于稳定并略微升高,因此烟草各部位的镉积累规律为:快速升高-快速降低-缓慢升高。
参考文献
[1] Fassler E, Robinson B H, Gupta SK, et al. Uptake and allocation of plant nutrients and Cd in maize,sunflower and tobacco growing on contaminated soil and the effect of soil conditioners under field conditions[J]. Nutrient Cycling in Agroecosystems,2010, 87(3): 339-352.
[2] Doganlar Z, Atmaca M. Influence of airborne pollution on Cd, Zn, Pb, Cu, and Al accumulation and physiological parameters of plant leaves in Antakya(Turkey) [J]. Water Air and Soil Pollution, 2011,214(1/4):509-523
[3] Belimov. A A, Safronova V I, Tsyganov V E, et al. Genetic variability in tolerance to cadmium and accumulation of heavy metals in pea (Pisum sativum L.)[J]. Euphytica, 2003, 131(1): 25-35.
[4] Verkleij JosA C, Golan-Goldhirsh A, Antosiewisz D M,et al. Dualities in plant tolerance to pollutants and their uptake and translocation to the upper plant parts[J]. Environmental and Experimental Botany,2009: 67(1):10-22.
[5] Das P, Samantaray S, Rout G.R, Studies on cadmium toxicity in plants: a review[J]. Environmental Pollution,1997, 98(1):29-36.
[6] Arduini I, Ercoli L, Mariotti M, et al. Response of miscanthus to toxic cadmium applications during the period of maximum growth[J]. Environmental and Experimental Botany, 2006, 55(1-2):29-40.
[7] Singh S, Eapen S, D Souza S F. Cadmium accumulation and its influence on lipid peroxidation and antioxidative system in an aquatic plant, Bacopa monnieri L[J]. Chemosphere, 2006, 62(2):233-246.
[8] Liu Wei-tao, Zhou Qi-xing, Sun Yue-bing, et al. Identification of Chinese cabbage genotypes with low cadmium accumulation for food safety[J]. Environmental Pollution, 2009, 157(6): 1961-1967.
[9] Liu Wei-tao, Zhou Qi-xing, Sun Yue-bing, et al. Variations in cadmium accumulation among Chinese cabbage cultivars and screening for Cd-safe cultivars[J]. Journal of Hazardous Materials, 2010, 173(1-3):737-743.
[10] 杨祥田,周翠,何贤彪,等. 田间试验条件下不同基因型水稻对Cd和Pb的吸收分配特征[J]. 农业环境科学学报,2013,32(3):438-444.
[11] Clarke B B, Brennan E. Tobacco leaves accumulate cadmium from root applications of the heavy metal[J]. Tobacco Science, 1983, 27: 152-153.
[12] Wagner G J, Sutton T G, Yeargan R. Root control of leaf cadmium accumulation in tobacco[J]. Tobacco Science 1988, 32: 88-91.
[13] Ruso J, Zapata J, Hernadez M, et al. Toxic metals accumulation and total soluble phenolics in sunflower and tobacco plants. Minerva biological technology,2001, 13 (2): 93-95.
[14] 刘海伟,石屹,梁洪波. 烟草和卷烟中重金属迁移分配的研究进展[J]. 中国农业科技导报,2013,15(2):153-158.
[15] 侯冬岩,回瑞华,李铁纯,等. 电感耦合等离子体质谱法(ICP-MS)同时测定正山小种红茶中18种微量元素[J]. 中国无机分析化学,2012,2(2):52-56.
[16] 王凯荣,曲伟,刘文龙,等. 镉对花生苗期的毒害效应及其品种间差异[J]. 生态环境学报,2010,19(7):1653-1658.
[17] 李新博,谢建治,李博文,等. 印度芥菜-苜蓿间作对镉胁迫的生态响应[J]. 应用生态学报,2009,20(7):1711-1715.
[18] 吴玉萍,杨虹琦,徐照丽,等. 重金属镉在烤烟中的累积分配[J]. 中国烟草科学,2008,29(5):37-39.
[19] Wagner G J, Yeargan R. Variation in cadmium accumulation potential and tissue distribution of cadmium in tobacco[J]. Plant Physiology, 1986,82(1):274-279.
[20] 袁祖丽. Cd,Pb 污染对烤烟生理特性及生长发育的影响[D]. 郑州:河南农业大学,2005.
[21] Clarke B, Brennan E. Differential cadmium accumulation and phytotoxicity in sixteen tobacco cultivars[J]. Journal of the Air and Waste Management Association, 1989, 39: 1319-1322.
[22] 吴启堂,陈卢,王文寿.水稻不同品种对Cd吸收累积的差异和机理研究[J].生态学报,1999,19 (1):104-107.
[23] 李坤权,刘建国,陆小龙,等. 水稻不同品种对镉吸收及分配的差异[J]. 农业环境科学学报,2003,22(5):529-532.
[24] 张金彪,黄维南,柯玉琴. 草莓对镉的吸收积累特性及调控研[J]. 园艺学报,2003,30 (5):514-518
[25] Murty K S N. Lead and cadmium content of Indian flue-cured tobacco[J]. Plant and Soil, 1986, 95(2):281-284
[26] Frank R, Braun, et al. Insecticide residues and metal contents in flue-cured tobacco and tobacco soil of southern Ontario 1976-1978[J]. Tobacco. Science,1980, 24: 136-140.
[27] Frank R, Braun, et al. Pesticide residues and metal contents in flue-cured tobacco and tobacco soils of southern Ontario,Canada 1980-1985[J]. Tobacco Science. 1986, 24:40-45.
[28] Wang Min, Zou Jinhua, Duan Xuchuan, et al. Cadmium accumulation and its effects on metal uptake in maize(Zea mays L.)[J]. Bioresource Technology, 2005, 98(1):82-88.
[29] Barazani O, Dudai N, Khadka U R, et al. Cadmium accumulation in Allium schoenoprasum L. grown in an aqueous medium[J]. Chemosphere, 2004, 57(9):1213-1218.
[30] Lichtenberger O, Neumann D. Analytical electron microscopy as a powerful tool in plant cell biology:examples using electron energy loss spectroscopy and X-ray microanalysis[J]. European Journal of Cell Biology, 1997, 73(4): 378-386.
[31] Bringezu K, Lichtenberger O, Leopold I, et al. Heavy metal tolerance of Silene vulgaris[J]. Journal of Plant Physiology, 1999, 154(4):536-546.
[32] Webb M A. Cell-mediated crystallization of calcium oxalate in plants[J]. The Plant Cell, 1999, 11(4):751-761.
[33] Neumann D, Zur Nieden U, Lichtenberger O, et al. How Does Armeria maritima Tolerate High Heavy Metal Concentrations[J]. Journal of Plant Physiology, 1995,146(5):704-717.
[34] Choi Y E, Harada E, Wada M, et al. Detoxification of cadmium in tobacco plants: formation and active excretion of crystals containing cadmium and calcium through trichomes[J]. Planta, 2001, 213(1): 45-50.
中图分类号:S572.06
文章编号:1007-5119(2015)02-0099-06
DOI:10.13496/j.issn.1007-5119.2015.02.018
基金项目:国家烟草专卖局特色优质烟叶开发重大专项“低危害烟叶开发”(TS-06-20110037);国家烟草专卖局创新平台经费专项(201304);中央级公益性科研院所基本科研业务费专项(22060302)
作者简介:贺远,男,在读博士,研究方向为植物生理与作物营养。E-mail:heyuan818@163.com。*通信作者,E-mail:wss620128@126.com
收稿日期:2014-02-16 修回日期:2015-01-20
Effects of Cadmium on the Growth of Tobacco and the Characteristics of Cadmium Accumulation by Tobacco
HE Yuan1,2, LIU Haiwei1, SHI Yi1, LU Ying1,2, CHANG Shuai1,2, WANG Shusheng1*
(1. Key Laboratory of Tobacco Biology and Processing, Ministry of Agriculture, Tobacco Research Institute, CAAS, Qingdao 266101, China; 2 Graduate School of CAAS, Beijing 100081, China)
Abstract:Tobacco is one of the most important crops in China. Pot experiments were carried out to study the effects of different concentrations of Cd (0, 1.2, 2.4 and4.8 mg/kg) on the tobacco growth and the characteristics of Cd distribution and uptake by tobacco. The results show that, the dry matter weight of tobacco leaves significantly decreased with the increase of the Cd concentration at the same growth stages (p< 0.01). The dry matter weight of stem increased firstly and then sharply decreased. The dry matter weight of root gradually decreased at the early growth stage (30 d and 45 d), while it slightly increased at first and then decreased rapidly at the later growth stage (60 d and 75 d). The Cd content of leaves significantly higher than that of stems and roots except the control treatment. The Cd content of control performed as: root > stem > leaf. The content of Cd in tobacco leaves showed as: lower leaf >> middle leaf > upper leaf. The accumulation rate of Cd increased in different parts of tobacco with the increase of the Cd concentration. Cd accumulation rate of tobacco showed as: rapid accumulation- quick reduction -slow accumulation.
Keywords:tobacco; cadmium; dry matter weight; accumulation rate
