不同持续时间中等强度运动对去卵巢大鼠骨量及骨微结构的影响
2015-04-15陈晓红郑陆于召栋
陈晓红 郑陆 于召栋
首都体育学院(北京100191)
随着社会老龄化程度的加深, 老年性疾病之一的骨质疏松症的发病率逐年提高[1]。而中老年女性由于卵巢功能逐渐减退,体内激素水平明显下降,绝经后女性骨质疏松的发病率明显高于同年龄段男性。 因此,绝经后女性骨质疏松的防治引起临床医生和科研人员关注。而运动作为一种有效手段,对骨健康具有明显的促进作用[2,3]。已有研究证实,中等强度跑台运动可以显著增加骨量[4,5]。为了甄别不同运动持续时间的作用效应,本研究以去卵巢大鼠为实验对象, 以运动作为唯一干预因素, 观察不同持续时间跑台运动对骨量及骨微结构的影响,以明确不同运动持续时间的作用效果,为中老年女性健骨运动方案的选择提供实验依据。
1 材料及方法
1.1 实验动物及分组
3月龄雌性Sprague-Dawley大鼠, 购自北京维通利华实验动物技术有限公司(SCXK京2012-0001),体重270 ± 50 g,分笼饲养,维持12/12小时明暗环境,自由取食和饮水。 实验开始前所有大鼠进行为期1周的适应性训练,每天以10 m/min的速度训练10 min,并于每天固定时间进行阴道脱落细胞学检查,观察动情周期变化,筛选出动情周期正常且能适应跑台运动的大鼠, 进行手术、随机分组、编号等。 所有大鼠术后3天开始正式实验。
(1)去卵巢组(OVX组):大鼠行OVX手术,术后3天将其随机分为OVX-4组、OVX-8组、OVX-12组,每组10只,分别在4周、8周及12周后处死,并进行取材及指标测试(BMD、骨组织形态计量学指标)。
(2)假手术组(SHAM组):大鼠进行假手术。手术步骤同OVX, 不进行卵巢切除。 术后3天将其随机分为SHAM-4组,SHAM-8组,SHAM-12组,每组10只,分别在4周、8周及12周后处死, 并进行取材及指标测试(BMD、骨组织形态计量学指标)。
(3)去卵巢+运动组(OVX+T组):大鼠行OVX手术,在术后3天将其随机分为OVX+T-4组、OVX+T-8组、OVX+T-12组,每组10只,分别完成4周、8周、12周的运动,分别在相应周运动结束后处死,并进行取材及指标测定(BMD、骨组织形态计量学指标)。
1.2 去卵巢模型的建立
大鼠用10%的水合氯醛(0.3 ml/100 g)麻醉后,取侧卧位,双侧腹部手术部位剃毛,用碘酒、酒精局部消毒皮肤。 分别自离肋下1.5 cm与离腰椎1.0 cm相交处做纵行切口约1 cm,切开皮肤,分离皮下组织,切开肌层,即可见位于两侧肾脏外下方呈菜花样淡粉红色的卵巢,然后轻轻镊起卵巢,结扎后切除之,缝合皮肤,另侧以同样方法做卵巢去除术。 并在去卵巢后第3~13天连续10天对去卵巢大鼠进行阴道脱落细胞学检查, 监测大鼠的动情周期,以评定去卵巢手术是否成功。
1.3 运动负荷方案
运动负荷的设定参照Bedford等[6]报道的有氧运动负荷标准及郑陆等[7]前期的动物实验负荷标准。采用段氏PT2000型鼠类跑台(杭州钱江科技公司)进行运动。运动方案为:起始跑速分别为16 m/min,持续时间均为30 min,跑台倾斜度均为0°,隔日增加跑速3 m/min,运动持续时间增加10 min,第2周起跑速为20 m/min,持续时间为60 min,跑台倾斜度为5°,每周运动5天,休息2天,连续12周。
本研究操作过程严格遵守 《北京市实验动物管理条例》。 本实验符合医学科学国际组织理事会(CIOMS)和世界卫生组织(WHO)制定的《涉及动物的生物医学研究的国际伦理学准则》,实验中尽量避免不适、痛苦或使痛苦最小化,必要时进行镇静、止痛、麻醉或无痛苦处死。
1.4 指标测试
1.4.1 骨密度测试
以美国GE公司生产的Lunar Prodigy 型双能X线骨密度仪(Dual Energy X-ray Absorptiometry, DXA)进行大鼠全身骨密度(bone mineral density, BMD)的测定,并用enCORE(小动物分析软件-版本10.50.086)进行分析。每日实验前,以随机附带的模块对DXA进行质量控制检测。 测试时,使麻醉好的大鼠取俯卧位,四肢展平,尾巴抻直置于DXA扫描床上。 大鼠于处死前称重,根据体重采用腹腔注射10%水合氯醛(0.3 ml/100 g)进行麻醉。麻醉成功后,将其置于双能X线骨密度仪上,测定全身的骨密度。
1.4.2 骨形态计量学
大鼠于处死前14、13天行腹部皮下注射四环素(25 mg/ kg); 于处死前4、3天行颈部皮下注射钙黄绿素(5 mg/kg)。 大鼠麻醉后处死,取右胫骨,去除肌肉等软组织后,置于70%的乙醇中固定,每3~7天更换一次乙醇,用于骨形态计量学测试。
骨组织形态计量学 (Bone Histomorphomertry),是一种对不脱钙骨组织进行定量描述的方法, 主要通过对显微镜下骨组织二维平面的测量,基于体视学原理,推导出三维的骨结构和骨重建的参数。由此,可以在组织学层面上,直接观察骨组织的变化,并可进行定量分析;还可在细胞学层面上,对骨小梁表面的成骨和破骨细胞进行定量分析。 此外,利用四环素、钙黄绿素可与钙特异性结合并沉积于骨矿化前沿的特性, 对活体依次注射四环素、钙黄绿素等荧光物质进行标记,并把时间因素标记在骨的重建过程中, 可获得有关骨形成的静动态数据,进而对骨形成过程进行定量分析。主要的技术步骤包括:骨组织样本的制备(活体的荧光物质标记→取材→固定→脱水→包埋→制片→染色→封片)→测量(在光镜、荧光显微镜下观察、分析)→获得静态和动态参数[8]。
测量范围:于右胫骨生长板往下画出1 mm,取2.0 mm×2.0 mm区域进行测量。 本实验所有参数均采用国际通用的标准骨组织形态计量学术语命名。 用图形分析软件测出测量参数, 然后通过软件自动计算骨形态计量学参数。
骨形态计量学参数主要包括静态参数和动态参数。 静态参数系描述骨小梁数量和形态结构的常用指标,常被用于各研究因素的有效性的评价,它包括4个指标BV/TV、Tb.Th、Tb.N和Tb.Sp。 BV/TV是指单位骨组织面积内骨小梁所占面积,可以客观、准确地反映干预因素对松质骨骨小梁的影响。 骨小梁面积百分比(BV/TV)、数目(Tb.Th)、厚度(Tb.N)均反映骨小梁的形态和结构,一般随着骨小梁面积百分比(BV/TV)、数目(Tb.Th)、厚度(Tb.N)的降低,骨小梁的分离度(Tb.Sp)增加,骨小梁会逐渐变稀疏。动态参数分为骨形成参数和骨吸收参数, 骨形成参数包括每毫米成骨细胞数(Ob.N/mm)、标记周长百分数(%L.Pm)、矿化沉积率(MAR)以及骨形成率(BFR/BS);骨吸收参数为破骨细胞周长百分数(Oc.N/mm)。动态参数不仅可以用于动态评价骨骼的变化,以确定不同干预方式对骨的影响效应,还可用于解释静态参数变化的原因,了解骨代谢相关机制。
1.4 数据处理
数据统计分析采用SPSS 16.0软件处理, 测量结果用平均数±标准差(mean±SD)表示。 以单因素方差分析(ANOVA) 对同一个时间点各干预方式间以及同种干预方式各个时间点间的实验数据进行显著性检验;P<0.05表示有显著性差异。
2 研究结果
2.1 骨密度的变化
随着实验时间的增加,SHAM各组大鼠全身骨密度无显著性差异(P>0.05)。 与同期SHAM组相比,OVX各组大鼠骨密度显著降低 (P<0.05)。 与同期OVX相比,OVX+T-4组无显著变化(P>0.05),而OVX+T-8及OVX+T-12组均显著增加 (P<0.01)。 与同期SHAM组相比,OVX+T-4组仍显著降低(P<0.05),但OVX+T-8及OVX+T-12组BMD数值虽仍低于同期SHAM组, 但已无显著性差异(P>0.05)。 见表1。
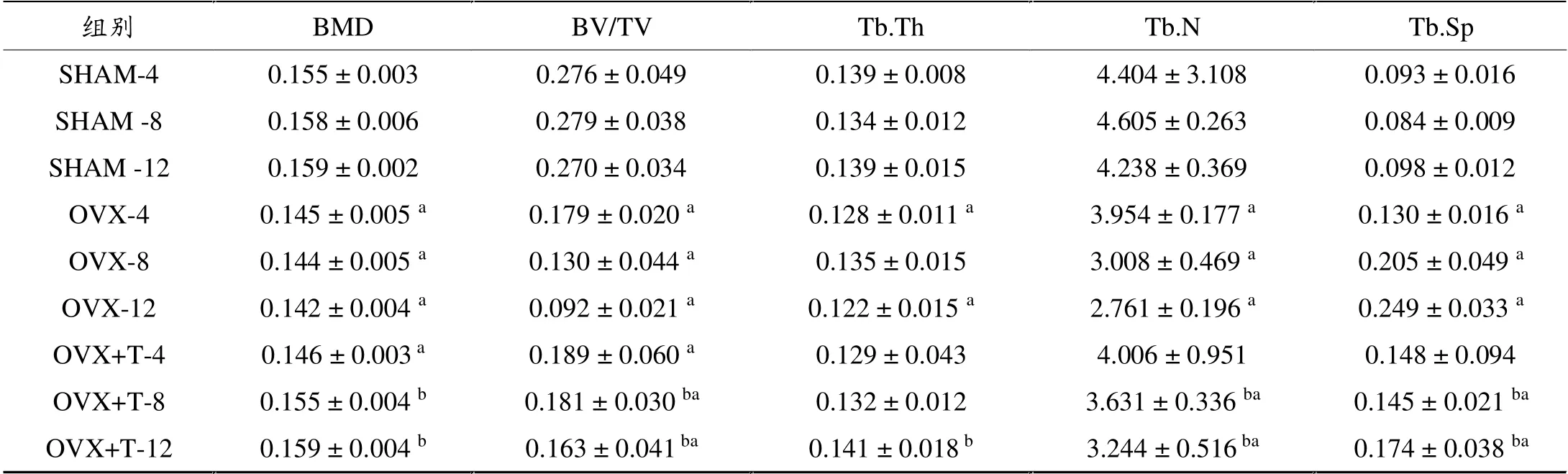
表1 各组大鼠骨形态计量学静态参数的变化
2.2 骨形态计量学静态参数的变化
随着实验时间的增加,SHAM各时间组间大鼠骨形态计量学各静态参数 (BV/TV、Tb.Th、Tb.N和Tb.Sp)无显著性差异(P>0.05)。 与同期SHAM组相比,OVX组的BV/TV、Tb.Th和Tb.N显著降低(P<0.05),Tb.Sp显著增加(P<0.05),且随去卵巢时间的增加,表现出BV/TV和Tb.N逐渐下降、Tb.Sp逐渐上升的态势。 与同期OVX组相比,OVX+T-4组静态参数无显著变化;OVX+T8组BV/TV、Tb.Th显著升高,而Tb.Sp显著下降;OVX+T12组BV/TV、Tb.Th、Tb.N显著升高(P<0.05),Tb.Sp显著下降(P<0.05);但与同期SHAM组相比,OVX+T组BV/TV显著降低(P<0.05),而Tb.Sp显著升高(P<0.05)。见表1。各组大鼠胫骨骨微结构的变化如图1所示。

图1 各组大鼠胫骨骨结构变化
2.3 骨形态计量学动态参数的变化
随着实验时间的增加,SHAM各组大鼠骨形态计量学各动态参数无显著性差异;OVX组大鼠与SHAM组大鼠的动态参数比较结果显示,OVX组骨形成参数(Ob.N/mm、%L.Pm、BFR/BS)及骨吸收参数(Oc.N/mm)均显著高于同期SHAM组;OVX+T组与OVX组的动态参数比较结果显示,OVX+T-4、8、12组的骨吸收指标(Oc.N/mm)显著低于同期OVX组,骨形成参数无显著性差异。OVX+T组与SHAM组相比,OVX+T组骨形成参数(Ob.N/mm、%L.Pm、BFR/BS)显著高于同期SHAM组。 见表2。

表2 各组大鼠骨形态计量学动态参数的变化
3 分析讨论
3.1 去卵巢大鼠骨密度及骨形态计量学指标的变化
去卵巢大鼠模型已是一种被公认的研究绝经后骨质疏松的标准模型, 这种由于雌激素减少所致大鼠的骨质疏松与人类绝经后的骨量丢失有许多相似之处[9]。因此, 常用去卵巢大鼠模型研究绝经后骨质疏松的防治。 本研究即采用此模型研究不同持续时间中等强度跑台运动对绝经后骨质疏松的干预效果。
本研究中,SHAM-4、SHAM-8、SHAM-12组大鼠全身骨密度分别为0.155、0.158、0.159,三组间无显著性差异,且SHAM各时间组骨形态计量学静态参数和动态参数均无显著性变化, 说明正常大鼠在这段时间内骨量和骨结构均无显著变化,处于稳定状态。OVX-4、OVX-8、OVX-12组骨密度均值分别为0.145、0.144和0.143,显著低于同期SHAM各时间组。
有研究认为,雌性大鼠在去卵巢后,骨骼在缺乏雌激素保护的状态下,松质骨较皮质骨更早出现改变,且变化也更明显[9]。因此,本研究采用大鼠右胫骨上段(松质骨)作为感兴趣区,进行骨形态计量学测量。 本研究发现,与SHAM组相比,OVX-4组大鼠骨量(BV/TV)和骨微结构(Tb.Th、Tb.N、Tb.Sp)出现显著变化,并随去卵巢时间的增加,骨量逐渐下降(BV/TV),骨微结构逐渐遭到破坏,骨小梁变稀疏、纤细,分离度增加(Tb.Th、Tb.N、Tb.Sp),如图1所示。 松质骨动态参数亦出现显著变化,OVX-4、OVX-8、OVX-12周大鼠, 骨形成(Ob.N/mm、%L.Pm、BFR/BS)及骨吸收(Oc.N/mm)指标均显著高于同期SHAM各时间组,说明去卵巢大鼠骨形成和骨吸收均显著增加,骨代谢处于高转换状态。以上结果与以往报道的研究结果一致[10]。 由此可见,本研究中的去卵巢大鼠模型建造成功。
3.2 不同运动持续时间对去卵巢大鼠骨密度的影响
DXA是近年来比较公认的一种快速精确测量骨密度( bone mineral density, BMD)的方法[11]。本研究采用此方法测量大鼠全身骨密度, 以研究不同持续时间跑台运动对大鼠骨量的影响。
运动作为一种安全、经济和有效的手段,对骨质疏松的干预效果已经得到广泛认可。研究表明,适宜的运动可以增加对骨骼的机械性刺激,提高骨代谢水平,使生长期骨量增加,提高峰值骨量[12,13];使成年期骨量保持,减少随年龄增长的骨丢失[14,15];对中老年人群特别是女性骨骼的影响表现为, 延缓骨量丢失的效应高于骨量提高的效应,预防和改善绝经后骨质疏松,降低骨折风险[16-18]。 对去卵巢大鼠及老龄大鼠的研究亦发现,运动可以补偿由于年龄增加所导致的骨量丢失[19,20]。美国运动医学会建议中老年人采用的健骨运动方式为有氧运动,如负重行走、跑步、上下楼梯等,也可采用中等强度的抗阻运动[21]。 然而,决定运动量的基本要素——运动持续时间和运动强度的不同选择搭配, 将导致运动效果的不同。研究认为,以40%~80%最大摄氧量的低及中等强度运动能使骨量增加, 但如果运动强度超过80%最大摄氧量,反而使骨量减少[15,22,23]。 可见,不同强度运动对骨骼产生的效应不尽相同。有研究报道,一次适量健骨运动的持续时间应在有氧运动范围内,即30~60分钟[24]。 而究竟以多长时间周期进行有氧运动才会出现骨量增加的良性效应,尚未见报道。
本研究采用20m/s、坡度为5°跑台运动、每天运动60分钟、每周5次的中等强度运动[6],观察持续4周、8周和12周不同运动时间、均一运动强度的运动效果,结果发现,4周中等强度跑台运动对去卵巢大鼠骨密度无明显影响;而当运动时间持续至8周,运动组大鼠的骨密度即显著高于同期OVX组,且显著高于运动4周组,说明持续8周的中等强度跑台运动即可使去卵巢大鼠骨密度显著增加;当运动时间持续至12周时,运动组大鼠骨密度的变化与运动8周组相似, 不仅高于同期OVX组,且显著高于运动4周组, 但与运动8周组比较无显著差异, 说明持续12周的中等强度跑台运动对去卵巢大鼠骨密度的增加效果与运动8周相似,不再有统计学意义的增长,提示增长速度放缓或趋于平台维持期,本研究所采取的中等强度运动形式,运动持续时间达到8周即可以出现全身骨量增加的显著效果。
3.3 递增负荷运动对骨微结构的影响
本研究中,运动4周组大鼠各静态参数(BV/TV、Tb.Th、Tb.N和Tb.Sp) 与同期OVX相比, 均未出现显著变化,此结果与同期全身骨密度的结果一致。 对运动4周组大鼠动态参数的分析发现,骨吸收指标(Oc.N/mm)显著低于同期OVX组,骨形成参数无显著性差异。 也就是说,4周中等强度跑台运动使骨吸收降低, 而对骨形成无显著影响。 由此可见,4周中等强度运动尚未对去卵巢大鼠的全身骨量和骨微结构产生明显影响, 但从动态参数可以看出,4周运动对骨代谢的影响已经初步显示效果, 其可以在一定程度上抑制去卵巢大鼠的骨吸收,但可能由于干预时间较短,还未能影响到大鼠的骨量和骨微结构。
随着运动时间的增加,运动8周组大鼠静态参数出现显著变化,BV/TV、 Tb.Th高于同期OVX组,Tb.Sp显著下降。 动态参数也出现显著变化, 骨吸收指标(Oc.N/mm)显著低于同期OVX组,骨形成参数无显著性差异。运动至12周时,静态参数和动态参数的变化与运动8周时基本一致。 运动8周及运动12周组全身骨密度均显著高于同期OVX组。 说明当中等强度跑台运动周期时间持续至8周及以上时,其对骨骼的正性刺激作用逐渐显现,骨密度、骨小梁面积、厚度及数目均增加,骨小梁分离度降低。 骨骼的这种正性变化可能是骨骼在运动负荷刺激下所产生的适应性变化。 对动态参数的分析可发现, 运动负荷刺激可有效抑制去卵巢大鼠松质骨的骨吸收,从而减缓去卵巢所导致的骨量丢失。对OVX+T及SHAM组的骨形态计量学参数分析发现,运动各组骨形成参数(Ob.N/mm、%L.Pm)显著高于同期SHAM组,可能是由于大鼠去卵巢后的高代谢状态所导致; 骨吸收参数(Oc.N/mm)在运动4周和8周组与同期SHAM组无显著差异,在12周时明显低于SHAM组,进一步说明中等强度的跑台运动可有效抑制去卵巢大鼠的骨吸收。 由此可见,8周及以上的跑台运动不仅可以显著抑制去卵巢大鼠的骨吸收, 还能够明显改善由于去卵巢所导致的骨量下降及骨微结构破坏, 对骨骼具有一定的保护作用。
但值得注意的是,虽然8周和12周运动组大鼠骨小梁面积百分率增高、 骨小梁数目增多、 骨小梁厚度增加,骨小梁分离度降低,但与同期SHAM组相比,仍有显著差距。 而此时,运动8周和12周组大鼠的全身骨密度与同期SHAM相比已无统计学差异,骨密度与骨形态计量学结果出现不一致性变化, 可能是由于骨形态计量学是在大鼠胫骨组织学层面上进行的定量分析, 其测试结果更为直观、准确,但其数据代表大鼠局部而非全身骨骼的变化;而对大鼠全身的骨密度测试,是通过双能X线扫描的方法,其虽被认为是人体骨质疏松评价的金标准,但对于大鼠而言,大鼠个体间骨密度测量值相差不大,可能其精确度略差于骨形态计量学。综合以上研究结果,我们认为,持续8周以上的中等强度跑台运动虽然在一定程度上可以减缓去卵巢大鼠骨量的丢失,保持骨小梁原有的立体网状结构,使骨小梁的厚度增加,但其作用有限,不能完全对抗去卵巢所导致的骨量丢失及骨微结构破坏。
4 小结
持续4周的中等强度跑台运动可抑制去卵巢大鼠骨吸收, 但尚未对去卵巢大鼠的密度和骨微结构产生明显影响;持续8周及以上的中等强度跑台运动不仅可以显著抑制去卵巢大鼠的骨吸收, 还能够明显改善由于去卵巢所导致的骨密度下降及骨微结构破坏。 提示跑步运动对绝经后女性机体骨代谢具有积极影响效应,可有效抑制骨吸收,有助于减缓年龄增加所导致的骨量降低,而选取的运动持续时间应在8周以上。
[1] Khosla S and Riggs BL. Pathophysiology of age-related bone loss and osteoporosis. Endocrinol Metab Clin North Am,2005, 34(4): 1015-1030, xi.
[2] Sumida S, Iwamoto J, Uenishi K, et al. One-year changes in bone mineral density and bone turnover markers in premenopausal amateur runners:A prospective study. Keio J Med,2014 [Epub ahead of print].
[3] Zhao R, Zhao M, and Zhang L. Efficiency of jumping exercise in improving bone mineral density among premenopausal women: A meta-analysis. Sports Med, 2014 [Epub ahead of print].
[4] Huang TH, Chang FL, Lin SC, et al. Endurance treadmill running training benefits the biomaterial quality of bone in growing male Wistar rats. J Bone Miner Metab, 2008, 26(4):350-357.
[5] Joo YI, Sone T, Fukunaga M, et al. Effects of endurance exercise on three-dimensional trabecular bone microarchitecture in young growing rats. Bone, 2003, 33(4): 485-493.
[6] Bedford TG, Tipton CM, Wilson NC, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures. J Appl Physiol, 1979, 47(6): 1278-1283.
[7] 郑陆, 潘力平, 隋波, 等. 运动性动情周期紊乱动物模型的建立. 山东体育学院学报, 2005, 21(2): 46-49.
[8] 陈晓红, 郑陆, 朱一力, 等. 长期递增负荷对雌性大鼠胫骨上段骨组织形态计量学的影响. 中国运动医学杂志, 2011,30(11): 1012-1017.
[9] Kalu DN. The ovariectomized rat model of postmenopausal bone loss. Bone Miner, 1991, 15(3): 175-191.
[10] 章晓霜, 高顺生, 李青南. 不同强度运动对去卵巢大鼠骨量的影响及机理. 中国运动医学杂志, 2001, 20 (2): 1478-1501.
[11] Watts NB. Fundamentals and pitfalls of bone densitometry using dual-energy X-ray absorptiometry (DXA). Osteoporos Int, 2004, 15(11): 847-854.
[12] Nurmi-Lawton JA, Baxter-Jones AD, Mirwald RL, et al. Evidence of sustained skeletal benefits from impact-loading exercise in young females: a 3-year longitudinal study. J Bone Miner Res, 2004, 19(2): 314-322.
[13] Nichols DL, Sanborn CF, Essery EV. Bone density and young athletic women. An update. Sports Med, 2007, 37(11): 1001-1014.
[14] Borer KT. Physical activity in the prevention and amelioration of osteoporosis in women : interaction of mechanical, hormonal and dietary factors. Sports Med, 2005, 35(9): 779-830.
[15] Iwamoto J, Takeda T, Sato Y. Effect of treadmill exercise on bone mass in female rats. Exp Anim, 2005, 54(1): 1-6.
[16] Karlsson MK. Physical activity, skeletal health and fractures in a long term perspective. J Musculoskelet Neuronal Interact,2004, 4(1): 12-21.
[17] Engelke K, Kemmler W, Lauber D, et al. Exercise maintains bone density at spine and hip EFOPS: a 3-year longitudinal study in early postmenopausal women. Osteoporos Int, 2006,17(1): 133-142.
[18] Ma D, Wu L, He Z. Effects of walking on the preservation of bone mineral density in perimenopausal and postmenopausal women: a systematic review and meta-analysis. Menopause,2013, 20(11): 1216-1226.
[19] Beyer RE, Huang JC, and Wilshire GB. The effect of endurance exercise on bone dimensions, collagen, and calcium in the aged male rat. Exp Gerontol, 1985, 20(6): 315-323.
[20] Notomi T, Okimoto N, Okazaki Y, et al. Tower climbing exercise started 3 months after ovariectomy recovers bone strength of the femur and lumbar vertebrae in aged osteopenic rats. J Bone Miner Res, 2003, 18(1): 140-149.
[21] American College of Sports Medicine, Chodzko-Zajko WJ,Proctor DN, et al. American College of Sports Medicine position stand. Exercise and physical activity for older adults.Med Sci Sports Exerc, 2009, 41(7): 1510-1530.
[22] Nordsletten L, Kaastad TS, Madsen JE, et al. The development of femoral osteopenia in ovariectomized rats is not reduced by high intensity treadmill training: a mechanical and densitometric study. Calcif Tissue Int, 1994, 55(6): 436-442.
[23] 陈晓红, 郑陆, 王智强. 过度运动致骨量降低动物模型的建造. 中国运动医学杂志, 2009, 28(6): 667-671.
[24] Hatori M, Hasegawa A, Adachi H, et al. The effects of walking at the anaerobic threshold level on vertebral bone loss in postmenopausal women. Calcif Tissue Int, 1993, 52 (6): 411-414.
